Министерство образования и науки Республики Башкортостан ГАПОУ Уфимский топливно-энергетический колледж
Специальность: 18.02.12
Практическая работа № 1
Решение расчетных задач на тему «Анализ неорганических продуктов»
Руководитель
___________Файзуллина С.Р.
«__»______ 2022 г
Разработчик
___________Суюндукова А.М.
«__»______ 2022 г
Практическая работа № 1
Тема: Решение расчетных задач на тему «Анализ неорганических продуктов»
Цель: изучить анализ неорганических продуктов, используя ГОСТ 2184-2013 «Кислота серная техническая» и провести расчет задач по теме «Анализ неорганических продуктов».
Задачи практической работы:
Изучить теоретические сведения производства кислоты серной технической.
Составить алгоритм выполнения анализа.
Выполнить расчёты и сделать выводы.
Теоретическая часть
Неорганические вещества — простые вещества и химические соединения, не являющиеся органическими, то есть, не содержащие в своей основе углерод, а также некоторые углеродсодержащие соединения. Неорганические вещества не имеют характерного для органических веществ углеродного скелета.
Кислота серная техническая — сильная неорганическая кислота, отвечающая высшей степени окисления серы. При обычных условиях концентрированная серная кислота — тяжёлая маслянистая жидкость без цвета и запаха, с сильнокислым «медным» вкусом.
Серной кислотой называют не только моногидрат H2SO4, но и его водные растворы (H2SO4+ H2O), а также растворы SO3 в моногидрате (олеум H2SO4+ SO3). Основные виды серной кислоты, выпускаемые российскими заводами:
– башенная, содержащая 75% H2SO4 в смеси с водой;
– контактная, содержащая 92,5-94% H2SO4 в смеси с водой;
– олеум, содержащий 18,5-24% SO3 в смеси с H2SO4.
Производство серной кислоты осуществляется в основном двумя методами: нитрозным; контактным. В промышленности серную кислоту получают окислением диоксида серы (сернистый газ, образующийся в процессе сжигания элементарной серы, серного колчеданаили сероводород-содержащих газов, поступающих с установок гидроочистки и систем отпарки кислых стоков) до триоксида (серного ангидрида) на твёрдом ванадиевом катализаторе в четыре ступени (данная реакция экзотермична, поэтому применяется промежуточное охлаждение после первого слоя с помощью трубных пучков, через которые подаётся воздух, и после следующих двух ступеней с помощью кольцевой трубы, имеющей большой диаметр, через которую подаётся воздух, над которой расположен дефлектор. Воздух нагнетается воздуходувками, часть горячего воздуха подаётся на горелочные устройства котлов, в которых производится сжигание сероводородсодержащих газов) последующим охлаждением и взаимодействием SO3 с водой. Получаемую данным способом серную кислоту также называют «контактной» (концентрация 92-94 %).Нитрозный способ заключаетсяв окислении диоксида серы диоксидом азота в присутствии воды.
Химизм производства серной кислоты
4FeS + 11O2= 8S02 +2 Fe2O3
2S02 + O2 =2S03
S03 + H2O =H2S04
Техническая серная кислота предназначается для производства удобрений, искусственного волокна, капролактама, двуокиси титана, этилового спирта, анилиновых красителей и целого ряда других производств.
Лабораторный анализ Определение массовой доли моногидрата в серной кислоте
Метод измерений - титриметрический, основан на нейтрализации серной кислоты раствором гидроксида натрия в присутствии индикатора метилового красного.
Подготовка к выполнению измерений
Приготовление дистиллированной воды, нейтральной по метиловому красному
К 1 дм3 дистиллированной воды добавляют 1-2 капли индикатора метилового красного и несколько капель раствора гидроксида натрия до перехода окраски от красной до оранжево-желтой.
Перекристаллизация янтарной кислоты
100 г янтарной кислоты взвешивают и растворяют при кипячении в 170 см воды. Горячий раствор быстро фильтруют на воронке с обрезанным носиком через фильтровальную бумагу и охлаждают при непрерывном перемешивании. Выделившиеся кристаллы отфильтровывают на воронке Бюхнера и повторно перекристаллизовывают, растворяя при кипячении в 140 см воды. Полученные кристаллы янтарной кислоты высушивают в сушильном шкафу при температуре (100±3)°С до постоянной массы.
Перекристаллизация щавелевой кислоты
50 г щавелевой кислоты взвешивают и растворяют при кипячении в 85 см воды. Горячий раствор быстро фильтруют на воронке с обрезанным носиком через фильтровальную бумагу и охлаждают, непрерывно перемешивая. Выделившиеся кристаллы отфильтровывают на воронке Бюхнера и повторно перекристаллизовывают, растворяя при кипячении в 70 см воды. Затем раствор охлаждают, непрерывно перемешивая. Выделившиеся кристаллы отфильтровывают на воронке Бюхнера, отжимают между листами фильтровальной бумаги и высушивают на воздухе в течение 30 мин (кристаллы не должны прилипать к стеклянной палочке). Кристаллы щавелевой кислоты переносят, рассыпая тонким слоем, в чашку Петри, помещают в сушильный шкаф и выдерживают при температуре (100±3)°С в течение 3 ч, периодически перемешивая. Чашку Петри с кристаллами щавелевой кислоты помещают в эксикатор с водой, где выдерживают не менее 2 сут. Крышка эксикатора должна быть закрыта негерметично (между крышкой и эксикатором прокладывают фильтровальную бумагу толщиной в 2-4 слоя). Полученные кристаллы гидрата щавелевой кислоты хранят в стеклянной банке с притертой пробкой. Препарат устойчив в течение месяца.
Установление коэффициента поправки раствора гидроксида натрия молярной концентрации эквивалента 0,5 моль/дм3 (0,5 н.).
1 г янтарной или щавелевой кислоты взвешивают, результат взвешивания записывают с точностью до четвертого десятичного знака, помещают в коническую колбу, растворяют в 50 см воды, не содержащей углекислоту и нагревают до 60°С-70°С. Содержимое колбы титруют в горячем состоянии раствором гидроксида натрия в присутствии 2 капель фенолфталеина до розового окрашивания, не исчезающего в течение 50-60 с.
Коэффициент поправки раствора гидроксида натрия вычисляют по формуле:
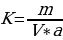
(1)
Гдеm - навеска установочного вещества, г;
V - объем раствора гидроксида натрия, израсходованного на титрование, см;
a - масса установочного вещества, соответствующая 1 см раствора гидроксида натрия молярной концентрации эквивалента точно 0,5 моль/дм3, г;
0,02952 г - для янтарной кислоты;
0,03152 г - для щавелевой кислоты.
Коэффициент поправки вычисляют с точностью до четвертого десятичного знака по каждой из трех навесок установочного вещества. Расхождение между максимальным и минимальным значениями коэффициента не должно превышать 0,001. Из вычисленных значений коэффициентов берут среднеарифметическое значение. Это значение коэффициента поправки должно быть равно 1,00±0,03. Если коэффициент поправки выходит за указанные пределы, то раствор соответственно закрепляют или разбавляют.
В случае возникновения разногласий при определении массовой доли моногидрата определение коэффициента поправки раствора гидроксида натрия проводят по щавелевой кислоте.
Значения массы установочного вещества (m) и объем NaOH, пошедший на титрование (V) представлены в таблице 1.
Таблица 1. Значения массы установочного вещества (m) и объем NaOH, пошедший на титрование (V).
| №варианта | m, г | V, см3 |
| 1; 13 | 1,0013; 1,0031; 1,0009 | 34,2; 34,0; 33,9 |
| 2; 14 | 1,0031; 1,0013; 1,0009 | 34,0; 34,2; 33,9 |
| 3; 15 | 1,0009; 1,0031; 1,0179 | 33,9; 34,0; 34,5 |
| 4; 16 | 1,0179; 1,0009; 1,0083 | 34,5; 33,9; 34,0 |
| 5; 17 | 1,0083; 1,0179; 1,0001 | 34,0; 34,5; 33,8 |
| 6; 18 | 1,0001; 1,0083; 1,0012 | 33,8; 34,0; 34,1 |
| 7; 19 | 1,0012; 1,0001; 1,0007 | 34,1; 33,8; 33,9 |
| 8; 20 | 1,0007; 1,0012; 1,0083 | 33,9; 34,1; 34,0 |
| 9; 21 | 1,0083; 1,0007; 1,0013 | 34,0; 33,9; 34,1 |
| 10; 22 | 1,0013; 1,0083; 1,0030 | 34,1; 34,0; 33,9 |
| 11; 23 | 1,0030; 1,0013; 1,0011 | 33,9; 34,1; 34,0 |
| 12; 24 | 1,0011; 1,0030; 1,0013 | 34,0; 33,9; 34,1 |
Выполнение измерений массовой доли моногидрата
Анализ проводят с использованием двух параллельных навесок.
0,7-1,0 г пробы серной кислоты взвешивают в пипетке Лунге-Рея (бюксе), результат взвешивания в граммах записывают с точностью до четвертого десятичного знака, переносят в коническую колбу вместимостью 250 см3, в которую предварительно помещают 50 см3 воды, нейтральной по метиловому красному, и титруют раствором гидроксида натрия в присутствии метилового красного до перехода красной окраски раствора в оранжево-желтую.
Обработка и вычисление результатов измерений
Массовую долю моногидрата в серной кислоте, %, вычисляют по формуле:
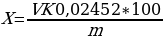
(2)
где V- объем раствора гидроксида натрия, пошедший на титрование, см;
K - коэффициент поправки раствора гидроксида натрия;
0,02452 - масса серной кислоты, соответствующая 1 см раствора гидроксида натрия молярной концентрации эквивалента точно 0,5 моль/дм, г;
m - навеска анализируемой кислоты, г.
За результат анализа принимают среднеарифметическое значение результатов двух (при необходимости четырех) параллельных определений п, допускаемое расхождение между которыми (максимальным и минимальным значениями для n = 4) при доверительной вероятности P = 0,95 не должно превышать значений предела повторяемости г для n = 2 или критического диапазона CR0,95 для n = 4, приведенных в таблице 4.
Значения массы серной кислоты (m) и объем раствора NaOH, пошедший на титрование представлены в таблице 2.
Таблица 2. Значения массы серной кислоты (m) и объем раствора NaOH, пошедший на титрование.
| № варианта | m, г | V, см3 |
| 1; 13 | 0,8596;0,8623 | 33,3; 34,6 |
| 2; 14 | 0,8623; 0, 8596 | 34,6; 33,3 |
| 3; 15 | 0,8119; 0,8623 | 31,6; 34,6 |
| 4; 16 | 0,8888; 0,8119 | 36,6; 31,6 |
| 5; 17 | 0,8533; 0,8888 | 33,7; 36,6 |
| 6; 18 | 0,8555; 0,8533 | 33,9; 33,7 |
| 7; 19 | 0,8602; 0,8555 | 34,0; 33,9 |
| 8; 20 | 0,8422; 0,8602 | 32,7; 34,0 |
| 9; 21 | 0,8887; 0,8422 | 36,7; 32,7 |
| 10; 22 | 0,8421; 0,8887 | 32,7; 36,7 |
| 11; 23 | 0,8745; 0,8421 | 36,5; 32,7 |
| 12; 24 | 0,8430; 0,8745 | 32,9; 36,5 |
Аппаратура, материалы, реактивы, растворы
Колбы 1,2-1000, 500, 100-2 по ГОСТ 1770.
Бюретка 1-1,2,3-2-50-0,1 по ГОСТ 29251.
Пипетки 1,2- 2-2, 25, 50 по ГОСТ 29169.
Цилиндры 1-25, 50, 500-2 по ГОСТ 1770.
Прибор 3-1,2 по ГОСТ 6859 для отбора и взвешивания летучих, агрессивных и ядовитых жидкостей (видоизмененная пипетка Лунге-Рея).
Спиртовка для запаивания ампул.
Стеклянная ампула вместимостью 2-3 см с длинным капилляром.
Стаканчик для взвешивания (бюкса) СВ - 14/8(или СН - 34/12) по ГОСТ 25336.
Колбы конические Кн-1-250-24/29 по ГОСТ 25336.
Склянка стеклянная толстостенная 45/27-500 см по ГОСТ 25336.
Пробка резиновая конусная.
Воронка Бюхнера по ГОСТ 9147.
Чашка Петри по ГОСТ 25336.
Склянка с тубусом (Бунзена) 1-0,5 по ГОСТ 25336.
Насос вакуумный или водоструйный лабораторный.
Вата гигроскопическая по ГОСТ 5556.
Кислота янтарная по ГОСТ 6341.
Кислота щавелевая по ГОСТ 22180.
Фенолфталеин (индикатор), спиртовой раствор с массовой долей 1%, приготовленный по ГОСТ 4919.1.
Метиловый красный (индикатор), спиртовой раствор с массовой долей 0,1%, приготовленный по ГОСТ 4919.1.
Натрия гидроокись по ГОСТ 4328, раствор молярной концентрации эквивалента 0,5 моль/дм (0,5 н.), приготовленный по ГОСТ 25794.1.
Характеристики
По физико-химическим характеристикам серная кислота должна соответствовать нормам, приведенным в таблице 3.
Таблица 3. Физико-химические характеристики серной кислоты.
| Наименование показателя | Норма для серной кислоты |
| Улучшенной
| Технической |
| 1 Массовая доля моногидрата (H2SO4), % | 92,5 – 94,0 | Не менее 92,5 |
Метрологические характеристики методики и диапазоны измерений приведены в таблице 4.
Таблица 4. Метрологические характеристики и диапазоны измерений.
| Диапазон измерений массовой доли моногидрата (H2SO4) | Показатель точности (границы абсолютной погрешности) ± Δ. массовая доля, при Р=0,95 | Показатель повторяемости (абсолютное среднеквадратическое отклонение повторяемости). массовая доля | Показатель воспроизводимости (среднеквадратическое отклонение воспроизводимости), массовая доля |
| От 73,0 до 99,9 включ. | 0,3 | 0,09 | 0,14 |
| От 73,0 до 99,9 включ. | 0,25 | 0,32 | 0,35 |
Задание
Рассчитать коэффициент поправки гидроксида натрия. Данные взять из таблицы 1. Расчет вести по янтарной кислоте.
Рассчитать массовую долю моногидрата в серной кислоте. Данные взять из таблицы 2.
Контрольные вопросы
Что такое моногидрат?
Назовите показатели качества серной кислоты?
Какое вещество является установочным при определении коэффициента поправки?
Что является сырьем в производстве серной кислоты?
Ответы на контрольные вопросы
Неорганические вещества — простые вещества и химические соединения, не являющиеся органическими, то есть, не содержащие в своей основе углерод, а также некоторые углеродсодержащие соединения.
Техническая серная кислота предназначается для производства удобрений, искусственного волокна, капролактама, двуокиси титана, этилового спирта, анилиновых красителей и целого ряда других производств.
Метод измерений - титриметрический, основан на нейтрализации серной кислоты раствором гидроксида натрия в присутствии индикатора метилового красного.
Янтарная или щавелевая кислота.
Производство серной кислоты осуществляется в основном двумя методами: нитрозным; контактным.