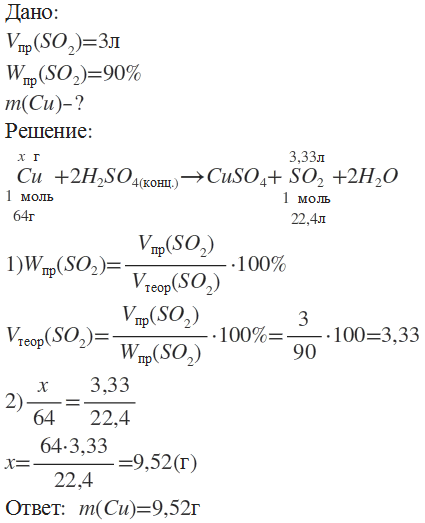Практическое занятие № 5. Решение задач по теме «Неорганические соединения»
Учебная цель: закрепить и обобщить теоретические и практические знания о неорганических соединениях.
Образовательные результаты, заявленные во ФГОС третьего поколения:
Обучающийся должен знать:
- классификацию неорганических соединений;
- химические свойства оксидов, кислот, оснований солей.
Обучающийся должен уметь:
- составлять управления химических реакций с участием основных классов неорганических соединений;
- называть продукты реакции;
- вычислять массу исходного вещества, если известно количество вещества одного из продуктов реакции.
Задачи практического занятия:
Закрепить теоретические знания о свойствах металлов.
Ответить на вопросы для закрепления теоретического материала.
Выполнить практические задачи.
Ответить на вопросы для контроля.
Обеспеченность занятия:
Учебно-методическая литература:
Справочная литература:
Тетрадь для практических и контрольных работ.
Калькулятор.
Ручка.
Краткие теоретические и учебно-методические материалы по теме практического занятия
Неорганические вещества делятся на простые и сложные.
Простыми неорганическими соединениями являются оксиды, основания и кислоты.
Оксидами называются соединения, состоящие из двух элементов, один из которых кислород.
Общая формула оксида – ЭХОУ.
Классификация оксидов. Оксиды подразделяются на основные, кислотные, амфотерные и безразличные.
Способы получения оксидов:
а) Горение и окисление простых веществ.
б) Горение и окисление сложных веществ.
в) Разложение некоторых сложных кислородсодержащих веществ (нерастворимых оснований, кислот, солей) при нагревании.
г) Взаимодействие металлов с водой при нагревании.
Химические свойства основных оксидов
а) Взаимодействие с водой. С водой взаимодействуют только оксиды щелочных и щелочно-земельных металлов:
б) Взаимодействие с кислотными оксидами
в) Взаимодействие с кислотами.
Химические свойства кислотных оксидов
а) Взаимодействие с водой
С водой взаимодействует подавляющее большинство кислотных оксидов (не взаимодействует SiO2) с образованием кислородсодержащей кислоты.
б) Взаимодействие с основными оксидами.
в) Взаимодействие с основаниями
Химические свойства амфотерных оксидов
Амфотерность означает проявление двойственной природы в отношении кислотно-основных свойств. Таким образом, амфотерные оксиды должны проявлять как свойства основных оксидов, так и свойства кислотных оксидов.
а) Взаимодействие с кислотными оксидами
В данном случае амфотерный оксид ведет себя как основный.
б) Взаимодействие с кислотами
В этом случае амфотерный оксид также ведет себя как основный.
в) Взаимодействие с основными оксидами
В данном случае амфотерный оксид ведет себя как кислотный.
г) Взаимодействие с основаниями
Амфотерный оксид ведет себя как кислотный:
Безразличные оксиды по отношению как к основным соединениям, так и к кислотным остаются инертными.
Соединения оксидов с водой называют гидроксидами. Гидроксиды обладают теми же кислотно-основными свойствами, что и оксиды, из которых они произошли. Гидраты основных оксидов проявляют основные свойства, гидраты амфотерных – амфотерные, а гидраты кислотных – кислотные. Первые два вида гидратов образуют один класс соединений – оснований, а последний вид – кислот.
Основаниями называют гидраты основных и амфотерных оксидов. В их состав входят одна или несколько гидроксильных групп.
Общая формула основания – Me(OH)n, где n – валентность металла.
Кроме того, к основаниям относится гидроксид аммония NH4OH.
Количество гидроксильных групп в основании определяет его кислотность.
Классификация оснований. Основания подразделяются на щелочи, нерастворимые основания. В последней группе выделяются амфотерные основания.
Щелочи – это основания щелочных и щелочно-земельных металлов и NH4OH; все они растворимы в воде. Например: NaOH, KOH, Ca(OH)2.
Остальные основания – нерастворимые основания, например: Cu(OH)2,
Fe(OH)2, Ni(OH)2, Cr(OH)2. Из нерастворимых оснований в отдельную группу выделяются амфотерные основания, которым соответствуют амфотерные оксиды, например: Be(OH)2, Zn(OH)2, Al(OH)3.
Способы получения оснований
а) Щелочи получают действием воды на оксиды щелочных и щелочноземельных металлов.
б) Щелочи получают также действием воды на щелочные и щелочно-земельные металлы.
в) Щелочи получают электролизом водных растворов солей.
г) Нерастворимые основания получают действием щелочей на соли.
Химические свойства
а) Электролитическая диссоциация. Щелочи подвергаются электролитической диссоциации с образованием аниона гидроксила, что обусловливает окраску индикаторов: фенолфталеина в малиновый цвет, лакмуса – в синий.
б) Взаимодействие с солями. Щелочи взаимодействуют с солями с образованием нерастворимых оснований или нерастворимых солей.
в) Щелочи взаимодействуют с амфотерными оксидами.
г) Все основания взаимодействуют с кислотами, с кислотными оксидами.
д) Все нерастворимые основания при нагревании разлагаются с образованием оксида и воды.
е) Амфотерные основания, кроме свойств, указанных для нерастворимых оснований, проявляют кислотные свойства: взаимодействуют с основными оксидами и щелочами.
Кислотами называются соединения, содержащие атомы водорода, способные давать катионы Н+ и замещаться атомами металлов или группами атомов (NH4+, ZnOH+, AlOH2+ и т.д.).
Общая формула кислоты – HnA, где n – валентность кислотного остатка А.
По числу атомов водорода (n) определяется основность кислоты (кислоты бывают одноосновными, двух-, трех- и четырехосновными).
Способы получения кислот
а) Кислородсодержащие кислоты получают действием воды на соответствующие кислотные оксиды (ангидриды).
б) Кислота (кислородсодержащая или бескислородная) получается реакцией обмена между ее солью и другой кислотой, если в результате реакции образуется летучая или малорастворимая или малодиссоциируемая кислота.
в) Бескислородные кислоты получают по реакции синтеза водорода с неметаллом.
Химические свойства кислот
а) Электролитическая диссоциация. Кислоты подвергаются электролитической диссоциации с образованием катиона Н+, что обусловливает окраску индикаторов: метилоранжа – в розовый цвет, лакмуса – в красный.
б) Кислоты взаимодействуют с металлами с образованием соли.
в) Кислоты взаимодействуют с основными и амфотерными оксидами с образованием соли и воды.
г) Кислоты взаимодействуют с основаниями с образованием соли и воды.
д) Кислоты взаимодействуют с солями, протекает реакция ионного обмена.
е) Разложение кислот. Некоторые кислоты разлагаются при нагревании (H2SiO3, HNO2), а некоторые – при комнатной температуре.
Соли – это продукты взаимодействия кислот с основаниями. Соль – это продукт замещения атомов водорода в кислороде на металл или продукт замещения гидроксильных групп в основании на кислотные остатки.
Общая формула соли – КХАУ,
где К – катион; А – анион.
Соли подразделяются на средние (нормальные) соли, которые являются продуктами полного замещения водорода кислоты на металл и полного замещения гидроксильных групп на кислотный остаток; кислые соли, которые являются продуктами неполного замещения водорода кислоты на металл, и основные, которые являются продуктами неполного замещения гидроксильных групп на кислотный остаток.
Реакции получения и химические свойства солей описаны при изучении соответствующих разделов кислот и оснований.
Вопросы для закрепления теоретического материала к практическому занятию
Приведите примеры получения оксидов.
Какими химическими свойствами обладают основные оксиды?
Какие способы получения оснований Вы знаете?
Задания для практического занятия:
Решить предложенные задачи.
Правильно оформить их в тетрадь для практических и контрольных работ.
Ответить на вопросы для контроля.
Отчитаться о выполненной работе преподавателю.
Задание 1
Решите задачу согласно варианту:
| Вариант 1 | Вариант 2 |
| При взаимодействии меди с концентрированной серной кислотой образовался газ объемом 33,6 л. Определить массу меди, вступившую в реакцию. | Сколько грамм оксида магния образуется при сжигании магния массой 12 г. |
Образец решения задания № 1
Определите, какая масса меди вступит в реакцию с концентрированной серной кислотой для получения оксида серы (IV) объёмом 3л (н.у.), если выход оксида серы (IV) составляет 90%.
Алгоритм решения
Дано:
Vпр(SO2) = 3 л
Wпр(SO2) = 90%
Найти: m(Cu) - ?
Решение:
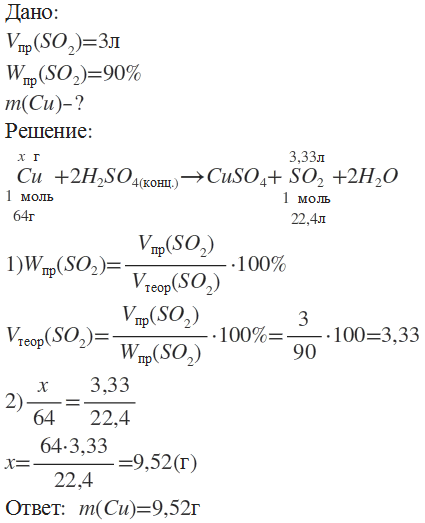
Ответ: m(Cu) = 9,52 г.
Задание 2
Решите задачу согласно варианту:
| Вариант 1 | Вариант 2 |
| Калий массой 3,9 г растворили в воде объемом 206 мл. Определите массовую долю полученного раствора. | Сколько грамм натрия прореагировало с водой, если при этом образовался газ объемом 4, 48 л. (н.у.) Сколько грамм гидроксида натрия получится при этом? |
Образец решения задания № 1
Рассчитать процентную концентрацию раствора, полученного растворением 80 г сахара в 160 г воды.
Алгоритм решения


Ответ: процентная концентрация составит 33,3%.
Задание 3
Решите задачу согласно варианту:
| Вариант 1 | Вариант 2 |
| Сколько грамм оксида кальция и воды необходимо для получения гашеной извести массой 7,4 г. | Сколько литров оксида углерода можно получить из известняка массой 25 г, с массовой долей примесей 20%. |
Образец решения задания № 3
Какую массу оксида кальция и какой объем углекислого газа (н.у.) можно получить при термическом разложении 20 г известняка, содержащего 80 % карбоната кальция?
Алгоритм решения


Ответ: m(CaO) = 8.96 г., V(CO2) = 3,58 л.
Вопросы для контроля
Перечислите основные химические свойства солей?
Запишите способы получения солей?
Запишите, где в вашей профессии и в жизни применяются соли.
Форма контроля выполнения практического задания:
Выполненная работа представляется преподавателю в тетради для выполнения практических и контрольных работ по дисциплине «Естествознание».
5