Тема 4 «Азотосодержащие органические соединения. Полимеры, пластмассы, волокна»
Практическое занятие № 8.
Амины, аминокислоты
Учебная цель: изучить основные химические свойства аминов и аминокислот.
Образовательные результаты, заявленные во ФГОС третьего поколения:
Обучающийся должен знать:
- основные химические свойства аминов и аминокислот.
Обучающийся должен уметь:
- составлять структурные формулы аминов и аминокислот;
- решать задачи с участием аминов и аминокислот.
Задачи практического занятия:
1. Закрепить теоретические знания о составе, строении и свойствах аминов и аминокилот.
2. Ответить на вопросы для закрепления теоретического материала.
3. Выполнить практические задачи.
4. Ответить на вопросы для контроля.
Обеспеченность занятия:
Учебно-методическая литература:
Справочная литература:
Тетрадь для практических и контрольных работ.
Калькулятор.
Ручка.
Краткие теоретические и учебно-методические материалы по теме практического занятия
Амины органические производные аммиака, в молекулах которого один, два или все три атома водорода замещены органическими радикалами.
По числу радикалов амины делятся на первичные, вторичные и третичные.
| Общая формула первичных аминов | Общая формула вторичных аминов | Общая формула третичных аминов |
|  | 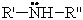 | 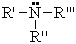 |
По типу простейших радикалов амины делятся на предельные, непредельные и ароматические.
Простейшие амины газы с запахом аммиака, более сложные жидкости с запахом рыбы, высшие твердые нерастворимые в воде вещества. Температуры кипения и растворимость в воде у аминов меньше, чем у соответствующих спиртов.
Химические свойства аминов
1. Горение:
4CH3NH2 + 9O2 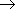 4CO2 + 10H2O +2N2
4CO2 + 10H2O +2N2
4C6H5NH2 + 31O2 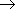 24CO2 + 14H2O + 2N2
24CO2 + 14H2O + 2N2
2. Взаимодействие с водой:
CH3NH2 + H2O  CH3NH3+ + OH
CH3NH3+ + OH
Анилин с водой практически не реагирует.
3. Взаимодействие с кислотами (основные свойства):
| 2CH3NH2 + H2SO4  | (CH3NH3)2SO4 |
|
| сульфат метиламмония |
| C6H5NH2 + HCl  | (C6H5NH3)Cl |
|
| хлорид фениламмония |
4. Реакции замещения в ароматических аминах (реакция анилина с бромной водой или с азотной кислотой):
|  | + 3Br2 |  | + 3HBr |
В этих реакциях (бромирование и нитрование) преимущественно образуются орто- и пара-производные.
Получение анилина:
C6H5NO2 + 6[H] C6H5NH2 + 2H2O.
В промышленности эта реакция протекает при нагревании нитробензола с водяным паром в присутствии железа. В лаборатории водород «в момент выделения» образуется по реакции цинка со щелочью или железа с соляной кислотой. В последнем случае образуется хлорид анилиния.
Аминокислоты органические вещества, в молекулах которых содержатся две функциональные группы: аминогруппа и карбоксильная группа.
Общая формула молекул аминокислот: - NH2—R—COOH,
где R двухвалентный радикал.
В твердом состоянии и частично в растворах аминокислоты представляют собой «внутренние соли», то есть состоят из биполярных ионов +NH3—R—COO-, образующихся при обратимом переносе протона (H+) от карбоксильной группы к аминогруппе, например:
|  |  |  |
| Молекула аминоуксусной кислоты |
| биполярный ион аминоуксусной кислоты |
Общая формула предельных аминокислот с одной карбоксильной и одной аминогруппой CnH2n+1NO2.
Химические свойства аминокислот
1. Горение:
4NH2CH2COOH + 13O2 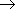 8CO2 + 10H2O + 2N2
8CO2 + 10H2O + 2N2
2. Взаимодействие с водой:
NH2CH2COOH + H2O  +NH3CH2COOH + OH
+NH3CH2COOH + OH
NH2CH2COOH + H2O  NH2CH2COO + H3O+ (NH2CH2COOH
NH2CH2COO + H3O+ (NH2CH2COOH  NH2CH2COO + H+)
NH2CH2COO + H+)
Аминокислоты амфотерные органические вещества. В водных растворах большинства аминокислот среда слабокислотная.
3. Реакции с растворами щелочей:
NH2CH2COOH + NaOH 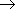 NH2CH2COO—Na+ + H2O (NH2CH2COONa аминоацетат натрия)
NH2CH2COO—Na+ + H2O (NH2CH2COONa аминоацетат натрия)
4. Реакции с растворами кислот:
2NH2CH2COOH + H2SO4 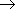 (NH3CH2COOH)2SO4
(NH3CH2COOH)2SO4
глицин (сульфат глициния)
5. Этерификация:
| NH2CH2COOH + C2H5OH |  | NH2CH2COOC2H5 + H2O (упрощенное уравнение реакции) |
6. Конденсация:
а) димеризация
| NH2—(CH2)5—COOH + H—NH—(CH2)5—COOH | | H2N—(CH2)5—CO—NH—(CH2)5—COOH | + H2O |
| аминокапроновая (6-аминогексановая) кислота |
| димер |
|
б) поликонденсация
| nNH2—(CH2)5—COOH | 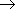 | [—NH—(CH2)5—COO—]n | + (n-1)H2O |
| аминокапроновая кислота |
| капрон |
|
Группа —CO—NH— называется амидной группой, а образующиеся полимеры - полиамидами.
Полиамиды -аминокислот называются пептидами. В зависимости от числа остатков аминокислот различают дипептиды, трипептиды, полипептиды. В таких соединениях группы —CO—NH— называют пептидными группами, а связь C—N - пептидной связью.
К полипептидам относятся белки. В их молекулах присутствуют остатки не одной, а нескольких аминокислот. При гидролизе белков (в кислотной среде или под действием ферментов) образуется смесь аминокислот.
Получение -аминокислот.
1. Из карбоновых кислот:
CH3—CH2—COOH + Cl2 CH3—CHCl—COOH + HCl
CH3—CHCl—COOH + 3NH3 CH3—CH(NH2)—COONH4 + NH4Cl
CH3—CH(NH2)—COONH4 + HCl CH3—CH(NH2)—COOH + NH4Cl
2. Гидролиз белков.
Вопросы для закрепления теоретического материала к практическому занятию
Какие соединения называются аминами?
На какие группы делятся амины?
К какой группе относится анилин?
Чем объяснить сходство аминов с аммиаком?
Какие вещества называются аминокислотами?
Задания для практического занятия:
Решить предложенные задачи.
Правильно оформить их в тетрадь для практических и контрольных работ.
Ответить на все вопросы для контроля.
Отчитаться о выполненной работе преподавателю.
Задание 1
Построить структурные формулы следующих аминов:
| Вариант 1 | Вариант 2 |
| Метиламин Метилэтиламин Триметиламин | Пропиламин Метилпропиламин Триэтиламин |
Образец решения задания
Построить структурную формулу этиламина.
Алгоритм решения
1. Записывают структурную формулу аммиака (NН3):

2. Замещают один водород на одну этильную группировку:

Этиламин
Аналогично строят структурные формулы других аминов, замещая один, два и три атома водорода в аммиаке на углеводородные радикалы.
Задание 2
| Вариант 1 | Вариант 2 |
| Написать уравнение реакции, подтверждающие химические свойства анилина | Написать уравнение реакции, подтверждающие химические свойства аминоуксусной кислоты. |
Образец решения задания
При выполнения данного задания необходимо воспользоваться краткими теоретическими и учебно-методическими материалами по теме практического занятия.
Задание 3
Решить задачу
| Вариант 1 | Вариант 2 |
| Вычислите массу соляной кислоты (НCl), которая потребуется для полного взаимодействия со 102 г 2%-го раствора анилина. | Вычислите массу бромной воды с массовой долей брома 3,5%, которая потребуется для полного взаимодействия со 150 г 2%-го раствора метиланилина. |
Образец решения задания
Вычислите массу бромной воды с массовой долей брома 2%, которая потребуется для полного взаимодействия со 186 г 1%-го раствора анилина.
Алгоритм решения
Дано:
m (С6Н5NH2) = 186 г.
(С6Н5NH2) = 1%-ый раствор
(Br2) = 2%
Найти: m (бромной воды).
Решение
1) Вычислим массу аналина, вступившего в реакцию:
m (С6Н5NH2) = (С6Н5NH2) mраствора (С6Н5NH2) = 0,01 186 = 1,86 г.
2) Запишем уравнение реакции взаимодействия аналина с бромной водой:

3) составляем пропорцию для расчета массы брома, вступившего в реакцию:
93 г С6Н5NH2 — 480 г Br2
1,86 г С6Н5NH2 — х г Br2
Мr(Br) = 160 а.е.м.
Мr(С6Н5NH2) = 12 6 + 7 + 14 = 93 а.е.м.
Мr(С6Н5NH2) = 93 г/моль.

4) Рассчитаем массу 2% раствора бромной воды:
Ответ: потребуется 480 г бромной воды.
Вопросы для контроля
Какими свойствами обладают амины: основными, кислотными или амфотерными?
В чем проявляется двойственность химических реакций аминокислот?
Форма контроля выполнения практического задания:
Выполненная работа представляется преподавателю в тетради для выполнения практических и контрольных работ по дисциплине «Химия».
6
























