Просмотр содержимого документа
«Презентация "Галогены" 9 класс.»

Глава ІІІ Галогены
ЧЕРНЕЦОВА Н.И.,
Учитель химии

22.11.20
Физические и химические свойства галогенов
Сравнительная характеристика галогенов
9 класс
УРОК 19.

- Изучить физические и некоторые химические свойства галогенов.
- Систематизировать знания о химической связи на примере простых веществ галогенов и их соединений, а также об окислительно - восстановительных реакциях.
- Основные понятия.
- Возгонка, конденсация.

- План:
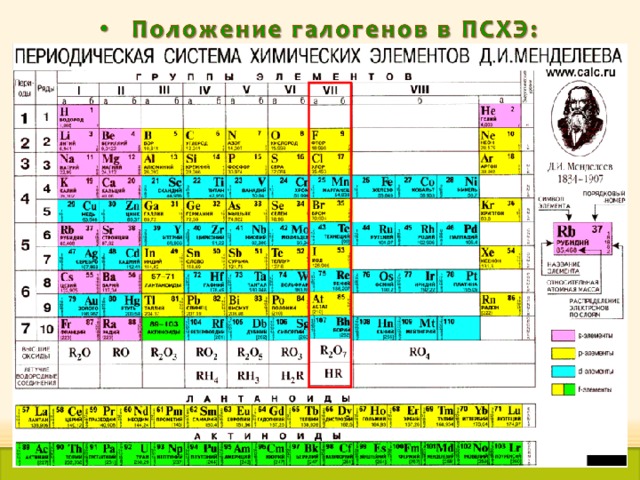
- Положение галогенов в ПСХЭ Д.И.Менделеева
- Строение атомов галогенов
- Строение молекул галогенов
- Физические свойства галогенов
- Химические свойства галогенов
- Применение галогенов
4
4

- 1. Охарактеризуйте галогены от фтора до иода по следующему плану (можно в виде таблицы):
- Порядковый номер элемента.
- Относительная атомная масса
- Строение атома химического элемента. Число энергетических уровней.
- Число электронов на внешнем энергетическом уровне.
- Молекулярная формула простого вещества.

№
1
Эле
мент
№
Пор-
вый
2
F
3
Cl
9
Ar
Строение
атома
19
Br
4
2)7
I
Число
Энергети-
ческих
уровней.
Число элек-ов
на внешнем энер-ком уровне.
2
Молекулярная формула простого вещества.
7
F 2

№
1
Эле
мент
2
№
Пор-
вый
F
Ar
9
3
Cl
Строение
атома
4
19
Br
17
I
35
35,5
2)7
Число
Энерг-
ских
Уро-ей.
2)8)7
80
53
Число элек-ов
на внешнем
энерком уровне.
2
2)8)18)7
127
7( 2 s 2 2p 5 )
3
Молекулярная формула простого вещества.
2)8)18)18)7
F 2
4
7( 3 s 2 3p 5 )
7( 4 s 2 4p 5 )
Cl 2
5
Br 2
7 ( 5 s 2 4p 5 )
I 2

- 2. Что общего и каковы различия в строении атомов галогенов?
- 3. Как изменяются радиусы атомов галогенов в группе сверху вниз?
- 4. У атомов каких элементов внешние электроны прочнее связаны с ядром:
- а) у хлора или у брома; б) у фтора или у брома; в) у брома или у иода? Почему?
- 5. Почему галогены образуют двухатомные молекулы?
![Элемент F Ar Cl 19 Число электронных слоев Br 35,5 R атома Число валентных электронов I 80 127 НеМетал свойства Окисл. свойства Эле- мент Элемент Ar Ar F F Электрон- ные слои Число электронных слоев Cl 19 Cl ) ) R атома Br r атома Br 35,5 80 ) ) ) Число валентных электронов I Валентные Электроны I 2 s 2 2p 5 127 At ) ) ) ) НеМетал Св-ва НеМеталсвойства [210] 3 s 2 3p 5 ) ) ) ) ) Окис-е Св-ва Окисл. свойства 4 s 2 4p 5 ) ) ) ) ) ) 5 s 2 5p 5 6 s 2 6p 5](https://fsd.multiurok.ru/html/2020/11/22/s_5fba55b8296e1/img9.jpg)
Элемент
F
Ar
Cl
19
Число электронных слоев
Br
35,5
R атома
Число валентных электронов
I
80
127
НеМетал свойства
Окисл.
свойства
Эле-
мент
Элемент
Ar
Ar
F
F
Электрон-
ные
слои
Число электронных слоев
Cl
19
Cl
) )
R атома
Br
r
атома
Br
35,5
80
) ) )
Число валентных электронов
I
Валентные
Электроны
I
2 s 2 2p 5
127
At
) ) ) )
НеМетал
Св-ва
НеМеталсвойства
[210]
3 s 2 3p 5
) ) ) ) )
Окис-е
Св-ва
Окисл.
свойства
4 s 2 4p 5
) ) ) ) ) )
5 s 2 5p 5
6 s 2 6p 5
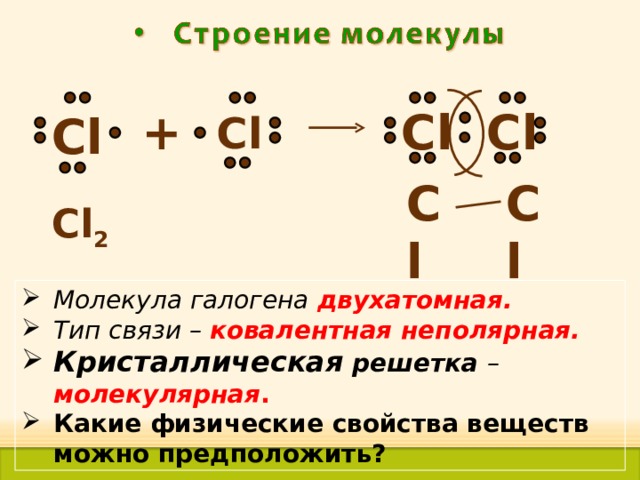
+
Cl
Cl
Cl
Cl
Cl
Cl
Cl 2
- Молекула галогена двухатомная.
- Тип связи – ковалентная неполярная.
- Кристаллическая решетка – молекулярная .
- Какие физические свойства веществ можно предположить?
11

- 6. Объясните, как происходит образование связи в молекулах галогенов, в водородных соединениях галогенов, в соединениях галогенов с металлами.

7. Вид химической связи в соединениях, образованных галогенами, неодинаков. Установите соответствие.
- А. Ковалентная полярная
- Б. Металлическая
- В . Ковалентная неполярная
- Г. Ионная
- 1) Молекулы простых веществ (F2, Cl 2 , Br 2 , I 2 )
- 2) Летучие водородные соединения
- 3 ) Соли ( NaCl , KBr , CuI 2 , CaF 2 )
- Ответ : 1- В; 2 - А; 3 - Г

8. Галогены и их соединения в твёрдом состоянии имеют кристаллическое строение. Какой тип кристаллической решётки можно предположить у галогенов и образованных ими веществ, находящихся в твёрдом состоянии? Установите соответствие.
- Тип кристаллической решётки
- 1. Галогены — простые вещества
- 2. Галогеноводороды 3. Соли бескислородных кислот
- (растворов галогеноводородов)
- А . Ионная
- Б. Атомная
- В. Молекулярная
- Г. Металлическая
- Ответ : 1- В; 2 - В; 3 - А

9. Галогены — простые вещества имеют одинаковый вид химической связи и одинаковый тип кристаллической решётки, но разное агрегатное состояние. Это объясняется тем, что:
- 1. в узлах кристаллической решётки находятся одинаковые по массе частицы, но расположенные друг от друга на разном расстоянии
- 2. в узлах кристаллической решётки находятся двухатомные молекулы с разной массой и разной силой притяжения друг к другу
- 3. в узлах кристаллической решётки находятся нейтральные атомы, на которые не действуют силы межатомного (межмолекулярного) притяжения в кристалле;
- 4. галогены образуют кристаллы разной формы.

ФИЗИЧЕСКИЕ СВОЙСТВА ГАЛОГЕНОВ

11

11

11

11

11

At 2
22

Гало-ген
Агрег. сост.
F 2
Цвет
Cl 2
Газ
Запах
Br 2
Бледно-желтый
Газ
T
плавл.
°C
Резкий раздражаю-щий
Жид-кость
Желто-зеленый
I 2
Красно-бурый
резкий неприятный
-219,7
T
кип.
°C
Твер-дое
− 100
-188,2
Резкий, удушающий,
пары токсичны
Темно-фиолето-вый
− 34
− 7,2
Специфичес-
кий резкий
58,8
+113,5
+184,3

F 2
24

Cl 2
25

Cl 2
26

Br 2
I 2
- Бром и иод добывают из природных вод.
- Источник иода – морские водоросли –
ламинарии.
27

27

1. Взаимодействие с металлами .
- При взаимодействии галогенов с металлами образуются соли – галогениды.
- Zn + F 2 = ZnF 2 фторид цинка
- 2 Fe + 3 Cl 2 = 2 FeCl 3 хлорид цинка
- 2 Al + 3 Br 2 = 2 AlBr 3 бромид алюминия
- 2 Al + 3 I 2 =2 AlI 3 иодид алюминия
29

2. Взаимодействие с водородом.
- При взаимодействии галогенов с водородом образуются галогеноводороды .
- При растворении в воде г алогеноводороды образуют кислоты.
H 2 + F 2 =2 HF
H 2 + Cl 2 =2 HCl
фтороводород (со взрывом)
H 2 + Br 2 =2 HBr
хлороводород (со взрывом при
ярком солнечном освещении)
бромоводород (при нагревании)
H 2 + I 2 =2 HI
иодоводород (при нагревании,
медленно)

3 . Взаимодействие с водой .
- Cl 2 , Br 2 , I 2 взаимодействуют по схеме:
- Г al 2 + H 2 O = H Г al О + НГ al
- Cl 2 + H 2 O = HClO + HCl ( хлороводородная кислота)
(хлорноватистая кислота)
F 2 особо !
F 2 + H 2 O → 2 HF ↑ + ↑ O 2
31
 Cl 2 Br 2 I 2 активность уменьшается 2К Br + Cl 2 = 2 KCl + Br 2 Почему для этой реакции не используют фтор? 31 " width="640"
Cl 2 Br 2 I 2 активность уменьшается 2К Br + Cl 2 = 2 KCl + Br 2 Почему для этой реакции не используют фтор? 31 " width="640"
- Более активный галоген вытесняет менее активный из
растворов солей .
F 2 Cl 2 Br 2 I 2 активность уменьшается
- 2К Br + Cl 2 = 2 KCl + Br 2
- Почему для этой реакции не используют фтор?
31

Фреоны
(как хладогент)
F 2
Зубная паста
Окислитель ракетного топлива
Тефлон и другие фторопласты
Тефлон называют «органической платиной». Перед ним бессильны расплавленные щелочи, высокие температуры, сильные кислоты, даже «Царская водка»
33
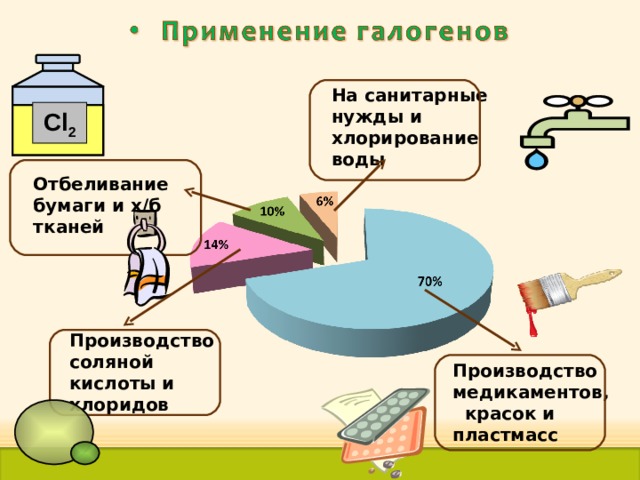
На санитарные нужды и хлорирование воды
Cl 2
Отбеливание бумаги и х/б тканей
Производство соляной кислоты и хлоридов
Производство медикаментов, красок и пластмасс
34

Лекарственные вещества
Br 2
В фотографии
Ингибиторы воспламенения
35

Лекарственные препараты
I 2
Цветная фотография
Глубокая очистка металлов
Галогеновые лампы
36

- Фтор находится в организме во всех органах и тканях.
F 2
- Но наибольшее его количество содержится в зубах, костях, волосах и ногтях.
- Кости – своеобразное «депо» фтора.
- Недостаток фтора – один из факторов, вызывающих болезнь зубов – кариес.
37

- В организме человека присутствует около 95 г хлора.
Cl 2
- Хлор поддерживает давление плазмы крови, лимфы, сохраняя баланс воды в организме.
- Хлор участвует в образовании соляной кислоты в желудке, обмене веществ.
38

- Содержание брома в организме человека (масса тела 70 кг) составляет 260 мг.
Br 2
- Бром находится в крови, мозге, печени, почках. Больше всего его в мозге человека.
- Препараты брома применяют при заболеваниях нервной системы: истерии, неврастении и других неврозах.
39

- Содержание йода в организме человека (масса тела 70 кг), по некоторым данным, составляет 25–30 мг.
I 2
- Йод необходим для нормального функционирования щитовидной железы .
- Йод оказывает успокаивающее действие на организм и нервную систему.
- Йод – один из лучших катализаторов окисления в организме.
40

- Учебник: «Химия – 9»,
- §12, упр. № 2,3(письменно)
40
















![Элемент F Ar Cl 19 Число электронных слоев Br 35,5 R атома Число валентных электронов I 80 127 НеМетал свойства Окисл. свойства Эле- мент Элемент Ar Ar F F Электрон- ные слои Число электронных слоев Cl 19 Cl ) ) R атома Br r атома Br 35,5 80 ) ) ) Число валентных электронов I Валентные Электроны I 2 s 2 2p 5 127 At ) ) ) ) НеМетал Св-ва НеМеталсвойства [210] 3 s 2 3p 5 ) ) ) ) ) Окис-е Св-ва Окисл. свойства 4 s 2 4p 5 ) ) ) ) ) ) 5 s 2 5p 5 6 s 2 6p 5](https://fsd.multiurok.ru/html/2020/11/22/s_5fba55b8296e1/img9.jpg)





















 Cl 2 Br 2 I 2 активность уменьшается 2К Br + Cl 2 = 2 KCl + Br 2 Почему для этой реакции не используют фтор? 31 " width="640"
Cl 2 Br 2 I 2 активность уменьшается 2К Br + Cl 2 = 2 KCl + Br 2 Почему для этой реакции не используют фтор? 31 " width="640"



















