
УГЛЕРОД.
Лобкова Ольга Владимировна, учитель химии и биологии.
МБОУ Жемчужненская СШ № 1

Проверка домашнего задания:
1). Осуществите цепочку превращений
Р → Mg 3 P 2 → PH 3 → P 2 O 5 → H 3 PO 4 → Na 3 PO 4
2). Предложите способ распознавания карбоната натрия и хлорида бария с помощью одного реагента. Проведите данные реакции.
Составьте уравнения соответствующих реакций в молекулярном, полном и сокращенном ионном виде.

Проверь себя:
Р → Mg 3 P 2 → PH 3 → P 2 O 5 → H 3 PO 4 → Na 3 PO 4
2. Mg 3 P 2 + 6 Н 2 О → 3 М g(OH) 2 + 2PH 3
3. 2PH 3 + 4О 2 → P 2 O 5 + 3Н 2 О
4. P 2 O 5 + 3Н 2 О → 2 H 3 PO 4
5. H 3 PO 4 + 3NaOH → Na 3 PO 4 + 3Н 2 О

Проверь себя:
Na 2 СO 3 BaCl 2
H 2 S O 4
Na 2 S O 4 + СO 2 ↑+ Н 2 О B a S O 4 ↓ + Н Cl

Эпиграф:
Бриллианты - это всего лишь кусочки угля, которые хорошо поработали над собой.

ЭЛЕМЕНТЫ 4 ГРУППЫ ГЛАВНОЙ ПОДГРУППЫ. УГЛЕРОД.

План характеристики
1.Положение углерода в ПСХЭ.
2.Заряд ядра и состав атома
3.Электронная формула
4.Возможные степени окисления
5.Углерод - простое вещество 6.Тип химической связи в простом веществе
7.Тип кристаллической решетки простого вещества
8. Аллотропные модификации и нахождение в природе
9. Применение углерода

Углерод как химический элемент
1.Положение в ПС 2 период, IV А группа,
№ 6
2.Заряд ядра +6
Общее число электронов 6
Число энергетических уровней 2

Углерод как химический элемент
3.Электронная конфигурация 1 s 2 2s 2 2p 2
Электронно-графическая формула

УГЛЕРОД КАК ХИМИЧЕСКИЙ ЭЛЕМЕНТ
4.Возможные степени окисления - +2, -2, +4, -4
Максимальная степень окисления +4
Минимальная степень окисления - 4

С сажа ; C фуллерен ; С алмаз ; С графит ; С карбин; С уголь
АЛЛОТРОПИЯ
- 6.Тип химической связи в прост. веществе – ковалентная неполярная .
- 7.Тип кристаллической решетки простого вещества – атомная

П О Ч Е М У
А Л М А З -
очень твердый,
Г Р А Ф И Т –
очень мягкий ?
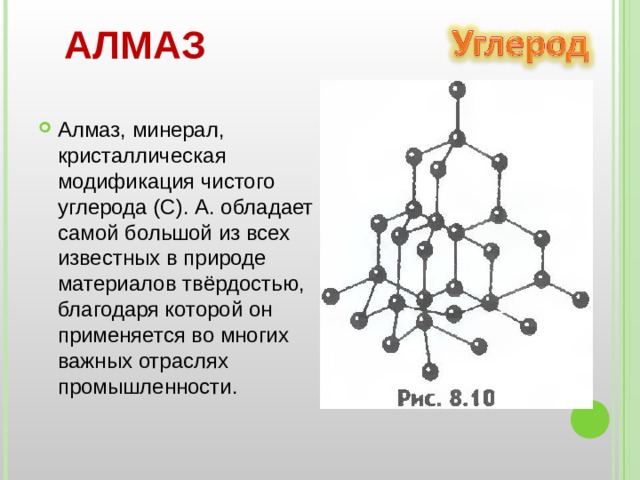
АЛМАЗ
- Алмаз, минерал, кристаллическая модификация чистого углерода (С). А. обладает самой большой из всех известных в природе материалов твёрдостью, благодаря которой он применяется во многих важных отраслях промышленности.

ГРАФИТ
- Графит (нем. Graphit, от греч. grapho-пишу), аллотропная модификация углерода, наиболее устойчивая при обычных условиях. Графит –распространенный в природе минерал. Встречается обычно в виде отдельных чешуек, пластинок и скоплений, разных по величине и содержанию графита.

Г Р А Ф И Т
Сходное с графитом строение имеют:
типографская краска, картриджи, резина, косметическая тушь
Сажа
Древесный уголь
твердое топливо, адсорбент для очистки газов и жидкостей
Кокс
восстановитель при выплавке чугуна из руд

АДСОРБЦИЯ
Найти определение в учебнике в п. 20

АЛМАЗ
АЛМАЗ «КУЛЛИАН»
Алмаз «ШАХ»
История его появления в Петербурге связана с трагическим событием произошедшим 30 января 1829 года в Тегеране: толпа фанатиков убила в этот день российского посла , дипломата и писателя А. С. Грибоедова. Чтобы замять неизбежный скандал , в Северную Пальмиру отправилась специальная депутация , и ее глава, принц Хозров - Мирза, вместе с извинениями шаха передал императору Николаю I одно из ценнейших сокровищ своего отца.
Размер 87 каратов.
Происхождение - Южная Африка.
Размер – 3025 каратов
Вес 605 г
Самый крупный из найденных

АЛМАЗ
Алмаз «Орлов»
Происхождение – Индия
Размер – 400 карат
Вес – 80 г
БОЛЬШАЯ ИМПЕРАТОРСКАЯ КОРОНА, ДЕРЖАВА ЕКАТЕРИНЫ II

АЛМАЗ
МАЛАЯ ИМПЕРАТОРСКАЯ КОРОНА
Корона создана из бриллиантовых кружев в серебряной оправе; при взгляде на нее трудно представить себе что она весит 378 г.: в малой короне 48 крупных – от 2 до 9 каратов – и 200 мелких бриллиантов.
Работа этого изделия была выполнена братьями Я. и Ж. Дювалям, сыновьями ювелира Людовика Дюваля.

ФУЛЛЕРЕН
- Фуллере́ны— молекулярные соединения, принадлежащие классу аллотропных форм углерода и представляющие собой выпуклые замкнутые многогранники, составленные из чётного числа трёхкоординированных атомов углерода. Своим названием эти соединения обязаны инженеру и дизайнеру Ричарду Бакминстеру Фуллеру.

КАРБИН
- Карбин представляет собой мелкокристаллический порошок чёрного цвета (плотность 1,9-2 г/см³), обладает полупроводниковыми свойствами. Получен в искусственных условиях из длинных цепочек атомов углерода, уложенных параллельно друг другу. Карбин — линейный полимер углерода.

Графен - материал будущего
- Кристаллы толщиной в один атом или одну молекулу - графен, созданный Геймом и его коллегами, "тверже и прочнее алмаза, но растягивается на четверть своей длины, точно резина", поясняет ученый. Графен не пропускает газы и жидкости, проводит тепло и электричество лучше, чем медь. Графеновые транзисторы работают быстрее кремниевых .

НАХОЖДЕНИЕ УГЛЕРОДА В ПРИРОДЕ

ПРИМЕНЕНИЕ
крем обуви
адсорбент
типография
сталь
сельское хозяйство
ювелирные изделия
топливо
медицина
резина

План характеристики
1.Положение углерода в ПСХЭ.
2.Заряд ядра и состав атома
3.Электронная формула
4.Возможные степени окисления
5.Углерод - простое вещество 6.Тип химической связи в простом веществе
7.Тип кристаллической решетки простого вещества
8. Аллотропные модификации и нахождение в природе
9. Применение углерода

Т е с т
1. Конфигурация внешнего электронного уровня элементов подгруппы углерода:
а) ns 2 np 2
б) ns 2 np 3
в) ns 2 np 4
г) ns 1 np 2
2. Наиболее характерная валентность элементов подгруппы углерода:
а) II
б) III
в) IV
г) V
3. Неметаллические свойства элементов подгруппы углерода в группе сверху вниз:
а) уменьшаются
б) уменьшаются, затем возрастают
в) возрастают
г) не изменяются
4. Углерод является:
а) восстановителем
б) восстановителем и окислителем
в) окислителем
г) не проявляет окислительно-восстановительных свойств
5. Атомную слоистую кристаллическую решетку имеет:
а) алмаз
б) фуллерен
в) графит
г) карбин
6. Наибольшей прочностью отличается кристаллическая решетка:
а) атомная
б) ионная
в) атомная слоистая
г) молекулярная

ПРОВЕРЬ ПОЛУЧЕННЫЕ ЗНАНИЯ
Ответы к тесту
1. а;
2. в;
3. а;
4. б;
5. в;
6. а.
Оцени себя по 5-ти бальной шкале

Домашнее задание
§ 20 стр. 109 упр. 6.
Найти 2 интересных факта об углероде или кремнии


ЭЛЕКТРОННЫЕ РЕСУРСЫ
- http://www.catalogmineralov.ru/article.php?aid=10&id=1&mid=122
- http://nale.livejournal.com/220661.html
- http://www.novgorod.fio.ru/projects/Project1409/znamenit.htm
- http://www.zerkalo-nedeli.com/nn/show/41/40021/)
- http://fio.karelia.ru/
- http://www.1september.ru/ru/him/2002/17/no17_1.htm
- http://arw.asu.ru/~sokol/server/resours/article/applicat/fuller.html
- http://www.alkor-group.ru/fullerrus.htm
- http://www.krugosvet.ru/articles/43/1004371/1004371a1.htm
- http://www.csa.ru/Fulleren/index.htmr
- http://www.catalogmineralov.ru/article.php?aid=10&id=1&mid=122

ЛИТЕРАТУРА:
- Энциклопедия для детей. Том 4. Москва «аванта+» 1995 г.
- Куликов Б. Азбука камней самоцветов. Словарь справочник. Москва. «терра»- « terra » 1996 г.
- Я познаю мир. Детская энциклопедия. Драгоценные камни и минералы. Москва. «астрель» 2003 г.
- Ножко Е.С.Сугатов А.П. Карбонаты.//Я иду на урок химии: 8-11 классы:Книга для учителя. – М.: Первое сентября, 2002, стр. 96-97.
















































