Просмотр содержимого документа
«Презентация к уроку химии в 9 классе "Кислородные соединения углерода"»
О каком элементе и его разновидностях идет речь?
Этот шаблон можно использовать как начальный файл для представления учебных материалов группе слушателей.
Разделы
Для добавления разделов щелкните слайд правой кнопкой мыши. Разделы позволяют упорядочить слайды и организовать совместную работу нескольких авторов.
Заметки
Используйте раздел заметок для размещения заметок докладчика или дополнительных сведений для аудитории. Во время воспроизведения презентации эти заметки отображаются в представлении презентации.
Обращайте внимание на размер шрифта (важно обеспечить различимость при ослабленном зрении, видеосъемке и чтении с экрана)
Сочетаемые цвета
Обратите особое внимание на графики, диаграммы и надписи.
Учтите, что печать будет выполняться в черно-белом режиме или в оттенках серого. Выполните пробную печать, чтобы убедиться в сохранении разницы между цветами при печати в черно-белом режиме или в оттенках серого.
Диаграммы, таблицы и графики
Не усложняйте восприятие: по возможности используйте согласованные, простые стили и цвета.
Снабдите все диаграммы и таблицы подписями.
1

Дайте краткий обзор презентации. Опишите главную суть презентации и обоснуйте ее важность.
Представьте каждую из основных тем.
Чтобы предоставить слушателям ориентир, можно можете повторять этот обзорный слайд в ходе презентации, выделяя тему, которая будет обсуждаться далее.
1

Это другой параметр для обзорных слайдов, использующих переходы.
1
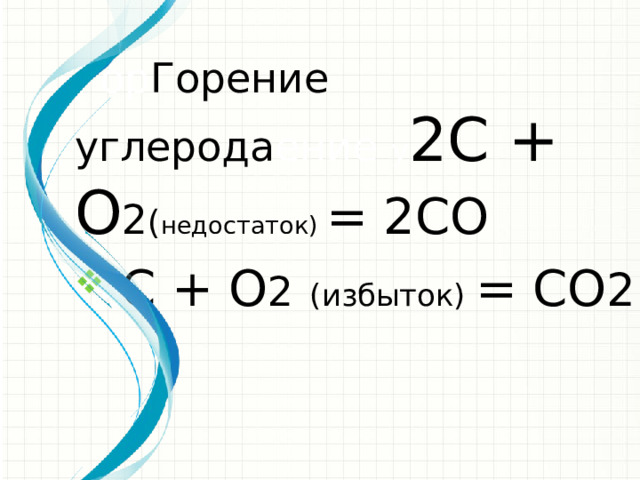
Гор Горение углерода ение у 2C + O 2 ( недостаток) = 2CO
- е C + O 2 (избыток) = CO 2
1

Тема урока:
Кислородные соединения углерода
1

Выберите утверждения, верные для оксида углерода (II):
- СО проявляет в реакциях свойства окислителя;
- СО проявляет в реакциях свойства восстановителя;
- СО – кислотный оксид;
- СО – основный оксид;
- СО – несолеобразующий оксид;
- СО ядовит;
- СО используют при выплавке чугуна как восстановитель;
- СО образуется при неполном сгорании топлива.

Для получения углекислого газа в лаборатории преимущественно используют реакцию:
- C + O 2 →
- CaCO 3 → при нагревании
- CaCO 3 + HCl →

При действии на карбонат металла кислотой образуется:
























