Просмотр содержимого документа
«Презентация к уроку на тему - "Углерод"»

УГЛЕРОД

Положение углерода в ПСХЭ
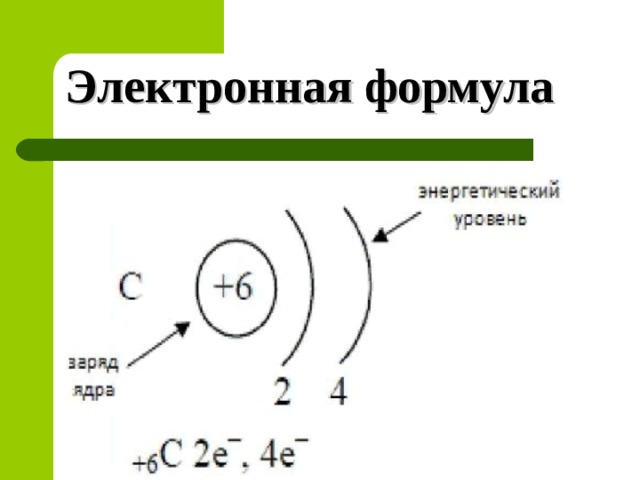
Электронная формула


Аллотропия -способность атомов одного элемента образовывать несколько простых веществ.

Аллотропия углерода
Алмаз - это прозрачное кристаллическое вещество, самое твердое из всех прозрачных веществ. Это обусловлено структурой его атомной кристаллической решетки. Кристаллы алмаза обычно бесцветные, но бывают синего, красного и черного цвета.

Фуллерены - удивительные полициклические структуры сферической формы. Применяется в качестве присадок для ракетных топлив, смазочного материала, сверхпроводящих материалов, а также в качестве красителей в копировальных машинах.

Карбин - черный порошок, решетка построена из прямолинейных цепочек С ∞ , полупроводник. Наиболее стабильная модификация углерода.
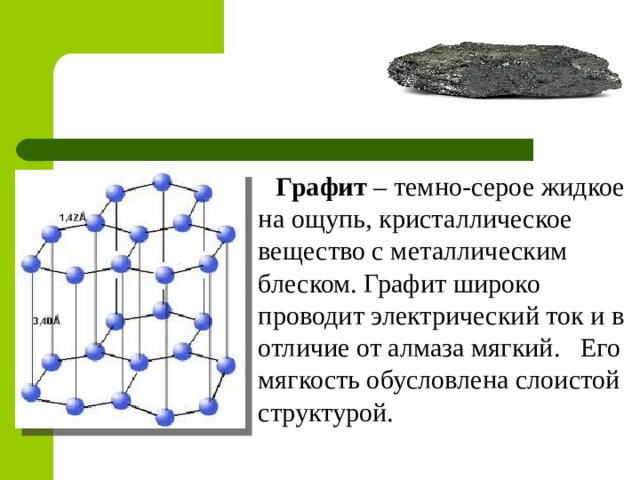
Графит – темно-серое жидкое на ощупь, кристаллическое вещество с металлическим блеском. Графит широко проводит электрический ток и в отличие от алмаза мягкий. Его мягкость обусловлена слоистой структурой.

Какие аллотропии свойственны для углерода?

Адсорбция
- поглощение газообразных или растворённых веществ поверхностью твёрдого вещества, а выделение этих веществ - десорбция

Химические свойства
С – малоактивен, на холоде реагирует только с фтором.
С + F 2 = CF 4
Химическая активность проявляется при высоких температурах.

Востановитель
Окислитель
С+О 2 = CO 2
2 C+O 2 =2CO (неполное сгорание)
2. С водой
С+Н 2 О= CO+H 2 ↑
2 Be + C=Be 2 C
4Al+3C=Al 4 C 3
2. С водородом
С+2Н 2 =СН 4
С+2 ZnO=2Zn+CO 2

Круговорот углерода
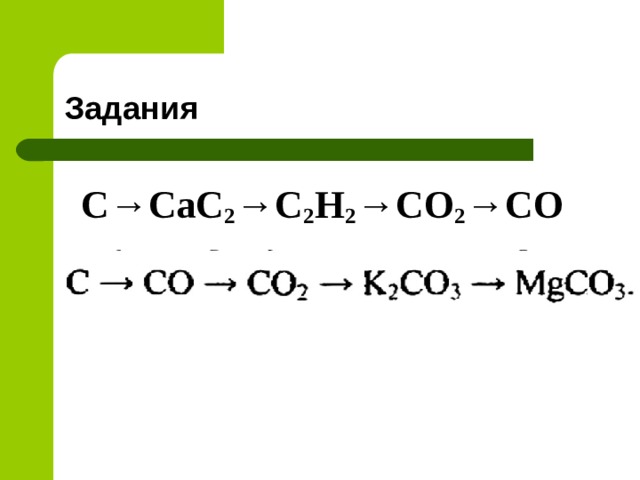
Задания
С→СаС 2 →С 2 Н 2 →СО 2 →СО
































