Просмотр содержимого документа
«Презентация к уроку " Общая характеристика неметаллов" 9 класс»

Большинство неметаллов имеют твёрдое агрегатное состояние
P
F
Общая характеристика неметаллов
S
Cl
Хлор (как и фтор) – окрашенные газообразные неметаллы.
Сера – кристаллическое вещество жёлтого цвета

Большинство неметаллов имеют твёрдое агрегатное состояние
Сера – кристаллическое вещество жёлтого цвета
Хлор (как и фтор) – окрашенные газообразные неметаллы.

Цели урока:
Определение положения неметаллов
в ПС.
Особенности атомного строения
элементов-неметаллов.
Характеристика простых веществ
неметаллов.
●
●
●
Аллотропия.
Закрепление материала.
●
●

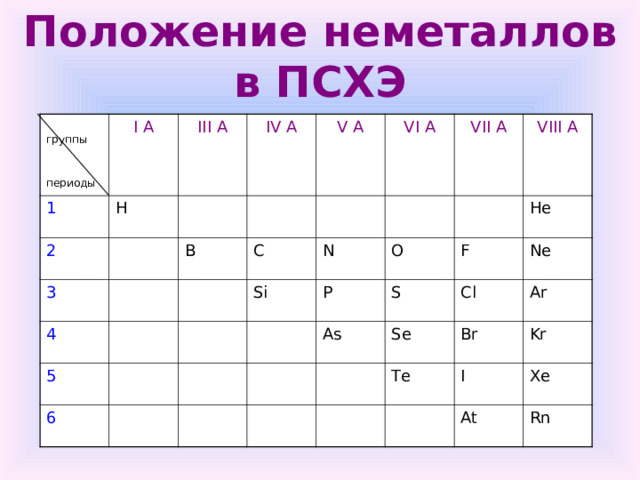
Положение неметаллов в ПСХЭ
группы
периоды
I А
1
H
III А
2
IV А
3
4
B
V А
C
5
VI А
Si
N
6
VII А
VIII А
P
O
S
He
As
F
Cl
Se
Ne
Ar
Te
Br
Kr
I
Xe
At
Rn

Особенности атомного строения неметаллов:
Небольшой атомный радиус
На внешнем уровне 4-8 электронов

Физические свойства
- Низкая электропроводность.
Почти все неметаллы – диэлектрики, кроме селена и кремния (полупроводники), и графита.
- Отсутствие металлического блеска, цветовая политра

Цветовая палитра:
Красно-бурый Фиолетовый
Красный
Красный
фосфор
Бром
Пары йода
Желтый
Желто-зеленый
Черный
Графит
Хлор
Сера
Агрегатное состояние
Жидкие
Твердые
Газы
Br 2
I 2 , P 4 , C,
Si, B, S 8
Не, N 2 , Н 2 ,
Cl 2 , O 2 , O 3

Температура плавления
- 3 800 0 С – у графита
- - 210 0 С - азота

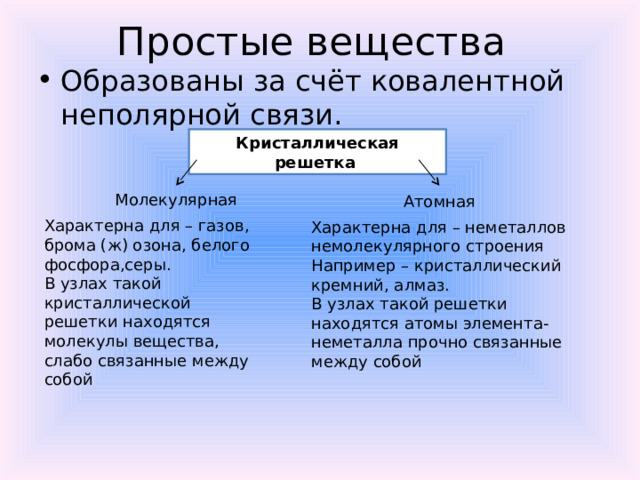
Простые вещества
- Образованы за счёт ковалентной неполярной связи.
Кристаллическая решетка
Молекулярная
Атомная
Характерна для – газов, брома (ж) озона, белого фосфора,серы.
В узлах такой кристаллической решетки находятся молекулы вещества, слабо связанные между собой
Характерна для – неметаллов немолекулярного строения
Например – кристаллический кремний, алмаз.
В узлах такой решетки находятся атомы элемента-неметалла прочно связанные между собой

Аллотропия – способность атомов одного химического элемента образовывать несколько простых веществ, различных по своим свойствам

Аллотропные изменения углерода

Аллотропные изменения кислорода
О - кислород
Кислород
Озон

Причины аллотропии

Химические свойства
- Являются и окислителями и восстановителями , в зависимости от природы реагирующих веществ (определяется электроотрицательностью)

Электроотрицательность – это способность атомов химического элемента притягивать к себе общие электронные пары
H Si P C S Br Cl N O F
у с и л е н и е ЭО

Окислительные свойства (неМе является ОКИСЛИТЕЛЕМ)
- неМе + Ме =бинарное соединение
- неМе + неМе = соль (окислитель тот неМе, имеющий большую электроотриуательность)
- неМе + сложное вещество

Восстановительные свойства не Ме – восстановитель
- неМе + неМе = соль Один из неметаллов (менее электроотриуательный – восстановиталь, другой (более электроотрицательный – окислитель)
- Восстановление сложных веществ

Домашнее задание
П.10 № 5

Спасибо за урок! Молодцы!






































