
эпиграф « Без химических реакций невозможна жизнь и всё многообразие веществ»

Кластер
Кластер
«Химические реакции»
«Химические реакции»
Соприкосновение
А. Л. Лавуазье
Измельчение, растворение
Задание: заполните пустые овалы соответствующей информацией. Раскройте каждый признак.
Действие тока, света
Нагревание
В.М. Ломоносов
Превращения веществ
Закон сохранения
Условия
?
Изменение
окраски
Химические
реакции
Определение
Появление запаха
Классификация
?
Признаки
Выделение
поглощение
теплоты
По тепловому
эффекту
Выделение газа
образование осадка

Задание: выявите признаки сходства и различия между данными реакциями.
2H 2 + O 2 = 2H 2 O
2HgO = 2Hg + O 2
Fe 2 O 3 + 3H 2 = 2Fe + 3H 2 O
3NaOH + H 3 PO 4 = Na 3 PO 4 + 3H 2 O

В 1774 г. английский химик Дж. Пристли получил кислород

В 1774 г. английский химик Дж. Пристли получил кислород
2HgO = 2Hg + O 2 ↑

ТИПЫ ХИМИЧЕСКИХ РЕАКЦИЙ
РАЗЛОЖЕНИЯ
Add Your Text

Ключевые слова
- По физике это пройденный путь в единицу времени 8,7,22,18,3,49,79,13,73,50,80 Первые 4 буквы латинское название элемента железа, следующие 4 буквы – так в народе называют сотрудников милиции.
- По физике это пройденный путь в единицу времени
- 8,7,22,18,3,49,79,13,73,50,80
- Первые 4 буквы латинское название элемента железа, следующие 4 буквы – так в народе называют сотрудников милиции.

Скорость химической реакции
Катализаторы
Ферменты

Цель урока
Изучить механизм реакций разложения. Познакомиться с понятиями «скорость химической реакции», «катализатор», «фермент». Развивать умения составлять уравнения химических реакций и проводить опыты.

Инструктаж по ТБ
- Работать над столом, соблюдая
чистоту рабочего места.
- Выполнять опыты по указанию учителя
- Спиртовку зажигать спичками, тушить колпачком.
Горящую спиртовку не передвигать!
Нагревание производить в верхней части пламени, не касаясь фитиля.
Пробирку с нагреваемой смесью держат отверстием в сторону от себя и товарищей.
- Пробирку с веществом необходимо сначала прогреть.
- Работать спокойно, без суетливости.
- После окончания работы приведите рабочее место в порядок.

Лабораторный опыт
Разложение малахита
- Пробирку с малахитом закрепите в держателе и закройте отверстие пробкой с газоотводной трубкой.
- Конец газоотводной трубки опустите во вторую пробирку с известковой водой.
- Зажгите спиртовку.
- Осторожно нагрейте содержимое пробирки.
- Что наблюдаете? Дайте объяснение.
- Результаты опыта запишите в таблицу.

№
1
Исходные вещества
Условия реакции
Сu 2 (OH) 2 CO 3
Уравнение:
Признаки реакции
малахит
2
Уравнение:
Продукты реакции
H 2 O 2
пероксид водорода
3
H 2 CO 3
Уравнение:
угольная кислота

№
1
Исходные вещества
Сu 2 (OH) 2 CO 3
Уравнение: Сu 2 (OH) 2 CO 3 → 2CuO + H 2 O + CO 2 ↑
Условия реакции
2
малахит
Нагревание
Признаки реакции
Продукты реакции
Уравнение:
H 2 O 2
Выделение газа. Изменение цвета.
CuO, H 2 O, CO 2
пероксид водорода
3
H 2 CO 3
Уравнение:
угольная кислота

Разложение пероксида водорода
Ход выполнения
1
Наблюдение
Налить в пробирку пероксид водорода.
Ход выполнения
Нагреть, не доводя до кипения.
2
Наблюдение
Аккуратно всыпать в химический
Вывод
стакан
немного порошка оксида марганца (IV);
Налить на 1/5
стакана пероксида водорода.
Внести в верхнюю часть стакана тлеющую лучинку
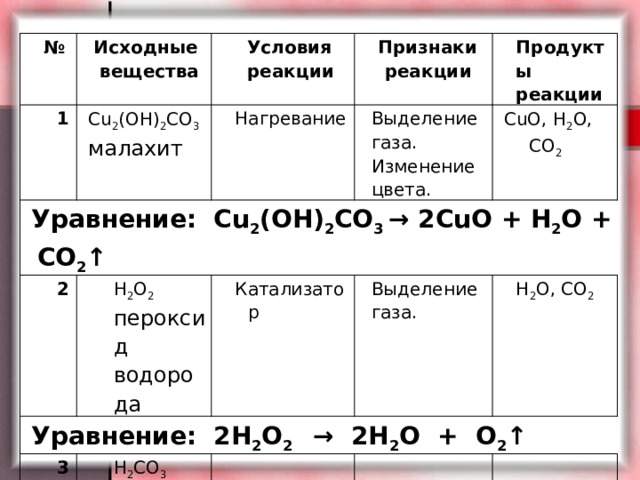
№
Исходные вещества
1
Условия реакции
Уравнение: Сu 2 (OH) 2 CO 3 → 2CuO + H 2 O + CO 2 ↑
Сu 2 (OH) 2 CO 3
Нагревание
2
малахит
Признаки реакции
Продукты реакции
H 2 O 2
Выделение газа. Изменение цвета.
Уравнение: 2H 2 O 2 → 2H 2 O + O 2 ↑
3
CuO, H 2 O, CO 2
пероксид водорода
Катализатор
Уравнение:
Выделение газа.
H 2 CO 3
угольная кислота
H 2 O, CO 2
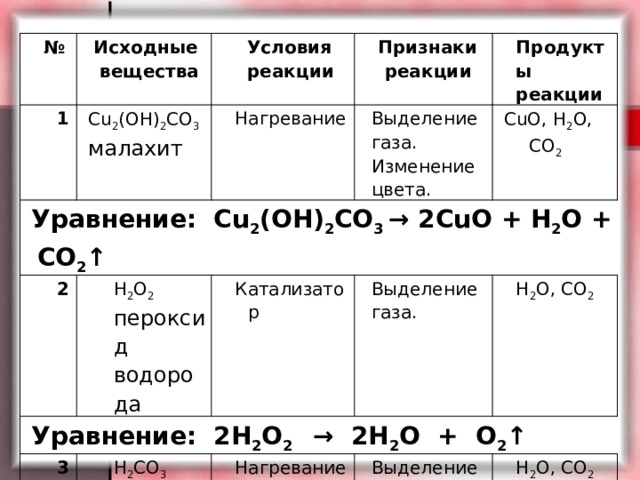
№
1
Исходные вещества
Условия реакции
Сu 2 (OH) 2 CO 3
Уравнение: Сu 2 (OH) 2 CO 3 → 2CuO + H 2 O + CO 2 ↑
Признаки реакции
малахит
Нагревание
2
Уравнение: 2H 2 O 2 → 2H 2 O + O 2 ↑
Продукты реакции
Выделение газа. Изменение цвета.
H 2 O 2
3
пероксид водорода
Катализатор
CuO, H 2 O, CO 2
Выделение газа.
H 2 CO 3
Уравнение: H 2 CO 3 → H 2 O + CO 2 ↑
H 2 O, CO 2
угольная кислота
Нагревание
Выделение газа.
H 2 O, CO 2
 АС + ВС + С " width="640"
АС + ВС + С " width="640"
Реакции разложения:
- из одного сложного вещества образуются два или несколько простых или менее сложных веществ
АВС = АС + ВС + С

Допишите предложения :
Скорость химической реакции – это _________________________
Катализатор – это ___________________________________
Фермент – это
___________

Скорость химической реакции – это быстрота превращения одних веществ в другие.

- Катализаторы – это вещества, изменяющие скорость химических реакций, но по окончании их остающиеся качественно и количественно неизменными.
- Ферменты - биологические катализаторы белковой природы.

Согласны ли вы,что
1)В реакции Cu(OH) 2 → CuO + H 2 O коэффициенты не нужны.
2) Реакция Zn + 2HCl → ZnCl 2 + H 2 относится к реакциям разложения.
3)Реакция 2Ca + O 2 → 2CaO не относится к реакциям разложения
4)Реакция 2HgO → 2Hg + O 2 относится к реакциям разложения.
5)В реакции NO → N 2 + O 2 коэффициенты не нужны.

Согласны ли вы,что
1)В реакции Cu(OH) 2 → CuO + H 2 O + коэффициенты не нужны.
2) Реакция Zn + 2HCl → ZnCl 2 + H 2 - относится к реакциям разложения.
3)Реакция 2Ca + O 2 → 2CaO не - относится к реакциям разложения
4)Реакция 2HgO → 2Hg + O 2 относится к реакциям разложения. +
5)В реакции NO → N 2 + O 2 коэффициенты не нужны. -

Выберите уравнения реакций разложения:
1)CaO + CO 2 = CaCO 3
2)CO 2 + 2NaOH = Na 2 CO 3 + H 2 O 3)2H 2 O = 2H 2 + O 2
4)CuSO 4 + Fe = Cu + FeSO 4 5)CaCO 3 = CaO + CO 2
6)ZnO + H 2 SO 4 = ZnSO 4 + H 2 O 7)Cu(OH) 2 = CuO +H 2 O

Выберите уравнения реакций разложения:
1)CaO + CO 2 = CaCO 3
2)CO 2 + 2NaOH = Na 2 CO 3 + H 2 O 3)2H 2 O = 2H 2 + O 2
4)CuSO 4 + Fe = Cu + FeSO 4 5)CaCO 3 = CaO + CO 2
6)ZnO + H 2 SO 4 = ZnSO 4 + H 2 O 7)Cu(OH) 2 = CuO +H 2 O

Соотнесите левые и правые части уравнений реакций. Расставьте коэффициенты:
А. NaNO 2 + O 2 ↑
Б. C + H 2 ↑
В. SiO 2 + H 2 O
Г. Na 2 CO 3 + CO 2 ↑ + H 2 O
- H 2 SiO 3 →
- NaNO 3 →
- NaHCO 3 →
- C 2 H 6 →

Соотнесите левые и правые части уравнений реакций. Расставьте коэффициенты:
- В. H 2 SiO 3 → SiO 2 + H 2 O
- А. 2NaNO 3 → 2NaNO 2 + 3O 2 ↑
- Г. 2NaHCO 3 → Na 2 CO 3 + CO 2 ↑ + H 2 O
- Б. C 2 H 6 → 2C + 3H 2 ↑

Восстановите пропущенную запись, расставьте коэффициенты в схемах реакций:
H 2
NH 3 = N 2 +
2
3
?
H 2 O = + O 2
H 2
?
2
2
СH 4 = + H 2
C
?
2
AgBr= + Br 2
?
2
2
Ag

Кластер
Кластер
«Химические реакции»
«Химические реакции»
Соприкосновение
А. Л. Лавуазье
Измельчение, растворение
Задание: заполните пустые овалы соответствующей информацией. Раскройте каждый признак.
Действие тока, света
Нагревание
В.М. Ломоносов
Превращения веществ
Закон сохранения
Условия
Катализатор
Изменение
окраски
Химические
реакции
Определение
Появление запаха
Классификация
Признаки
По числу и составу веществ
Выделение
поглощение
теплоты
По тепловому
эффекту
Выделение газа
образование осадка

Домашнее задание
«Реакции разложения»
- Выполнить задание №3,4,5 стр.56
- Задание № 11 - по желанию

Рефлексия
Ваше настроение на уроке пусть покажет индикаторная бумажка:
- нейтральная – придётся дома наверстать!

PS Изобразить пантомимой реакции разложения
- В результате реакции образуются два простых вещества.
- В результате реакции образуется одно простое и одно сложное вещество.
- В результате реакции образуются два сложных вещества.

Спасибо за урок!

Расставьте коэффициенты в схемах реакций:
HgO = Hg + O 2
2
2
H 2 O 2 = H 2 О + O 2
2
2
СH 4 = C 2 H 2 + H 2
2
3
KClO 3 = KCl + O 2
2
2
3






















 АС + ВС + С " width="640"
АС + ВС + С " width="640"


























