
Ароматические Углеводороды.

Ароматические углеводороды (Арены)
Арены (ароматические углеводороды) – это непредельные (ненасыщенные) циклические углеводороды, молекулы которых содержат устойчивые циклические группы атомов (бензольные ядра) с замкнутой системой сопряженных связей. Общая формула: C n H 2n–6 при n ≥ 6.
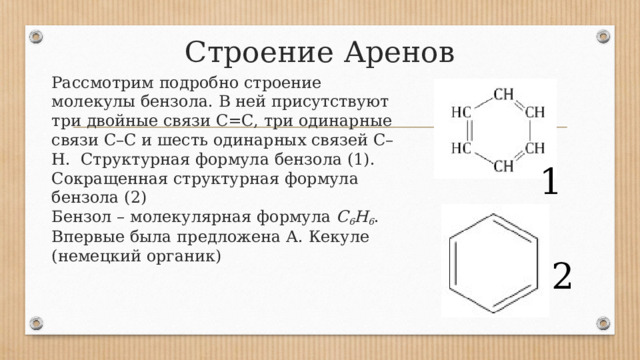
Строение Аренов
Рассмотрим подробно строение молекулы бензола. В ней присутствуют три двойные связи С=С, три одинарные связи С–C и шесть одинарных связей С–Н. Структурная формула бензола (1). Сокращенная структурная формула бензола (2) Бензол – молекулярная формула С 6 Н 6 . Впервые была предложена А. Кекуле (немецкий органик)
1
2

Каждый атом углерода образует 2 σ -связи с двумя соседними атомами углерода и одним атомом водорода, которые находятся в одной плоскости. Углы составляют 120°. Т.е. все атомы углерода лежат в одной плоскости и образуют шестигранник. Cоответственно, на самом деле все связи между атомами углерода в молекуле бензола одинаковой длины (0,140 нм), что соответствует промежуточному значению между одинарной и двойной ( полуторная связь) .
Соответственно, в молекуле бензола между углеродными атомами нет обычных одинарных и двойных связей, а все они выравнены (делокализованы).
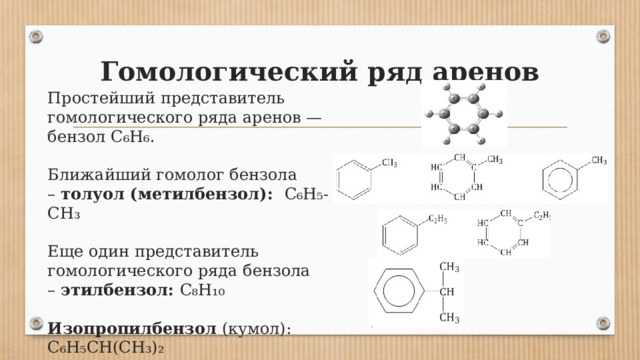
Гомологический ряд аренов
Простейший представитель гомологического ряда аренов — бензол C₆H₆. Ближайший гомолог бензола – толуол (метилбензол): C₆H₅-CH₃ Еще один представитель гомологического ряда бензола – этилбензол: C₈H₁₀ Изопропилбензол (кумол): C₆H₅CH(CH₃)₂

Номенклатура аренов
Первый представитель гомологического ряда аренов — бензол: Ближайший гомолог бензола – толуол (метилбензол): При составлении названия ароматического соединения за главную цепь принимают молекулу бензола. Если в ароматическом кольце несколько заместителей, то атомы углерода бензольного кольца нумеруются: в направлении, где больше заместителей, от самого главного заместителя (чем больше атомов углерода в радикале, тем он старше). 1,2-диметилбензол
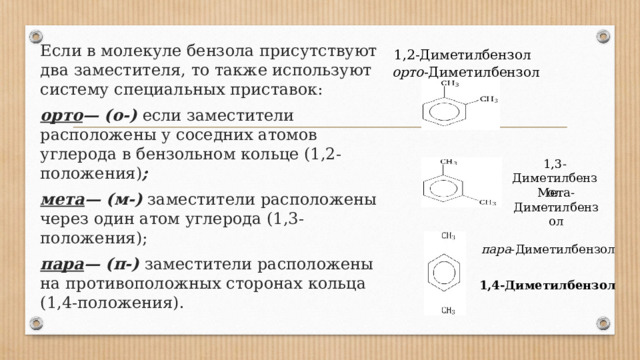
Если в молекуле бензола присутствуют два заместителя, то также используют систему специальных приставок:
орто — (о-) если заместители расположены у соседних атомов углерода в бензольном кольце (1,2-положения) ;
мета — (м-) заместители расположены через один атом углерода (1,3-положения);
пара — (п-) заместители расположены на противоположных сторонах кольца (1,4-положения).
1,2-Диметилбензол
орто -Диметилбензол
1,3-Диметилбензол
Мета-Диметилбензол
пара -Диметилбензол
1,4-Диметилбензол
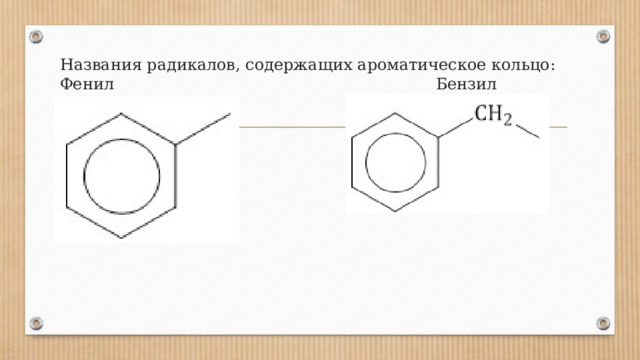
Названия радикалов, содержащих ароматическое кольцо: Фенил Бензил

Изомерия аренов Структурная изомерия
Для гомологов бензола характерна структурная изомерия .
Структурные изомеры — это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
Изомерия углеродного скелета в боковой цепи характерна для ароматических углеводородов, которые содержат три и более атомов углерода в боковой цепи. Например
Формуле С 9 Н 12 соответствуют изомеру изопропилбензол и пропилбензол
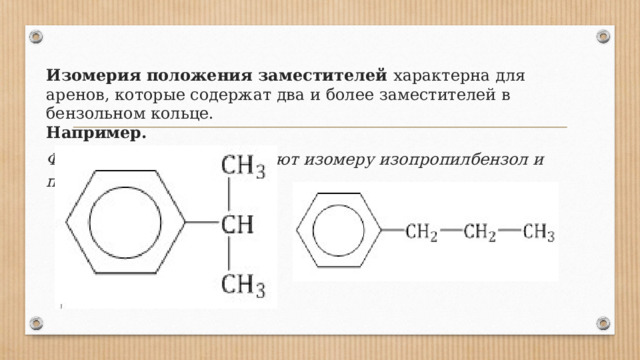
Изомерия положения заместителей характерна для аренов, которые содержат два и более заместителей в бензольном кольце. Например.
Формуле С 9 Н 12 соответствуют изомеру изопропилбензол и пропилбензол

Химические свойства аренов
Арены – непредельные углеводороды, молекулы которых содержат три двойных связи и цикл. Но из-за эффекта сопряжения свойства аренов отличаются от свойств других непредельных углеводородов. Для ароматических углеводородов характерны реакции:
присоединения,
замещения,
окисления (для гомологов бензола). Ароматическая система бензола устойчива к действию окислителей. Однако гомологи бензола окисляются под действием перманганата калия и других окислителей.

1. Реакции присоединения 1.1. Гидрирование
Бензол присоединяет водород при нагревании и под давлением в присутствии металлических катализаторов (Ni, Pt и др.).
При гидрировании бензола образуется циклогексан: При гидрировании гомологов образуются производные циклоалканы. При нагревании толуола с водородом под давлением и в присутствии катализатора образуется метилциклогексан:

1.2. Хлорирование аренов
Присоединение хлора к бензолу протекает по радикальному механизму при высокой температуре , под действием ультрафиолетового излучения.
При хлорировании бензола на свету образуется 1,2,3,4,5,6-гексахлорциклогексан (гексахлоран) . Гексахлоран – пестицид, использовался для борьбы с вредными насекомыми. В настоящее время использование гексахлорана запрещено.
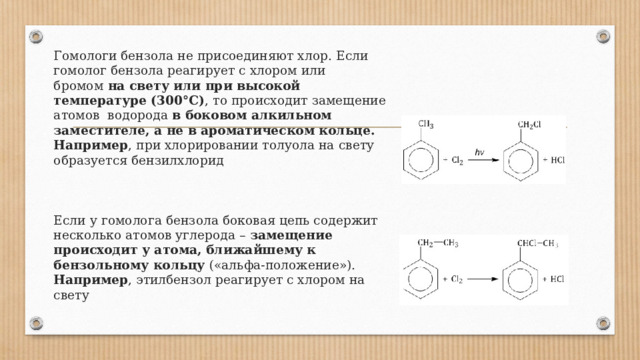
Гомологи бензола не присоединяют хлор. Если гомолог бензола реагирует с хлором или бромом на свету или при высокой температуре (300°C) , то происходит замещение атомов водорода в боковом алкильном заместителе, а не в ароматическом кольце. Например , при хлорировании толуола на свету образуется бензилхлорид Если у гомолога бензола боковая цепь содержит несколько атомов углерода – замещение происходит у атома, ближайшему к бензольному кольцу («альфа-положение»). Например , этилбензол реагирует с хлором на свету

2. Реакции замещения 2.1. Галогенирование
Реакции замещения у ароматических углеводородов протекают по ионному механизму (электрофильное замещение) . При этом атом водорода замещается на другую группу (галоген, нитро, алкил и др.). Бензол и его гомологи вступают в реакции замещения с галогенами (хлор, бром) в присутствии катализаторов (AlCl 3 , FeBr 3 ) .
При взаимодействии с хлором на катализаторе AlCl 3 образуется хлорбензол:

Ароматические углеводороды взаимодействуют с бромом при нагревании и в присутствии катализатора – FeBr 3 . Также в качестве катализатора можно использовать металлическое железо. Бром реагирует с железом с образованием бромида железа (III), который катализирует процесс бромирования бензола: При взаимодействии гомологов бензола с галогенами на свету или при высокой температуре (300 о С) происходит замещение водорода не в бензольном кольце, а в боковом углеводородном радикале.

2.2. Нитрование
Бензол реагирует с концентрированной азотной кислотой в присутствии концентрированной серной кислоты (нитрующая смесь). При этом образуется нитробензол: Серная кислота способствует образованию электрофила NO 2 + :

Толуол реагирует с концентрированной азотной кислотой в присутствии концентрированной серной кислоты. В продуктах реакции мы указываем либо о -нитротолуол либо п -нитротолуол: Нитрование толуола может протекать и с замещением трех атомов водорода. При этом образуется 2,4,6-тринитротолуол (тротил, тол):

2.3. Алкилирование ароматических углеводородов
Арены взаимодействуют с галогеналканами в присутствии катализаторов (AlCl 3, FeBr 3 и др.) с образованием гомологов бензола . Например , бензол реагирует с хлорэтаном с образованием этилбензол Ароматические углеводороды взаимодействуют с алкенами в присутствии хлорида алюминия, бромида железа (III), фосфорной кислоты и др. Например , бензол реагирует с этиленом с образованием этилбензола

Алкилирование спиртами протекает в присутствии концентрированной серной кислоты. Например , бензол реагирует с этанолом с образованием этилбензола и воды

2.4. Сульфирование ароматических углеводородов
Бензол реагирует при нагревании с концентрированной серной кислотой или раствором SO 3 в серной кислоте (олеум) с образованием бензолсульфокислоты:

3. Окисление аренов 3.1. Полное окисление – горение
При горении бензола и его гомологов образуются углекислый газ и вода. Реакция горения аренов сопровождается выделением большого количества теплоты.
2C 6 H 6 + 15O 2 → 12CO 2 + 6H 2 O + Q
Уравнение сгорания аренов в общем виде:
C n H 2n–6 + (3n – 3)/2 O 2 → nCO 2 + (n – 3)H 2 O + Q
При горении ароматических углеводородов в недостатке кислорода может образоваться угарный газ СО или сажа С.
Бензол и его гомологи горят на воздухе коптящим пламенем. Бензол и его гомологи образуют с воздухом и кислородом взрывоопасные смеси.

3.2. Окисление гомологов бензола
Гомологи бензола легко окисляются перманганатом и дихроматом калия в кислой или нейтральной среде при нагревании.
При этом происходит окисление всех связей у атома углерода , соседнего с бензольным кольцом, кроме связи этого атома углерода с бензольным кольцом.
Толуол окисляется перманганатом калия в серной кислоте с образованием бензойной кислоты:

Если окисление толуола идёт в нейтральном растворе при нагревании , то образуется соль бензойной кислоты – бензоат калия: Таким образом, толуол обесцвечивает подкисленный раствор перманганата калия при нагревании. При окислении других гомологов бензола всегда остаётся только один атом С в виде карбоксильной группы (одной или нескольких, если заместителей несколько), а все остальные атомы углерода радикала окисляются до углекислого газа или карбоновой кислоты.

Например , при окислении этилбензола перманганатом калия в серной кислоте образуются бензойная кислота и углекислый газ Например , при окислении этилбензола перманганатом калия в нейтральной кислоте образуются соль бензойной кислоты и карбонат

Более длинные радикалы окисляются до бензойной кислоты и карбоновой кислоты: Изопропилбензол окисляется перманганатом калия в кислой среде до бензойной кислоты и углекислого газа:

4. Ориентирующее действие заместителей в бензольном кольце
Если в бензольном кольце имеются заместители, не только алкильные, но и содержащие другие атомы (гидроксил, аминогруппа, нитрогруппа и т.п.), то реакции замещения атомов водорода в ароматической системе протекают строго определенным образом, в соответствии с характером влияния заместителя на ароматическую π-систему. Заместители подразделяют на две группы в зависимости от их влияния на электронную плотность ароматической системы: электронодонорные (первого рода) и электроноакцепторные (второго рода).

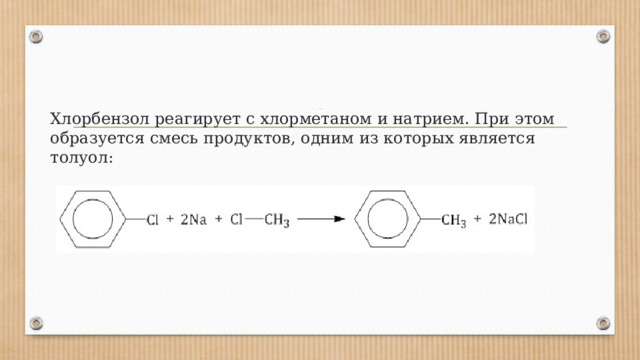
Получение аренов 1. Реакция Вюрца-Фиттига
Хлорбензол реагирует с хлорметаном и натрием. При этом образуется смесь продуктов, одним из которых является толуол:

2. Дегидроциклизация алканов
Алканы с углеродной цепью, содержащей 6 и более атомов углерода в главной цепи, при дегидрировании образуют устойчивые шестиатомные циклы, т. е. циклогексан и его гомологи, которые далее превращаются в ароматические углеводороды.
Гексан при нагревании в присутствии оксида хрома (III) в зависимости от условий может образовать циклогексан и потом бензол:
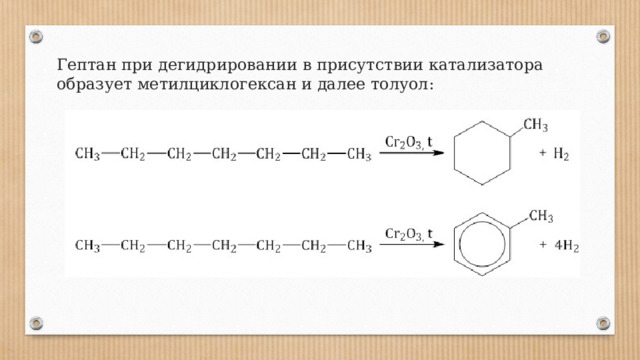
Гептан при дегидрировании в присутствии катализатора образует метилциклогексан и далее толуол:
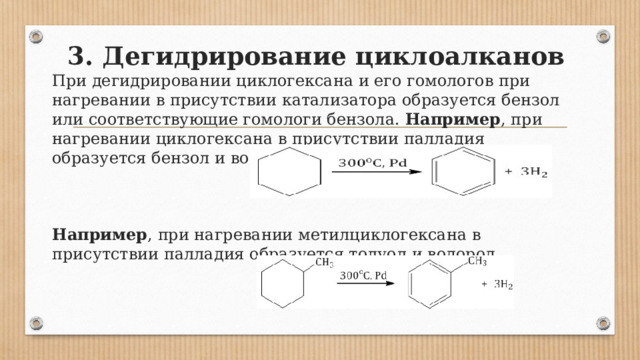
3. Дегидрирование циклоалканов
При дегидрировании циклогексана и его гомологов при нагревании в присутствии катализатора образуется бензол или соответствующие гомологи бензола. Например , при нагревании циклогексана в присутствии палладия образуется бензол и водород Например , при нагревании метилциклогексана в присутствии палладия образуется толуол и водород

4. Декарбоксилирование солей бензойной кислоты
Реакция Дюма — это взаимодействие солей карбоновых кислот с щелочами при сплавлении.
R–COONa + NaOH → R–H + Na 2 CO 3
Декарбоксилирование — это отщепление (элиминирование) молекулы углекислого газа из карбоксильной группы (-COOH) или органической кислоты или карбоксилатной группы (-COOMe) соли органической кислоты.
Взаимодействие бензоата натрия с гидроксидом натрия в расплаве протекает аналогично реакции получения алканов по реакции Дюма с образованием бензола и карбоната натрия:

5. Алкилирование бензола и его гомологов
Арены взаимодействуют с галогеналканами в присутствии катализаторов (AlCl 3, FeBr 3 и др.) с образованием гомологов бензола. Например , бензол реагирует с хлорэтаном с образованием этилбензола Ароматические углеводороды взаимодействуют с алкенами в присутствии хлорида алюминия, бромида железа (III), фосфорной кислоты и др. Например , бензол реагирует с этиленом с образованием этилбензола

- Алкилирование спиртами протекает в присутствии концентрированной серной кислоты. Например , бензол реагирует с этанолом с образованием этилбензола и воды

6. Тримеризация ацетилена
При нагревании ацетилена под давлением над активированным углем молекулы ацетилена соединяются, образуя бензол.

7. Получение стирола
Стирол можно получить дегидрированием этилбензола: Стирол можно также получить действием спиртового раствора щелочи на продукт галогенирования этилбензола (1-хлор-1-фенилэтан):






















































