
Санкт-Петербургский университет ГПС МЧС РФ
Кафедра физики и теплотехники
В. С . ЗВОНОВ
ВВЕДЕНИЕ В АТОМНУЮ ФИЗИКУ
2012 г.

Что такое атом?
Как он устроен?
Макс Планк

ЧТО ТАКОЕ ВЕЩЕСТВО, ПРОСТРАНСТВО И ВРЕМЯ?
- Такими вопросами задавались философы, ученые уже долгое время, но никто конкретно не мог представить точную картину мира.

Закономерности в атомных спектрах. Постулаты Бора.
Раскаленные тела излучают свет, который разлагается в спектр с помощью призмы или дифракционной решетки. Так выглядит спектр раскаленного азота.

Закономерности в атомных спектрах. Постулаты Бора.
Раскаленные тела излучают свет, который разлагается в спектр с помощью призмы или дифракционной решетки.
Первым получил спектры солнечного излучения и объяснил их природу И.Ньютон в 1704 году.
Следующий этап наступил через 100 лет, когда Уильям Волластон в 1802 году наблюдал тёмные линии в солнечном спектре, но не придал своим наблюдениям значения.
В 1814 эти линии независимо обнаружил и подробно описал Фраунгофер (сейчас линии поглощения в солнечном спектре называются линиями Фраунгофера), но не смог объяснить их природу.
И.Ньютон
(1642-1726)
У.Г.Волластон
(1766-1828)
Й.Фраунгофер
(1786-1826)
Линии Фраунгофера в спектре Солнца

Закономерности в атомных спектрах. Постулаты Бора.
Спектр испускания водорода оказался не сплошным , как у солнечного света, а линейчатым . Обнаруженное явление требовало объяснения, которое долгое время не могли найти.
Не менее удивительным было то, что длины волн линий поглощения и испускания в спектрах водорода совпадали с огромной точностью.
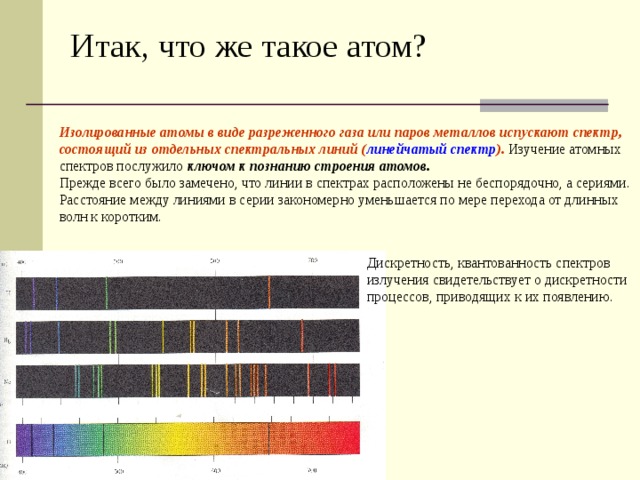
Итак, что же такое атом?
Изолированные атомы в виде разреженного газа или паров металлов испускают спектр, состоящий из отдельных спектральных линий ( линейчатый спектр ). Изучение атомных спектров послужило ключом к познанию строения атомов.
Прежде всего было замечено, что линии в спектрах расположены не беспорядочно, а сериями. Расстояние между линиями в серии закономерно уменьшается по мере перехода от длинных волн к коротким.
Дискретность, квантованность спектров
излучения свидетельствует о дискретности
процессов, приводящих к их появлению.

х
Швейцарский физик Й. Бальмер в 1885 году установил, что длины волн серии в видимой части спектра водорода могут быть представлены формулой ( формула Бальмера ):
0 = const , n = 3, 4, 5,…
или
И.Я.Бальмер
(1825-1898)
И.Ридберг
(1854-1919)
R = 1,09·10 7 м -1 – постоянная Ридберга , n = 3, 4, 5,…
В физике постоянной Ридберга называют и другую величину равную R = R ·с . R = 3,29·10 15 c -1
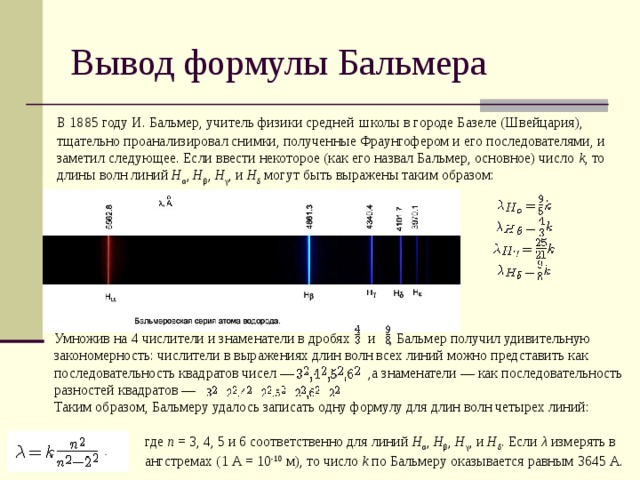
Вывод формулы Бальмера
В 1885 году И. Бальмер, учитель физики средней школы в городе Базеле (Швейцария), тщательно проанализировал снимки, полученные Фраунгофером и его последователями, и заметил следующее. Если ввести некоторое (как его назвал Бальмер, основное) число k , то длины волн линий H α , H β , H γ , и H δ могут быть выражены таким образом:
.
Умножив на 4 числители и знаменатели в дробях и , Бальмер получил удивительную закономерность: числители в выражениях длин волн всех линий можно представить как последовательность квадратов чисел — ,а знаменатели — как последовательность разностей квадратов —
Таким образом, Бальмеру удалось записать одну формулу для длин волн четырех линий:
где n = 3, 4, 5 и 6 соответственно для линий H α , H β , H γ , и H δ . Если λ измерять в ангстремах (1 А = 10 -10 м), то число k по Бальмеру оказывается равным 3645 А.

Постоянная Ридберга.
В 1890 году шведский физик-спектроскопист Ридберг записал формулу Бальмера в «перевернутом» виде», для величины . Она называется волновым числом .и показывает, какое число длин волн в вакууме укладывается на единичной длине. Волновое число легко связать с частотой света ν :
«Перевертывая» формулу Бальмера, получаем для волнового числа
Тогда окончательно формулу Бальмера можно записать
Постоянная Ридберга была с большой точностью измерена на линиях серии Бальмера .
Она оказалась равной R = 109677,581 см -1 .

Дальнейшие исследования показали, что в спектре водорода имеется еще несколько серий :
Серия Лаймана
(УФ)
Серия Пашена
(ИК)
Т. Лайман
(1874-1954)
Серия Блэккета
(ИК)
Ф.Пашен
(1865-1947)
Серия Пфунда
(ИК)
П.Блэккет
(1897-1974)
А.Г.Пфунд
(1879-1949)
Обобщенная формула Бальмера - Ридберга

Обобщенная формула Й. Бальмера
или
где k = 1, 2, 3,…, n = k + 1, k + 2,….

Термы.
В.Ритц
(1878-1909)

Уровни энергии атома водорода.
Теперь если вспомним, что свет излучается (М.Планк) и поглощается (А.Эйнштейн) порциями (квантами), энергия которых пропорциональна частоте ( E = hν ). Тогда естественно предположить, что в атоме существуют уровни энергии, и свет излучается при переходе с одного уровня на другой. Поглощая свет, атом переходит с более низкого уровня на более высокий.
hν 32 = Е 3 – Е 2 = 1, 9 эВ, где 1 эВ = 1,6 10 -19 Дж.
Это соответствует длине волны
λ = с/ ν 32 = ( 3 10 8 6,68 10 -34) /(1,9 1,6 10 -19 )= 6,59 10 -7 м = 6590 А.
Измеренное значение оказалось равным 6650 А – первая линия Бальмера
Приведенные выше сериальные формулы подобраны эмпирически и долгое время не имели теоретического обоснования, хотя и были подтверждены экспериментально с очень большой точностью. Приведенный выше вид сериальных формул, удивительная повторяемость в них целых чисел, универсальность постоянной Ридберга свидетельствуют о глубоком физическом смысле найденных закономерностей, вскрыть который в рамках классической физики оказалось невозможным.
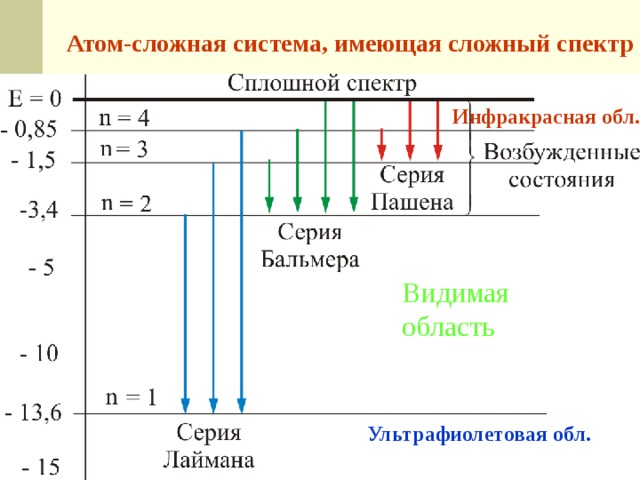
Атом-сложная система, имеющая сложный спектр
Инфракрасная обл.
Видимая
область
Ультрафиолетовая обл.

Череда великих открытий
1895- открытие Х-лучей Рентгеном
1896- открытие радиоактивности Беккерелем
1897 - открытие электрона Дж.Томсоном
1911 – создание планетарной модели атома Резерфорда
В.К.Рёнтген
(1845-1923)
А.А.Беккерель
(1852-1908)
Дж.Д.Томсон
(1956-1940)
Э.Резерфорд
(1871-1937)

Модели атома- какую выбрать?
Ж.Перрен в 1901 году, а
Х.Нагаока в 1904 году предложили идею планетарной
модели атома , согласно которой вокруг положительно заряженного массивного ядра вращаются электроны.
Ж.Б.Перрен
(1870-1942)
В 1903 году Томсон предложил модель атома, согласно которой атом имеет форму шара, положительный заряд которого распределен равномерно по всему объему, а отрицательно заряженные электроны находятся внутри него, причем их суммарный отрицательный заряд равен положительному заряду шара, так что в целом атом электрически нейтрален. Электроны взаимодействуют с элементами положительно заряженной среды по закону Кулона. При отклонении электрона от положения равновесия возникают силы, стремящиеся возвратить его в исходное положение, что порождает колебания электронов и обуславливает излучение атомов.
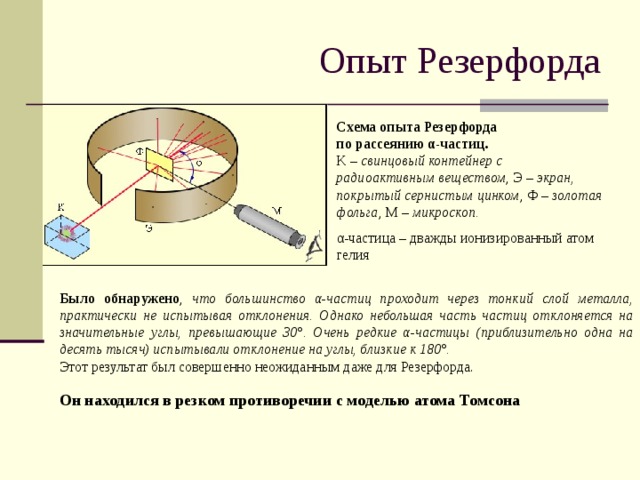
Опыт Резерфорда
Схема опыта Резерфорда
по рассеянию α-частиц.
K – свинцовый контейнер с радиоактивным веществом , Э – экран, покрытый сернистым цинком , Ф – золотая фольга , M – микроскоп.
α-частица – дважды ионизированный атом гелия
Было обнаружено , что большинство α-частиц проходит через тонкий слой металла, практически не испытывая отклонения. Однако небольшая часть частиц отклоняется на значительные углы, превышающие 30°. Очень редкие α-частицы (приблизительно одна на десять тысяч) испытывали отклонение на углы, близкие к 180°.
Этот результат был совершенно неожиданным даже для Резерфорда.
Он находился в резком противоречии с моделью атома Томсона

Большинство α-частиц рассеивалось на углы порядка 3°
Отдельные α-частицы отклонялись на большие углы, до 150º
(одна из нескольких тысяч)
Такое отклонение возможно лишь при взаимодействии практически точечного положительного заряда – ядра атома – с близко пролетающей α-частицей .
Атом
Томсона

Опыт Резерфорда
- Было обнаружено , что большинство α-частиц проходит через тонкий слой металла, практически не испытывая отклонения. Однако небольшая часть частиц отклоняется на значительные углы, превышающие 30°. Очень редкие α-частицы (приблизительно одна на десять тысяч) испытывали отклонение на углы, близкие к 180°.
- Этот результат был совершенно неожиданным даже для Резерфорда.
- Он находился в резком противоречии с моделью атома Томсона
Рассеяние α-частицы
в атоме Томсона (a) и в атоме Резерфорда (b).
Таким образом, опыты Резерфорда и его сотрудников привели к выводу, что в центре атома находится плотное положительно заряженное ядро, диаметр которого не превышает 10–14–10–15 м. Это ядро занимает только 10–12 часть полного объема атома, но содержит весь положительный заряд и не менее 99,95 % его массы. Это и есть модель атома Резерфорда

Планетарная модель атома Резерфорда
Резерфорд предложил планетарную модель атома. Согласно этой модели, в центре атома располагается положительно заряженное ядро, в котором сосредоточена почти вся масса атома. Атом в целом нейтрален. Вокруг ядра, подобно планетам, под действием кулоновских сил со стороны ядра вращаются электроны Находиться в состоянии покоя электроны не могут, так как они упали бы на ядро.
Ze
e

Почему атом устойчив?
Планетарная модель атома, предложенная Резерфордом, несомненно явилась крупным шагом вперед в развитии знаний о строении атома. Она была совершенно необходимой для объяснения опытов по рассеянию α-частиц, однако оказалась неспособной объяснить сам факт длительного существования атома, т. е. его устойчивость. По законам классической электродинамики, движущийся с ускорением заряд должен излучать электромагнитные волны, уносящие энергию. За короткое время (порядка 10 –8 с) все электроны в атоме Резерфорда должны растратить всю свою энергию и упасть на ядро. То, что этого не происходит в устойчивых состояниях атома, показывает, что внутренние процессы в атоме не подчиняются классическим законам.

Планетарная модель атома противоречит электродинамике Максвелла!!!

Согласно теории Максвелла, ускоренно движущийся заряд излучает электромагнитные волны.

Как же устроен атом?
Нильс Бор – великий датский ученый
в 1913 году разгадал тайну атома

Закономерности в атомных спектрах. Постулаты Бора.
Глубокий физический смысл понятия «терм», введенный Ритцем,
что ν = R/n 2 был впервые вскрыт в 1913 году датским ученым Нильсом Бором , который увидел в комбинационном принципе яркое проявление своеобразных квантовых законов, управляющих внутриатомными движениями. Бор предположил, что каждому терму соответствует вполне определенное энергетическое состояние атома. И так, как набор термов для каждого атома дискретен, то атом может обладать только вполне определенным дискретным рядом значений энергии. Тогда сериальные формулы и комбинационный принцип есть не что иное, как выражение того факта, что свет строго определенной частоты излучается лишь при скачкообразном изменении энергетического состояния атома. Именно поэтому волновые числа выражаются как разность двух термов.
Бор сказал: Как только я увидел формулу Бальмера, весь вопрос стал мне немедленно ясен.
Нильс Бор
(1885-1962)

Первый постулат Бора ( постулат стационарных состояний )
- Атомная система может находится только в особых стационарных или квантовых состояниях, каждому из которых соответствует определенная энергия W n . В стационарных состояниях атом не излучает.
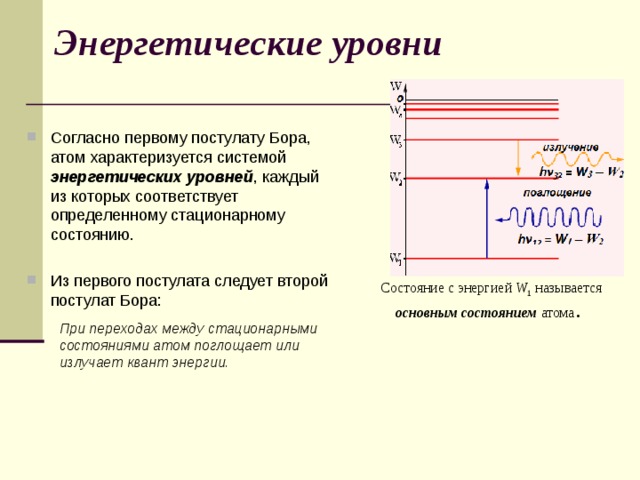
Энергетические уровни
- Согласно первому постулату Бора, атом характеризуется системой энергетических уровней , каждый из которых соответствует определенному стационарному состоянию.
- Из первого постулата следует второй постулат Бора:
Состояние с энергией W 1 называется основным состоянием атома .
При переходах между стационарными состояниями атом поглощает или излучает квант энергии.

Второй постулат Бора ( правило частот ):
- при переходе атома из одного стационарного состояния с энергией W n в другое стационарное состояние с энергией W k излучается или поглощается квант, энергия которого равна разности энергий стационарных состояний:

Теория атома Бора
Постулаты Бора определили направление развития новой науки – квантовой физики атома. Но они не содержали рецепта определения параметров стационарных состояний (орбит) и соответствующих им значений энергии E n .
Правило квантования, приводящее к согласующимся с опытом
значениям энергий стационарных состояний атома водорода,
Бором было угадано . Он предположил, что момент
импульса электрона, вращающегося вокруг ядра, может
принимать только дискретные значения, кратные постоянной
Планка. Для круговых орбит правило квантования Бора
записывается в виде
 " width="640"
" width="640"
Уравнение движения электрона получим из равенства центробежной силе кулоновской силе:
m e υr = nħ
Отсюда найдем радиус стационарных орбит:
=

Теория атома Бора
Радиус первой орбиты водородного атома называют Боровским радиусом:
При n =1, Z = 1 для водорода имеем:
Å=
= 0,529·10 –10 м.
r 1 =5,2917720859(36)×10 −11 м
цифры в скобках указывают погрешность в последних значащих цифрах
Боровский радиус часто используется в атомной физике в качестве атомной единицы длины

Внутренняя энергия атома слагается из кинетической энергии электрона и потенциальной энергией взаимодействия электрона с ядром:
Отсюда
Из этой формулы вытекает, что
энергия электрона может принимать только дискретные значения,
т.к. n = 1, 2, 3,…

При переходе электрона в атоме водорода из состояния n в состояние k излучается фотон с энергией :
и частота излучения,
Мы получили обобщенную формулу Бальмера, которая хорошо согласуется с экспериментом, где постоянная Ридберга

Теория атома Бора
Эта формула в точности совпадает с эмпирической формулой Ридберга для спектральных серий атома водорода, если положить постоянную R равной
Подстановка числовых значений m e , e, ε 0 и h в эту формулу дает результат
R = 3,29·10 15 Гц,
который очень хорошо согласуется с эмпирическим значением R.
r 1 =5,2917720859(36)×10 −11 м
Энергия ионизации атома водорода Е 1 = 13,595 эВ
Боровское правило квантования связано с волновыми свойствами электронов
Прекрасное согласие боровской теории атома водорода с экспериментом служило веским аргументом в пользу ее справедливости. Однако попытки применить эту теорию к более сложным атомам не увенчались успехом. Бор не смог дать физическую интерпретацию правилу квантования. Это было сделано десятилетием позже де Бройлем на основе представлений о волновых свойствах частиц.
Де Бройль предложил, что каждая орбита в атоме водорода соответствует волне, распространяющейся по окружности около ядра атома. Стационарная орбита возникает в том случае, когда волна непрерывно повторяет себя после каждого оборота вокруг ядра. Другими словами, стационарная орбита соответствует круговой стоячей волне де Бройля на длине орбиты. Это явление очень похоже на стационарную картину стоячих волн в струне с закрепленными концами.
В стационарном квантовом состоянии атома водорода на длине орбиты должно укладываться по идее де Бройля целое число длин волн λ, т. е.
nλ n = 2πr n .
nλ n = 2πr n .
Подставляя в это соотношение длину волны де Бройля λ = h / p, где p = m e υ – импульс электрона, получим:

Опыт Франка-Герца
В 1914 Дж.Франк (1882–1964) и Г.Герц (1887–1975) экспериментально подтвердили правильность представления о квантовании энергетических уровней, бомбардируя атомы паров ртути электронами с известной энергией.
Они измеряли энергию, теряемую электронами при рассеянии на атомах ртути. Электроны с энергией ниже определенного порогового значения вообще не передавали энергию атомам ртути; но, как только энергия электронов оказывалась достаточной для возбуждения перехода атома ртути на ближайший уровень с более высокой энергией, электроны интенсивно передавали свою энергию.
Это было убедительным доказательством существования квантованных энергетических уровней.
Опыт Франка и Герца.
Существование дискретных энергетических уровней атома и доказательство правильности теории Бора подтверждается опытом Франка и Герца.
Немецкие ученые Джеймс Франк и Густав Герц, за экспериментальные исследования дискретности энергетического уровня получили Нобелевскую премию в 1925 г.
Г.Герц
(1887-1975)
Д.Франк
(1882-1964)
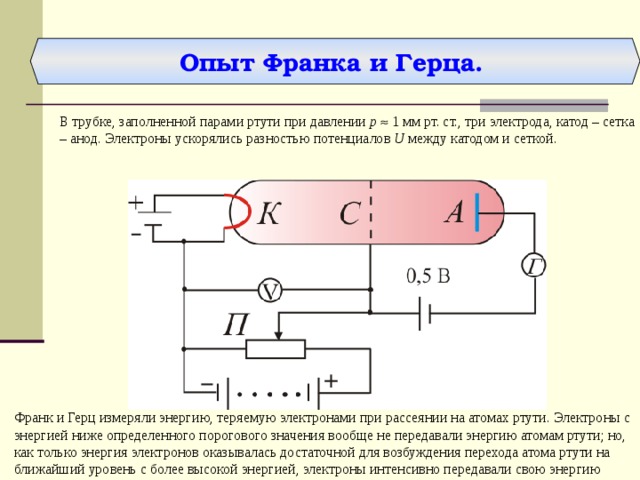
Опыт Франка и Герца.
В трубке, заполненной парами ртути при давлении р 1 мм рт. ст., три электрода, катод – сетка – анод. Электроны ускорялись разностью потенциалов U между катодом и сеткой.
Франк и Герц измеряли энергию, теряемую электронами при рассеянии на атомах ртути. Электроны с энергией ниже определенного порогового значения вообще не передавали энергию атомам ртути; но, как только энергия электронов оказывалась достаточной для возбуждения перехода атома ртути на ближайший уровень с более высокой энергией, электроны интенсивно передавали свою энергию
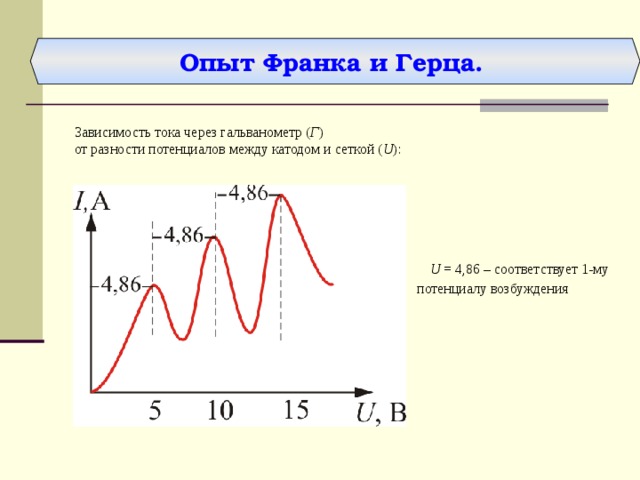
Опыт Франка и Герца.
Зависимость тока через гальванометр ( Г )
от разности потенциалов между катодом и сеткой ( U ):
U = 4,86 – соответствует 1-му потенциалу возбуждения
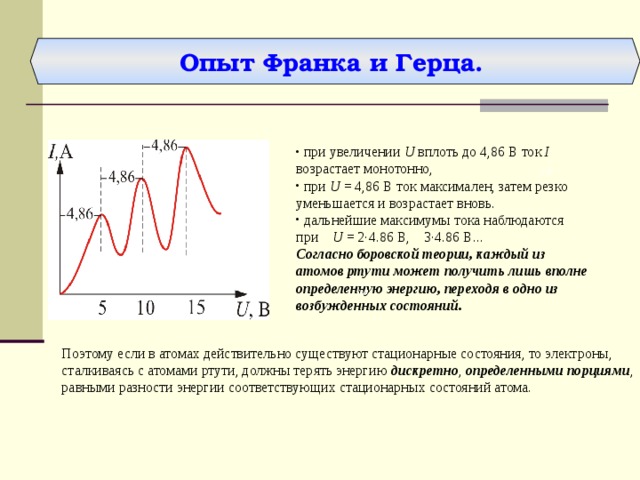
Опыт Франка и Герца.
- при увеличении U вплоть до 4,86 В ток I возрастает монотонно,
- при U = 4,86 В ток максимален, затем резко уменьшается и возрастает вновь.
- дальнейшие максимумы тока наблюдаются при U = 2·4.86 B, 3·4.86 B...
Согласно боровской теории, каждый из атомов ртути может получить лишь вполне определенную энергию, переходя в одно из возбужденных состояний.
Поэтому если в атомах действительно существуют стационарные состояния, то электроны, сталкиваясь с атомами ртути, должны терять энергию дискретно , определенными порциями , равными разности энергии соответствующих стационарных состояний атома.
Опыт Франка и Герца.
Ближайшим к основному, невозбужденному состоянию атома ртути является возбужденное состояние, отстоящее по шкале энергий на 4,86 В. Пока разность потенциалов между катодом и сеткой меньше 4,86 В, электроны, встречая на своем пути атомы ртути, испытывают с ними только упругие соударения. При = 4,86 эВ энергия электрона становится достаточной, чтобы вызвать неупругий удар, при котором электрон отдает атому ртути всю кинетическую энергию , возбуждая переход одного из электронов атома из нормального состояния в возбужденное.
Электроны, потерявшие свою кинетическую энергию, уже не смогут преодолеть тормозящий потенциал и достигнуть анода. Этим и объясняется резкое падение анодного тока при = 4,86 эВ. При значениях энергии, кратных 4,86, электроны могут испытывать с атомами ртути 2, 3, … неупругих соударения. При этом они полностью теряют свою энергию и не достигают анода, т.е. наблюдается резкое падение анодного тока.
Таким образом, опыт показал, что электроны передают свою энергию атомам ртути порциями , причем 4,86 эВ – наименьшая возможная порция, Следовательно, идея Бора о существовании в атомах стационарных состояний блестяще выдержала проверку экспериментом.

Опыт Франка и Герца.
Атомы ртути , получившие при соударении с электронами энергию Δ Е 1 и перешедшие в возбужденное состояни е, спустя время ~ 10 -8 с должны вернуться в основное состояние , излучая, согласно второму постулату Бора фотон с частотой (правило частот):
При этом длина волны светового кванта:
- что соответствует ультрафиолетовому
излучению.
Опыт действительно обнаруживает ультрафиолетовую линию с
Таким образом, опыты Франка и Герца экспериментально подтвердили не только первый, но и второй постулат Бора .

- при увеличении U вплоть до 4,86 В ток I возрастает монотонно,
- при U = 4,86 В ток максимален, затем резко уменьшается и возрастает вновь.
- дальнейшие максимумы тока наблюдаются при
U = 2·4.86 B, 3·4.86 B...
Такой ход кривой объясняется тем, что вследствие дискретности энергетических уровней атомы ртути могут воспринимать энергию бомбардирующих электронов только порциями :
либо
Е 1 , Е 2 , Е 3 … - энергии 1-го, 2-го и т.д. стационарных состояний .
Зашли мы как-то с БЕРКЛИЕМ к ВАНАДИЮ на его ФЕРМИЙ. Сидим, скучаем, на душе СЕРА . Тут БЕРКЛИЙ нам вдруг и СКАНДИЙ : "А не сходить ли нам в ЦИРКОНИЙ ?" А надо сказать, что от нас неподалеку как раз ЦИРКОНИЙ остановился проездом то ли из ТУЛИЯ в САМАРИЙ, то ли из ФРАНЦИЯ в АМЕРИЦИЙ , а может быть даже из ИНДИЯ в ЕВРОПИЙ .
Мы говорим: "Ну ты, БЕРКЛИЙ , ТИТАН !" Стали считать РУБИДИИ . Как раз на три билета хватило. Тут ВАНАДИЙ и говорит: "А я НЕОДИМ , я с ГАЛЛИЙ ". А БЕРКЛИЙ ему: "Раз НЕОДИМ , давай еще рубидии" - и нам под МАРГАНЕЦ . А ВАНАДИЙ , известный ПЛУТОНИЙ , давай АНТИМОНИи разводить: "У меня, мол, одна МЕДЬ АСТАТ , АРГЕНТУМ весь кончился".
Я говорю: "Может, ну ее, ГАЛЛИЙ - вредная она, как МЫШЬЯК !" А ВАНАДИЙ ни в какую - прямо КРЕМНИЙ ! Впился в нас, как БОР . Тогда я, как самый АКТИНИЙ , у него ИТТЕРБИЙ : " ПЛАТИНА , - говорю, - и все тут!" С большим трудом ПАЛЛАДИЙ .
"А кто за билетами-то пойдет? - говорит ВАНАДИЙ - Я вчера с ДУБНИЯ упал, совсем ХРОМ ..." Тогда БЕРКЛИЙ с БЕРИЛЛИЙ наши РУБИДИИ , сунул их в карман и побежал. А ВАНАДИЙ РАДОН , как ТОРИЙ - давай звонить своей ГАЛЛИЙ и что-то ей там про ИНДИЙ за ЛИТИЙ.
Вдруг из окна слышим: " АУРУМ , АУРУМ !" Я говорю: "Никак БЕРКЛИЙ ?" А ВАНАДИЙ : "Нет, НЕОН ". ГАДОЛИНИЙ мы, ГАДОЛИНИЙ , кто бы это был. Слышим опять: " АУРУМ , АУРУМ !"
Вышли мы во двор и видим - по двору БЕРКЛИЙ кругами бегает, а за ним соседский КОБАЛЬТ АРГОН и ГАФНИЙ , ГАФНИЙ на него. Догнал он БЕРКЛИЯ , да как УКСУС его сзади за карман, где наши РУБИДИИ лежат!. Наш БЕРКЛИЙ парень ЖЕЛЕЗО , не уступает: " СУРЬМА , - кричит, - СВИНЕЦ , ПРАЗЕОДИМ проклятый!" А тот знай его ТЕРБИЙ .
Тут БЕРКЛИЙ совсем ЛЮТЕЦИЙ стал. Руками машет, орет: "Кто мне брюки ЛАНТАН будет?" Ну, думаю, все - сейчас БЕРКЛИЙ ГОЛЬМИЙ останется. Подбегаем мы и видим - РУБИДИИ -то наши уже у КОБАЛЬТА во РТУТИ ! Я к нему: " АРГОНЧИК , - говорю, - скажи " ГАФНИЙ ", ну, скажи!" А он только сквозь зубы ЦЕЗИЙ : р-р-р...
Вдруг ВАНАДИЙ СТАННУМ на четвереньки да как рявкнет: " ГАФНИЙ !!!" От неожиданности АРГОН наши РУБИДИИ проглотил и бегом со двора. Я - за ним: " ПОЛОНИЙ , кричу, РУБИДИИ на место!" А ВАНАДИЙ грустно так говорит: "Что он тебе, РОДИЙ их, что ли?"
Изучаем АТОМ
Атом состоит из ядра и окружающего его электронного "облака". Находящиеся в электронном облаке электроны несут отрицательный электрический заряд. Протоны , входящие в состав ядра, несут положительный заряд.
В любом атоме число протонов в ядре в точности равно числу электронов в электронном облаке, поэтому атом в целом – нейтральная частица, не несущая заряда.
Атом может потерять один или несколько электронов или наоборот – захватить чужые электроны. В этом случае атом приобретает положительный или отрицательный заряд и называется ионом .
Практически вся масса атома сосредоточена в его ядре, так как масса электрона составляет всего лишь 1/1836 часть массы протона.
Внешние размеры атома – это размеры гораздо менее плотного электронного облака, которое примерно в 100000 раз больше диаметра ядра.
Кроме протонов, в состав ядра большинства атомов входят нейтроны , не несущие никакого заряда. Масса нейтрона практически не отличается от массы протона. Вместе протоны и нейтроны называются нуклонами (от латинского nucleus – ядро).
Электроны, протоны и нейтроны являются главными "строительными деталями" атомов и называются субатомными частицами.

БЛАГОДАРЮ ЗА ВНИМАНИЕ
Профессор Звонов Валерий Степанович Санкт-Петербургский университет государственной противопожарной службы МЧС России кафедра Физики и теплотехники

«Введение в атомную физику»
Профессор Звонов Валерий Степанович Санкт-Петербургский университет государственной противопожарной службы МЧС России кафедра Физики и теплотехники
Пишите мне [email protected]

ВОПРОСЫ ?
Профессор Звонов Валерий Степанович Санкт-Петербургский университет государственной противопожарной службы МЧС России кафедра Физики и теплотехники





































 " width="640"
" width="640"
























