
Металлы
Подготовила преподаватель
химии, высшей категории
Сафронова М.В.

Цели занятия:
- Повторить положение металлов в ПСХЭ, особенности строения их атомов и кристаллов (металлическую химическую связь и кристаллическую металлическую решетку).
- Обобщить и расширить сведения о физических свойствах металлов и их классификации.
- Повторить особенности протекания реакции металлов с растворами электролитов.
- Развивать логические операции мышления при обобщении знаний и конкретизации общих свойств металлов для отдельных представителей этого класса простых веществ.

вещества
Состоят из атомов
Одного вида
Состоят из атомов
Разного вида

Простые вещества
Химические элементы, образующие в свободном состоянии простые вещества с металлической связью.
Химические элементы,которые образуют в свободном состоянии вещества, не обладающие физическими и химическими свойствами металлов.

Роль металлов в жизни человека и общества.
- В древности человеку были известны только 7металлов: Золото( Au ) ,Серебро( Ag ) ,Медь( Cu ) ,Олово( Sn ) , Свинец( Pb ) ,Железо( Fe ) и Ртуть( Hg ) .
- Сначала человек познакомился с металлами, которые встречаются в самородном виде - это золото,серебро и медь.
- Остальные металлы появились после того,как человек научился добывать их из руд с помощью огня.
- Каменный век → Медный век → Бронзовый век → Железный век.

- Из серебра,золота и меди чеканили монеты.
1. Серебряная монета с изображением богини Афины
и совы.
2. Золотая монета с изображением Александра
Македонского и бога Зевса.
3. Медная монета в виде дельфина.
- Из металлов и их сплавов изготавливаются памятники, статуи.
Царь-пушка
(бронза)
Царь-колокол (бронза) Статуя Колосса Родосского (Бронза)

- Материал, из которого сооружена пирамида Хеопса,изготовлен из камня и меди.

Нахождение в природе

Нахождение металлов в природе
- В виде соединений
- В самородном состоянии ( Au, Pt, Ag)
- В виде солей (галогенидов, карбонатов, нитратов, фосфатов)
- В виде оксидов и сульфидов

Металлы имеют
- металлическую кристаллическую решетку.
е е
е е
- Сравнительно небольшое количество электронов на внешнем энергетическом уровне
Li
2 е 1е

- Имеют свободные валентные электроны
- Подвижные электроны компенсируют электрическое отталкивание между положительно заряженными ионами и тем самым связывают их в твердые тела

Физические свойства металлов.
- Все металлы обладают общими физическими
свойствами, так как во всех металлах существует металлическая химическая связь и металлическая кристаллическая решётка.

Физические свойства металлов
- Твердые вещества, кроме ртути.
(самый мягкий – калий,
самый твердый – хром)

- Пластичные
- Au, Ag, Cu, Sn, Pb,Zn, Fe
уменьшается

- Высокая теплопроводность и электропроводность
Аg Сu Аu Аl Мg Zn Fе РЬ Hg
Электропроводность и теплопроводность металлов обусловлена их строением. Хаотически движущиеся электроны под действием электрического напряжения приобретают направленное движение, в результате чего возникает электрический ток.

Легкоплавкие тугоплавкие
Hg, Ga, Cs, In, Bi W, Mo, V, Cr

легкие тяжелые
( Li –самый легкий, (осмий – самый тяжелый,
K , Na, Mg) Ir, Pb)

- Обладают металлическим блеском

Причины, приводящие к различию в физических свойств металлов
- Атомы металлов образуют разные типы кристаллических решеток

Причины, приводящие к различию физических свойств
- Атомы металлов имеют разное число валентных электронов, участвующих в образовании металлической связи
- Атомы (ионы) имеют разные радиусы

Положение металлов в Периодической системе Д. И.Менделеева

В группах:
- металлические свойства усиливаются
причина:
1.увеличивается заряд ядра,
2.число электронов на внешнем не изменяется
3.радиус атома увеличивается
В периодах:
- металлические свойства уменьшаются
причина:
1. увеличивается заряд ядра
2. число электронов на внешнем увеличивается
3. радиус атома уменьшается

Все металлы проявляют только восстановительные свойства
Атомы металлов легко отдают электроны внешнего (а некоторые – и предвнешнего) электронного слоя, превращаясь в положительные ионы.
Металлы имеют большой атомный радиус и малое число электронов (от 1 до 3) на внешнем слое.
Исключение:
Ge, Sn, Pb ─ 4 электрона;
Sb, Bi ─ 5 электронов;
Po ─ 6 электронов

Химические свойства металлов
- Металлы в химических реакциях являются восстановителями, при этом они окисляются
M o – ne =M n+
Al, Be, Mg, Ca, Li, Na, K, Rb, Cs
Восстановительная способность возрастает

- Металлы вытесняются из их соединений другими металлами
- Н.Н. Бекетов – создал «вытеснительный ряд» (прототип электрохимического ряда напряжения металлов)
Li, K, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Ni, Sn, Pb, (H) , Cu, Hg, Ag, Pt, Au .

Химические свойства металлов

Взаимодействие с неметаллами:
Li K Ca Na
Mg Al Zn Cr Fe Ni Pb Cu Hg Ag
При обычных условиях
4Li + O 2 → 2Li 2 O
2Na + O 2 → Na 2 O 2
Медленно или при нагревании
Pt Au
4Al + O 2 → 2Al 2 O 3
3Fe + 2O 2 = Fe 3 O 4
M + O 2 ≠

Взаимодействие со сложными веществами :
с водой
Li K Ca Na
Mg Al Zn Cr Fe Ni Pb (H 2 )
При обычных условиях
2Me + 2H 2 O = 2MeOH + H 2
Cu Hg Ag Pt Au
При нагревании
3Fe + 4H 2 O → Fe 3 O 4 + 4H 2
M + H 2 O ≠

Взаимодействие растворами кислот
Li K Ca Na Mg Al |Zn Cr Fe Ni Pb ( H 2 ) Cu Hg Ag Pt Au
Zn + 2HCl → ZnCl 2 + H 2
Не вытесняют H 2 ↑ из растворов кислот

Взаимодействие с растворами солей
«Каждый металл вытесняет из растворов солей другие металлы, находящиеся правее него в ряду напряжений, и сам может быть вытеснен металлами, расположенными левее»
Fe + CuSO 4 → Cu↓ +FeSO 4

Какие реакции практически осуществимы?
Реагирующие вещества
K
О 2
Ca
Н 2 О
Fe
HCl
( раствор)
Cu
Pb(NO 3 ) 2
раствор
Au
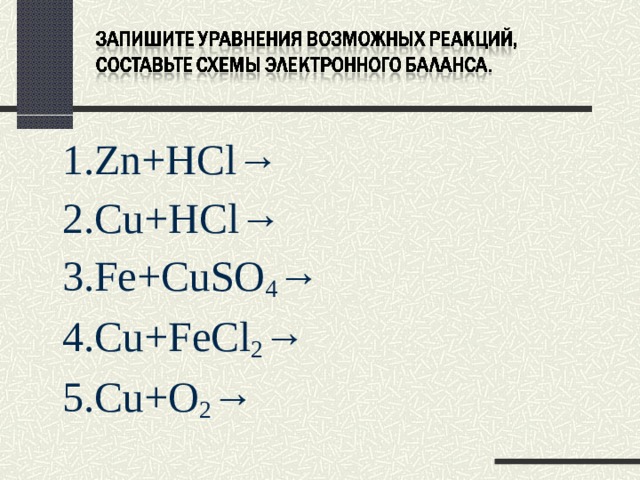
1. Zn + HCl→
2. С u+HCl→
3.Fe+CuSO 4 →
4. Cu + FeCl 2 →
5. Cu + O 2 →

Выводы :
- Все металлы имеют --------------- кристаллическую решетку.
- В металлах осуществляется --------------------- связь.
- Основные физические свойства металлов – металлический блеск, электро- и теплопроводность, пластичность обусловлены ---------------------- металлов.
- Металлы проявляют только ------------------------ свойства, потому что в реакциях они всегда ---------- свои электроны.
- Металлы используют в основном в виде --------------.

РЕФЛЕКСИЯ
1. Вам было легко или были трудности?
2. Какое задание было самым интересным и почему?
3.Как вы можете использовать полученные знания на уроке при изучении других предметов и в жизни?
4.Как бы вы оценили свою работу?

Применение металлов
медицина
Станкострое-ние
Сельское хозяйство
Для получения сплавов
- Металлургическая промыш-ленность
Домашнее хозяйство
Польза и вред металлов для человека
_
+
Кадмий – накапливаясь в почках, приводит к гипертонии, снижению иммунитета, слабоумию. Содержится в табачном дыме, питьевой воде, загрязненном воздухе
Кальций – основа структурной костной ткани организма человека. Самое необходимое для человека минеральное вещество.
Медь - играет важную роль в обеспечении иммунной защиты, в том числе противорадиационной и противораковой, участвует в энергетическом обмене и кроветворении, в образовании защитного пигмента кожи меланина
Алюминий – старческое слабоумие, нарушение вазомоторных реакций, анемия, заболевание почек и печени. Пищевая фольга, посуда, пивные банки.
Свинец - нарушение мозговой деятельности, раковые заболевания, нарушение детородной функции у женщин. Загрязненный воздух – выхлопные газы автомобилей
Железо - необходимо для жизни, для образования гемоглобина (красных кровяных телец), миоглобина (красный пигмент в мышцах) и некоторых ферментов
Нельзя допустить, чтобы люди направляли на свое собственное уничтожение те силы природы, которые они сумели открыть и покорить.
Ф. Жолио-Кюри

Получение металлов
- Пирометаллургическим способом -восстановление углеродом, оксидом углерода ( II ), водородом при высокой температуре.
- Алюминотермическим способом
- Гидрометаллургическим способом – получение из руды более активным металлом или из растворов
- Электролизом – с помощью электрического тока из расплавов или растворов

Домашнее задание
Подготовить сообщение по теме:
«Химические и физические свойства металла ( AL Cu Fe Cr) и его связь в моей профессиональной деятельностью».
Учебник Химия для спо О.С.Габриелян,. Параграф 7.1, стр.110-113. задание №3 после параграфа.
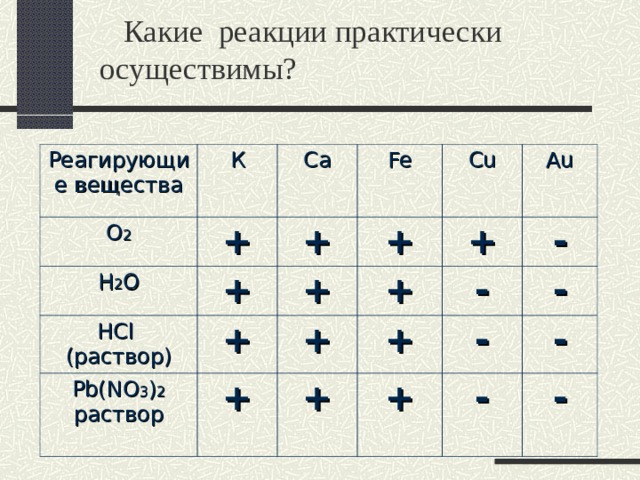
Какие реакции практически осуществимы?
Реагирующие вещества
К
О 2
+
Ca
Н 2 О
+
Fe
+
HCl
( раствор)
+
+
Pb(NO 3 ) 2
раствор
+
Cu
+
+
Au
+
+
-
+
-
+
-
-
+
-
-
-

Выводы :
- Все металлы имеют металлическую кристаллическую решетку.
- В металлах осуществляется металлическая связь.
- Основные физические свойства металлов – металлический блеск, непрозрачность, электро- и теплопроводность, пластичность обусловлены строением металлов.
- Металлы проявляют только восстановительные свойства, потому что в реакциях они всегда отдают свои электроны.
- Металлы используют в основном в виде сплавов.
- Металлы имеют важное значение в жизни человека.
























































