
9 класс
Бозаджи Н.М.
учитель химии
высшей категории

Скажи мне – и я забуду,
Покажи мне – и я запомню,
Вовлеки меня – и я научусь!
Китайская мудрость

Цель : После прочитанного фрагмента выбрать правильный ответ ,написав букву правильного ответа и как результат – тема нашего урока!

1. Уголь – ценнейшее из полезных ископаемых, – ответил инженер, - и природа как будто решила доказать это, создав алмаз, ибо он, в сущности, не что иное, как кристаллический углерод.
Ж.Верн «Таинственный остров»

Б) озон
К) графит
А) карбин
Р) фуллерен

2 .Между тем Рукодельница воротится, воду процедит, в кувшины нальет, да еще какая затейница: коли вода нечиста, так свернет лист бумаги, положит в нее угольков да песку крупного насыплет, вставит ту бумагу в кувшин да нальет в нее воды, а вода-то, знай проходит сквозь песок да сквозь уголья и капает в кувшин чистая, словно хрустальная.
Русская народная сказка «Мороз Иванович»

Б) фильтрование
А) дистилляция
О) адсорбция
М) кристаллизация

3. Угарный газ! – вскричал Холмс.- Подождите немного. Сейчас он уйдет.
Заглянув в дверь, мы увидели, что комнату освещает только тусклое синее пламя, мерцающее в маленькой медной жаровне посредине… В раскрытую дверь тянуло страшным ядовитым чадом, от которого мы задыхались и кашляли.
А.К.Дойл «Случай с переводчиком»

3.Найдите химические ошибки в прочитанном отрывке. Почему Холмс и его спутники не могли по описанным признакам определить присутствие угарного газа в помещении?
Н) угарный газ не имеет запаха
Г) угарный газ имеет приятный запах
А) при отравлении угарным газом человек не кашляет

4. В аравийской пустыне растет дерево Caratina silikva (каратина силиква), косточки плодов которого всегда имеют одинаковый вес в любой год и на любом дереве. Поэтому ювелиры древности и применяли для своих весов такие гирьки, называя их каратами. В наши дни существует каратная проба золота и драгоценных камней.

И) 100 г
З) 0,5 г
Т) 0,2 г
Р) 0,1 г

5 . - Вы слышали об эффекте «собачьей пещеры» в Италии? Есть там такая пещера - яма. Человек войдет и ходит, а собака или кролик погибают через несколько минут.
- Почему?
- Из вулканической трещины выделяется углекислый газ…
В.Короткевич «Черный замок Ольшанский»

Ы) СО 2 тяжелее воздуха и скапливается внизу
А) СО 2 безопасен для человека, но вреден для животных
Ж) человек входит в пещеру в противогазе
5. Почему в «собачьей пещере» человек остается живым, а собаки и другие мелкие животные гибнут?

1 2 3 4 5
К А Р Б О Н А Т Ы

- Что такое карбонаты ? Кабонаты - это соли угольной кислоты, что и будет предметом обсуждения на сегодняшнем уроке.

30.04.15г

В результате изучения темы, вы будете способны:
- Давать характеристику угольной
- Давать характеристику угольной
кислоте и её свойствам .
2. Моделировать способы получения угольной кислоты
3. Рассматривать свойства солей угольной кислоты.
4. Моделировать качественную реакцию на карбонат ион
5.Писать уравнения реакций
6.Осуществлять рефлексию своей деятельности
- кислоте и её свойствам . 2. Моделировать способы получения угольной кислоты 3. Рассматривать свойства солей угольной кислоты. 4. Моделировать качественную реакцию на карбонат ион 5.Писать уравнения реакций 6.Осуществлять рефлексию своей деятельности

- У́гольная кислота́ — слабая двухосновная кислота с химической формулой H 2 CO 3
Задание 1. Напишите уравнения реакций
ступенчатой диссоциации угольной кислоты :
H 2 CO 3 H + + HCO 3 -
HCO 3 - H + + CO 3 2 -
H 2 CO 3 2H + + CO 3 2 -

NB! Двухосновная, образует 2 рода солей:
средние – карбонаты (ионы CO 3 2- )
кислые – гидрокарбонаты (ионыНCO 3 - )

- Угольная кислота – нестойкая, в чистом виде не выделена, так как легко разлагается на углекислый газ и воду (процесс обратимый)
H 2 CO 3 CO 2 ↑ +H 2 O
Опыт

1. Растворением в воде углекислого газа
CO2 ↑ + H2O H2CO3
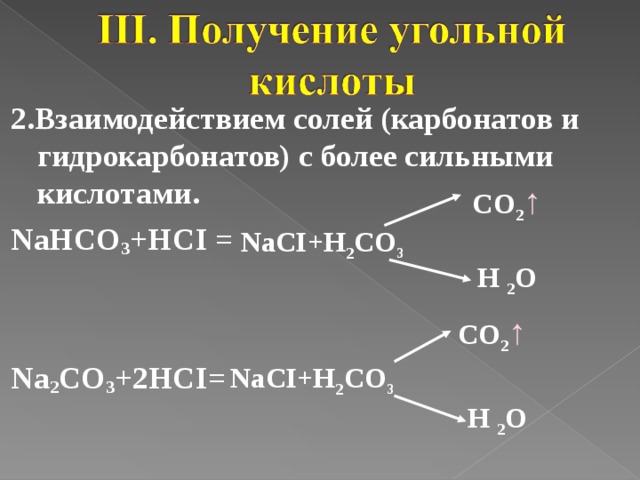
2.Взаимодействием солей (карбонатов и гидрокарбонатов) с более сильными кислотами .
NaHCO 3 +HCI =
Na 2 CO 3 +2HCI=
CO 2 ↑
NaCI+H 2 CO 3
H 2 O
CO 2 ↑
NaCI+H 2 CO 3
H 2 O


IV. Соли угольной кислоты и их растворимость
Химическая формула
Название
Na 2 CO 3
Растворимость
Сода кальцинированная
NaHCO 3
Сода питьевая
K 2 CO 3
CaCO 3
Поташ
Мел, мрамор, известняк
MgCO 3
Доломит
Р
Р
Р
Н
Н

V. Химические свойства карбонатов и гидрокарбонатов
1) Взаимодействие гидрокарбонатов с кислотами
Na Н CO 3 + HCl =
питьевая
сода
2) Вступают в реакции обмена с другими растворимыми солями
Na 2 CO 3 + CaCl 2 =
NaCl + H 2 O + CO 2 ↑
CaCO 3 ↓ + 2 NaCl

Химические свойства карбонатов и гидрокарбонатов
3) Карбонаты и гидрокарбонаты могут превращаться друг в друга
СаСО 3 + СО 2 ↑ + Н 2 О = Са(НСО 3 ) 2
Са(НСО 3 ) 2 = СаСО 3 + СО 2 ↑ + Н 2 О
4) Разложение гидрокарбонатов и карбонатов при нагревании
NaHCO 3 t˚C → Na 2 CO 3 + H 2 O + CO 2 ↑
CaCO 3 t ˚ C → CaO + CO 2 ↑
Исключение:
карбонаты металлов I группы, гл. подгруппы

Химические свойства карбонатов и гидрокарбонатов
Гидрокарбонаты обуславливают временную жесткость воды.
Способы устранения временной жесткости воды:
1. Кипячение
При кипячении растворимые гидрокарбонаты кальция и магния превращаются в нерастворимые карбонаты.
2. Добавление соды ( Na 2 CO 3 )
Устраняется не только временная, но и постоянная жесткость воды, создаваемая хлоридами и сульфатами кальция и магния.

VI. Определение карбонатов
Определение карбонат – ионов
CO 2 ↑
Ca CO 3 +2HCI=CaCI 2 + H 2 CO 3
H 2 O
CO 2 ↑ +Ca(OH) 2 =CaCO 3 ↓+ H 2 O

VII. Значение карбонатов
- Среди карбонатов особое внимание заслуживает карбонат кальция CaCO3 , встречающийся в виде:
известняка мрамора мела

VII. Значение карбонатов
На Земле живут три брата
Из семейства карбонатов.
Старший брат– красавец –Мрамор,
Славен именем Карары,
Превосходный зодчий. Он
Строил Рим и Парфенон.
Всем известен Известняк,
Потому и назван так.
Знаменит своим трудом,
Возводя за домом дом.

VII. Значение карбонатов
И способен и умел
Младший мягкий братец Мел.
Как рисует, посмотри,
Этот СаСО 3 .
Любят братья порезвиться,
В жаркой печке прокалиться.
CaO да CO 2 образуются тогда.
Это углекислый газ,
Каждый с ним знаком из вас,
Выдыхаем мы его.

VII. Значение карбонатов
Ну а это CaO –
Жарко обожженная
ИЗВЕСТЬ НЕГАШЕННАЯ.
Добавляем к ней воды,
тщательно мешая,
Чтобы не было беды,
руки защищаем.
Круто замешанная ИЗВЕСТЬ,
но ГАШЕННАЯ!
Известковым молоком
величается.

VII. Значение карбонатов
Светлый дом повеселел,
Превратив известку в мел.
Фокус- покус для народа:
Стоит лишь подуть сквозь воду,
Как она легко-легко превратится в молоко!
А теперь довольно ловко получаю газировку:
Молоко плюс уксус, Ай!
Льется пена через край!
Все в заботах, все в работе
От зари и до зари –
Эти братья Карбонаты,
Эти CaCO 3!

Химическая формула вещества
Тривиальное (историческое) название
ZnCO 3
Современное название
Галмей
Na 2 CO 3
Применение
вещества
NaHCO 3
Карбонат цинка
Кальцинированная сода
Питьевая сода
Производство красок.
Na 2 CO 3 ·10H 2 O
Карбонат натрия
MgCO 3
Кристаллическая сода
Умягчение воды, производство стекла.
Гидрокарбонат натрия
В пищевой про-мышленности, в медицине.
Десятиводный гидрат карбоната натрия
Смесь MgCO 3 и CaCO 3 (1:1)
Жжённая магнезия
(CuOH) 2 CO 3
Доломит
Для умягчения воды при стирке белья.
Карбонат магния
В медицине.
Смесь карбонатов магния и кальция
Малахит
K 2 CO 3
В строительстве.
Основной карбонат меди ( II)
Поташ
CaCO 3
Поделки, ювелирные украшения.
Карбонат калия
Мел, мрамор, известняк
Пр-во стекла, керамики, цемента, удобрение.
Карбонат кальция
Пр-во строительных материалов.

Рефлексия
Задание 1. Напишите уравнение реакции получения карбоната кальция из гидроксида кальция
Ca(OH) 2 +CO 2 = CaCO 3 + H 2 O

Задание 2. Как из карбоната кальция получить гидрокарбонат кальция? Напишите уравнение реакции.
CaCO 3 ↓ +H 2 O+CO 2 = Ca(HCO 3 ) 2

Задание 3 . Возможно ли обратное превращение? Если да, то назовите способы превращения.
t 0
Ca(HCO 3 ) 2 = CaCO 3 + H 2 O + CO 2
Ca(HCO 3 ) 2 + Na 2 CO 3 =CaCO 3 +2NaHCO 3

Задание 4 . Установите соответствие между левыми и правыми частями уравнений
правые части
уравнений
а) K 2 SO 4 + 2CO 2 + 2H 2 O
б) Ca(HC О 3 ) 2
в) K 2 CO 3 + CO 2 + H 2 O
г) CaO + CO 2
д) 2NaCI + CO 2 + H 2 O
левые части уравнений
t o
1 ) 2KHCO 3 →
t o
2)CaCO 3 →
3)Na 2 CO 3 + 2HCI →
4) С aCO 3 +CO 2 +H 2 O →
5)2KHCO 3 + H 2 SO 4 →
Ответ : 1 –в; 2 -г; 3-д; 4-б; 5-а

1.На уроке я работал… 2.Своей работой на уроке я… 3.Урок для меня показался… 4.За урок я… 5.Мое настроение… 6.Материал урока мне был…
активно, доволен, коротким, не устал, полезен, стало лучше, понятен, интересен, легким.

- Разобрать и выучить конспект.
- Повторить параграф: § 4.14.2
- Выполнить задания:
работа в группах упр.1(9-15) стр.112























































