

СДЕЛАЙТЕ СВОИ УРОКИ ЕЩЁ ЭФФЕКТИВНЕЕ, А ЖИЗНЬ СВОБОДНЕЕ
Благодаря готовым учебным материалам для работы в классе и дистанционно
Скидки до 50 % на комплекты
только до
Готовые ключевые этапы урока всегда будут у вас под рукой
Организационный момент
Проверка знаний
Объяснение материала
Закрепление изученного
Итоги урока

Была в сети 17.10.2023 07:16

Дъячук Людмила Владимировна
преподаватель биологии, химии
Местоположение
Россия, Барабинск
Специализация
Презентация по теме "Химическая связь"
Категория:
Химия
14.11.2018 07:38





![Между анионами и катионами возникают силы электростатического притяжения, которые осуществляют ионную химическую связь. Этот тип связи характерен для соединений типичных металлов с типичными неметаллами. Например, .. Na• + •Cl: → Na + [Cl] - . .](https://fsd.multiurok.ru/html/2018/11/14/s_5beba6d4aa8df/img3.jpg)


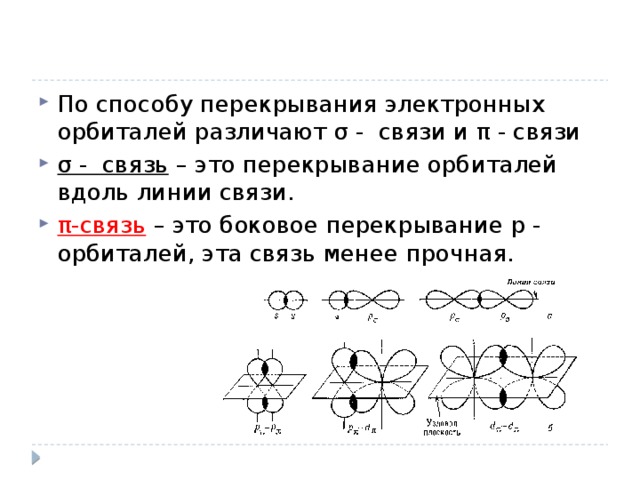





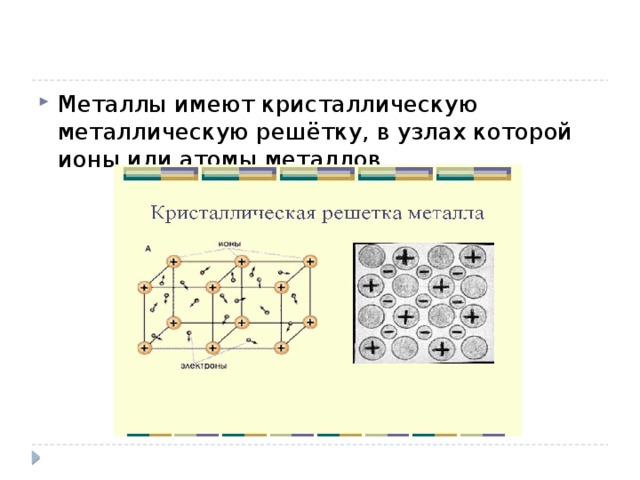







![Список использованных источников 1. Ерохин, Ю.М. Химия [Текст]: учеб. для сред. проф. учеб. заведений / Ю.М. Ерохин; под ред. В.Н.Николаева. – 8-е изд., стер. – М.: Издательский центр «Академия», 2007. – 384 с. 2. Габриелян, О.С. Химия. 11 класс. Углубленный уровень [Текст]: учебник/ О.С. Габриелян, И.Г. Остроумов, С.Ю. Пономарёв; под. ред. Т.Д. Гамбурцева. – 5-е изд., стереотип. – М.: Дрофа, 2017. – 368 с. 3. Радецкий, А.М., Горшкова, В.П., Кругликова, Л.Н. Дидактический материал по химии для 10-11 классов [Текст]: пособие для учителя / под ред. Е.К. Липкина. – М.: Просвещение, 2008. – 79 с. 4. Яндекс картинки https://yandex.ru/images/search?textD0%B8%D0%B7%D0%BD%D0%B8&stype=image&lr=65&noreask=1&parent-reqid=1475903999184409-13365433093687541860103608-sfront6-016&source=wiz](https://fsd.multiurok.ru/html/2018/11/14/s_5beba6d4aa8df/img20.jpg)










