Презентация может быть использована при изучении темы "Кислоты" как при дистанционном обучении, так и в школе при очном обучении. Рассмотрены основные вопросы темы, добавлены видео-опыты, что позволяет сделать изложение теории более наглядным. Структура презентации, использование анимации позволяет организовать беседу и изучать новый материал с опорой на имеющиеся у ученика знания.
Просмотр содержимого документа
«Презентация по теме "Кислоты"»

Повторение
- Распределите формулы из предоставленного перечня по основным классам неорганических соединений и назовите их:
- HBr, SO 3 , КН, KOH, HNO 3 , N 2 O 5 , H 2 SO 4 , Ca(OH) 2 , K 2 O, Al 2 O 3 , Zn(OH) 2 ,CaH 2 , H 2 S, Fe(OH) 3 .
1. Оксиды: …
2. Водородные соединения:
- гидриды металлов: …
- летучие водородные соединения: …
3. Основания: …
3/23/18

Вещества
Мы изучили!
Металлы
Простые
Неметаллы
Бинарные соединения
ОСНОВАНИЯ Ме(ОН) х
Сложные
КИСЛОТЫ
3/23/18

3/23/18
Кислоты
8 класс
Автор: Кунова Г.В. учитель химии ЦДО, г. Липецк.

Кислоты в природе
- В природе встречается много кислот:
ЩАВЕЛЕВАЯ
ЯБЛОЧНАЯ
УКСУСНАЯ
ЛИМОННАЯ
МУРАВЬИНАЯ
3/23/18
Кислоты в природе
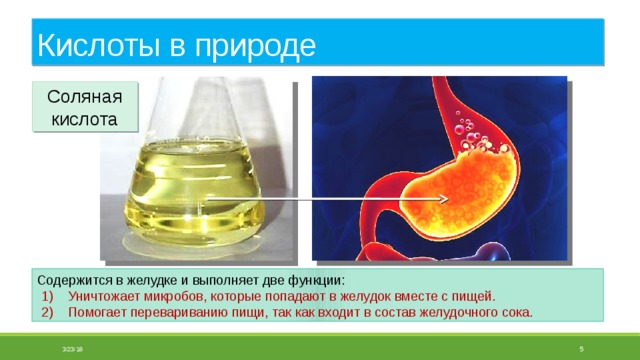
Соляная кислота
Содержится в желудке и выполняет две функции:
- Уничтожает микробов, которые попадают в желудок вместе с пищей.
- Помогает перевариванию пищи, так как входит в состав желудочного сока.
3/23/18

Прочитайте формулы кислот: H Cl , H 2 SO 4 , H 3 PO 4
- Что общего во всех этих формулах?
В молекулах кислот содержатся один или несколько атомов водорода.
- Чем различаются эти формулы?
Остальная часть молекулы называется кислотным остатком.
Общая формула H n R
3/23/18

КИСЛОТЫ
Классификация кислот
- По числу атомов водорода – ОСНОВНОСТЬ
Одноосновные (HCl - , HNO 3 - )
Двухосновные (H 2 S 2- , H 2 SO 4 2- )
Трехосновные (H 3 PO 4 3- )
Многоосновные
3/23/18
КИСЛОТЫ
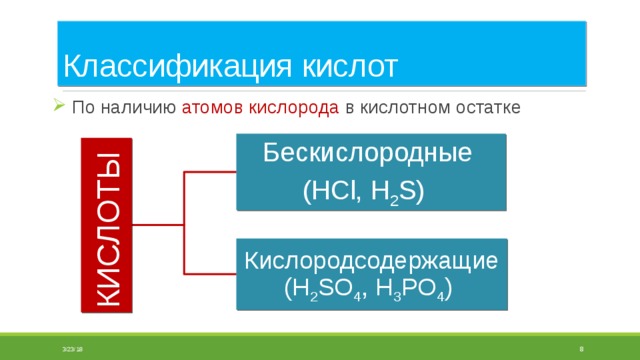
Классификация кислот
- По наличию атомов кислорода в кислотном остатке
Бескислородные
(HCl, H 2 S)
Кислородсодержащие (H 2 SO 4 , H 3 PO 4 )
3/23/18
 H 2 +1 S +6 O 4 -2 3/23/18 " width="640"
H 2 +1 S +6 O 4 -2 3/23/18 " width="640"
Алгоритм определения с.о. атома неметалла , образующего кислотный остаток в молекуле кислоты
Следует помнить!
Сумма степеней окисления атомов химических элементов в соединении = 0.
С.о. кислорода -2; с.о. водорода +1.
- Неизвестную с.о. элемента в формуле кислоты обозначаем + Х
- Находим сумму с.о. всех химических элементов в формуле кислоты и приравниваем ее к нулю.
- Решаем уравнение с одним неизвестным и вычисляем х
Пример:
H 2 + 1 S +Х O 4 -2
(+1)*2 + ( +Х ) + (-2)*4 = 0, Х = 0 + 8 – 2 = +6.
С.о. серы в серной кислоте +6 = H 2 +1 S +6 O 4 -2
3/23/18

Составление формулы оксида соответствующего кислоте.
- Зная степень окисления элемента-неметалла, образующего кислотный остаток кислородсодержащей кислоты, можно определить, какой оксид ей соответствует.
- Пример:
- Серной кислоте H 2 SO 4 , в которой у серы степень окисления равна +6 , соответствует оксид серы ( VI ) S +6 O 3 .
3/23/18

Составление формулы оксида соответствующего кислоте.
Пример:
10
+5
НNO 3
N O
+5
-2
2
5
3/23/18

Физические свойства кислот
Кислоты
Кислоты
(по агрегатному состоянию)
(по растворимости)
Растворимые в воде
H 2 SO 4 , Н 3 РО 4
Жидкие
HCl,
H 2 SO 4
Нерастворимые в воде
H 2 SiO 3
Твердые
Н 3 ВО 3 , Н 3 РО 4
3/23/18

Как приготовить раствор кислоты?
Вывод:
3/23/18
12

Действие кислот на индикаторы
Вывод:
Индикатор
Цвет индикатора в растворе кислоты
ЛАКМУС
Краснеет
Красно-розовая
МЕТИЛ-ОРАНЖ
Бесцветный
ФЕНОЛФТАЛЕИН
3/23/18
12

Качественная задача: в какой из пробирок находится - вода - щелочь - кислота?
3/23/18

Серная кислота H 2 SO 4
При обычных условиях — тяжёлая маслянистая жидкость без цвета и запаха.
3/23/18

- Угольная и сернистая кислоты - H 2 CO 3 и H 2 SO 3 - в свободном виде не существуют , так как они разлагаются на воду и соответствующий оксид (газ):
- Кремниевая кислота H 2 SiO 3 нерастворима в воде (↓).
3/23/18

Задание
3/23/18

Домашнее задание:
3/23/18

Источники:
- Габриелян, О. С. Химия. 8 класс: учеб. для общеобразоват. учреждений / О. С. Габриелян. 2-е изд., М. : Дрофа, 2013.
- Габриелян, О. С. Химия. 8 класс: рабочая тетрадь к учебнику О.С. Габриеляна «Химия. 8 класс» / О. С. Габриелян, С.А. Сладков.- М. : Дрофа, 2013.
- Интернет-ресурсы: рисунки, модели молекул.
- http :// www.youtube.com : видео-опыты.
3/23/18















 H 2 +1 S +6 O 4 -2 3/23/18 " width="640"
H 2 +1 S +6 O 4 -2 3/23/18 " width="640"





















