Просмотр содержимого документа
«Презентация по теме "Водородные соединения" (8 класс)»

3/23/18
Задание
Оксиды металлов
Оксиды неметаллов
Na 2 O – оксид натрия
N 2 O 5 – оксид азота (V)
CuO – оксид меди (II)
SO 2 – оксид серы (IV)
Fe 2 O 3 – оксид железа (III)
Cl 2 O 7 – оксид хлора
Cu 2 O – оксид меди (I)
P 2 O 5 – оксид фосфора

3/23/18
Бинарные водородные соединения
Химия – 8
Автор: Кунова Г.В. учитель химии ЦДО, г. Липецк.

3/23/18
Бинарные водородные соединения элементов
Водородные соединения металлов (гидриды)
Летучие водородные соединения
МеН n
неМеН n

3
3/23/18
- Водородные соединения металлов
- Гидриды металлов - это белые кристаллические вещества , нелетучие и тугоплавкие.
- Получают при взаимодействии металлов с водородом при 200-600°С.
- Связь между атомами металла и водорода ионная.
- Примеры: LiH, CaH 2 , AlH 3 .
Гидрид кальция
Гидрид алюминия
Гидрид лития

3/23/18
3
Задание
Аммиак
Физические свойства
NH 3
Области применения
Хлороводород
HCl

3/23/18
- Летучие водородные соединения
Аммиак NH 3
- При н.у. - это бесцветный газ с резким характерным запахом (запах нашатырного спирта).
- Ядовит!
- Аммиак почти вдвое легче воздуха.
- Растворимость NH 3 в воде чрезвычайно велика — около 1200 объёмов (при 0 °C) или 700 объёмов (при 20 °C) в объёме воды.
Интересные факты:
- Облака Юпитера состоят из аммиака.
- Пары нашатырного спирта способны изменять окраску цветов. Например, голубые и синие лепестки становятся зелеными, ярко красные − черными.
- Некоторые цветы, не имеющие запаха от природы, после обработки аммиаком начинают благоухать. Например, приятный аромат приобретают астры.

3/23/18
- Хлороводород HCl – бесцветный, дымящий на воздухе газ.
- t пл = 114,2°C, t кип = 85,1°C.
- Хорошо растворяется в воде с образованием соляной кислоты.
Водный раствор широко используется для получения хлоридов, для травления металлов, очистки поверхности сосудов, скважин от карбонатов, обработки руд, при производстве каучуков, глутамината натрия, соды, хлора и других продуктов. Также применяется в органическом синтезе.
Вдыхание хлороводорода может привести к кашлю, удушью, воспалению носа, горла и верхних дыхательных путей, а в тяжёлых случаях, отёк легких, нарушение работы кровеносной системы, и даже смерть. Контактируя с кожей может вызывать покраснение, боль и серьёзные ожоги. Хлористый водород может вызвать серьёзные ожоги глаз и их необратимое повреждение.
Использовался как отравляющее средство во время войн.

3/23/18
Растворение аммиака в воде
Растворение хлороводорода в воде
3/23/18
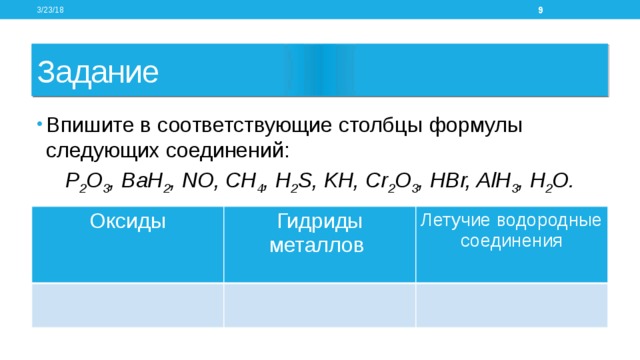
Задание
- Впишите в соответствующие столбцы формулы следующих соединений:
P 2 O 3 , BaH 2 , NO, СH 4 , H 2 S, KH, Cr 2 O 3 , HBr, AlH 3 , H 2 O.
Оксиды
Гидриды металлов
Летучие водородные соединения

3/23/18
Домашнее задание

3/23/18
Оцени свое настроение после нашего урока
1
2
3

3/23/18
Источники:
- Габриелян, О. С. Химия. 8 класс: учеб. для общеобразоват. учреждений / О. С. Габриелян. 2-е изд., М. : Дрофа, 2013.
- Габриелян, О. С. Химия. 8 класс: рабочая тетрадь к учебнику О.С. Габриеляна «Химия. 8 класс» / О. С. Габриелян, С.А. Сладков.- М. : Дрофа, 2013.
- Интернет-ресурсы: рисунки, модели молекул.
- http://www.youtube.com/watch?v=_pPDa-1bKBY : Видео-опыт «Растворение хлороводорода в воде».





























