Просмотр содержимого документа
«Презентация "Сера"»

Химия . 9 класс Неметаллы
Сера
Шнякина Марина Юрьевна, учитель химии ОУ «Луговская школа» Таврического района Омской области

Этимология названия
В отличие от кислорода (от лат. Oxigenium – «рождающий кислоту»), селена (от лат. Selene – Луна) и теллура (от лат. Tellus – Земля), происхождение названия «сера» неизвестно.

Исторические сведения
- Сера известна с глубокой древности и упоминается Гомером в «Одиссее» как лекарство от недугов.
- В Древнем Египте серу использовали для приготовления красок, косметических средств.
- В Древней Греции, сжигая серу, дезинфицировали помещение и вещи.
- В Древнем Риме ее использовали для лечения кожных заболеваний.
- В средние века сера была одним из «начал» у алхимиков, считалась необходимой составной частью «философского камня».

Цель урока
Изучить особенности строения, свойства и значение серы.

План исследования
- Положение серы в ПС.
- Распространение серы в природе.
- Аллотропные видоизменения серы.
- Степени окисления серы и соединения серы.
- Биологическая роль серы.

Работа в тетрадях
Этапы исследования
Задачи
Положение серы в ПС
Результаты исследований
Распространение серы в природе
Аллотропные видоизменения серы
Степени окисления серы и соединения серы
Биологическая роль серы

1 . ПОЛОЖЕНИЕ СЕРЫ В ПС
- Каков химический знак?
- В какой группе периодической системы находится?
- В каком периоде находится?
- Какой атомный номер?
- Какая относительная атомная масса?
- Сколько электронов в атоме? Как располагаются электроны на АО?
- Какая электронная формула серы?
- Какие низшая (в соединениях с водородом и металлами) и высшая (в соединении с кислородом) валентности серы?

Сера:
Порядковый номер № 16
Период : 3 период
Группа: VI группа, главная подгруппа

32
+16
6
2
8
3d 0
3p 4
3s 2
2p 6
2s 2
1s 2
Валентные возможности- II;IV;VI
1 s 2 2s 2 2p 6 3s 2 3p 4
Краткая электронная запись-

2. Сера в природе
?
Какие природные соединения, содержащие серу, вам известны?

Сера в природе
халькопирит CuFeS 2
галенит PbS
пирит FeS 2
киноварь HgS
самородная сера S
гипс Са SO 4 . 2H 2 O

3. Аллотропия серы
3. Физические свойства
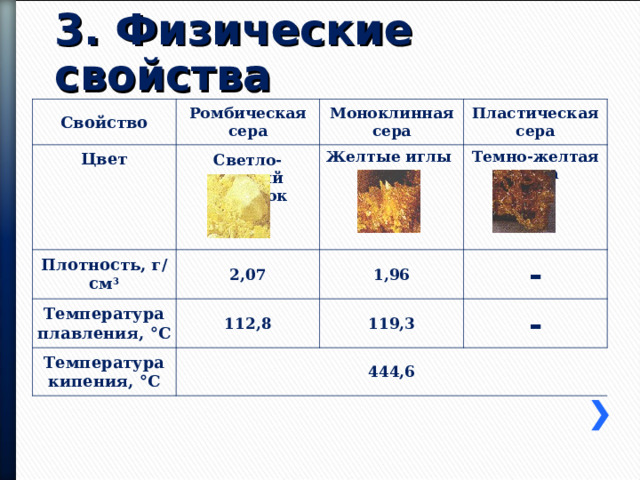
Свойство
Ромбическая сера
Цвет
Моноклинная сера
Светло-желтый порошок
Пластическая сера
Желтые иглы
Плотность, г/см 3
Температура плавления, °С
Темно-желтая масса
2,07
Температура кипения, °С
1,96
112,8
119,3
-
444,6
-

Работа в тетрадях
Физические свойства серы
Ф.С.:
Тв., желтая, хрупкая, Н (нераст.в Н2О), Р (раст.) в CS 2 , не смачивается водой (флотация), плохо проводит тепло и ток

Плохо проводит теплоту и не проводит электрический ток.
Сера в воде практически не растворяется
Температура плавления 120 0 С
Твёрдое кристаллическое вещество желтого цвета, без запаха.

4. Химические свойства
Какими окислительно-восстановительными свойствами обладает сера?
?

4. Химические свойства
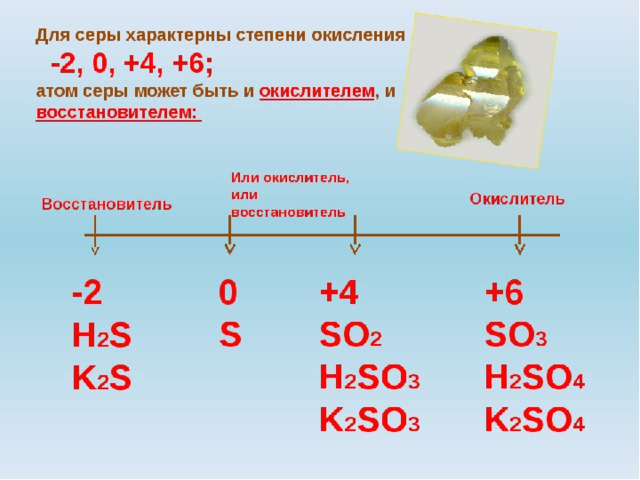
Сера – окислитель
Сера – восстановитель
При взаимодействии с какими веществами сера проявляет окислительные, а с какими – восстановительные свойства?
?

Химические свойства
Закончите уравнения реакций:
Сера – восстановитель
Сера – окислитель
S + O 2 =
S + F 2 =
S + H 2 =
S + Na =
S + Fe =
S + Hg =

Химические свойства
Закончите уравнения реакций:
Сера – восстановитель
Сера – окислитель
H 2 S
SO 2
S + H 2 =
S + Na =
S + Fe =
S + Hg =
S + O 2 =
S + F 2 =
Na 2 S
2
3
SF 6
FeS
HgS

?
Почему сера в соединениях с металлами проявляет степень окисления –2, а в соединениях с кислородом и галогенами +4 и +6?

5. Биологическая роль серы
- Сера участвует в ОВР в организмах растений и животных
- Сера входит в состав белков и аминокислот
- Особенно много серы в волосах, шерсти, рогах, копытах
- Соединения серы обнаружены в хрящах, костях, в желчи

Учебник: §26, упр. 2,

http://school-collection.edu.ru
http://ido.tsu.ru
http://900igr.net
http://www.terramarina.okis.ru







































