СЛОЖНЫЕ ЭФИРЫ
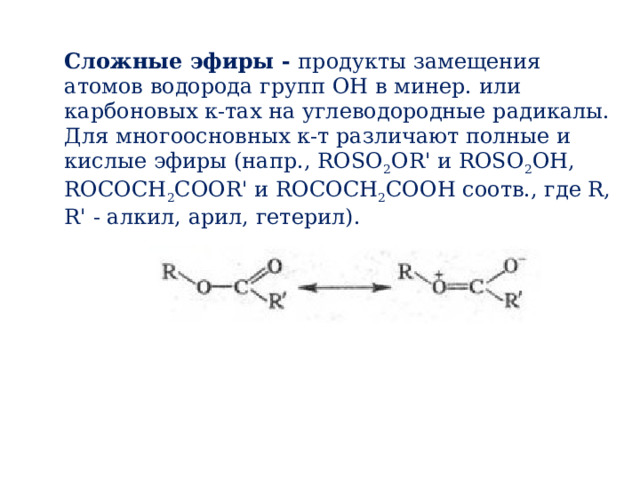
Сложные эфиры - продукты замещения атомов водорода групп ОН в минер. или карбоновых к-тах на углеводородные радикалы.
Для многоосновных к-т различают полные и кислые эфиры (напр., ROSO 2 OR' и ROSO 2 OH, ROCOCH 2 COOR' и ROCOCH 2 COOH соотв., где R, R' - алкил, арил, гетерил).

Сложные эфиры карбоновых кислот — соединения с общей формулой R–COOR', где R и R' — углеводородные радикалы. В сложных эфирах муравьиной кислоты R – атом водорода.
Общая формула сложных эфиров, образованных предельными одноосновными кислотами и предельными одноосновными спиртами такая же, как у карбоновых кислот: C n H 2n O 2 или
КЛАССИФИКАЦИЯ
Сложные эфиры можно получить как на основе карбоновых кислот, так и на основе минеральных (неорганических) кислот. Но эфиры минеральных кислот встречаются реже.
Сложные эфиры карбоновых кислот можно разделить на три группы .

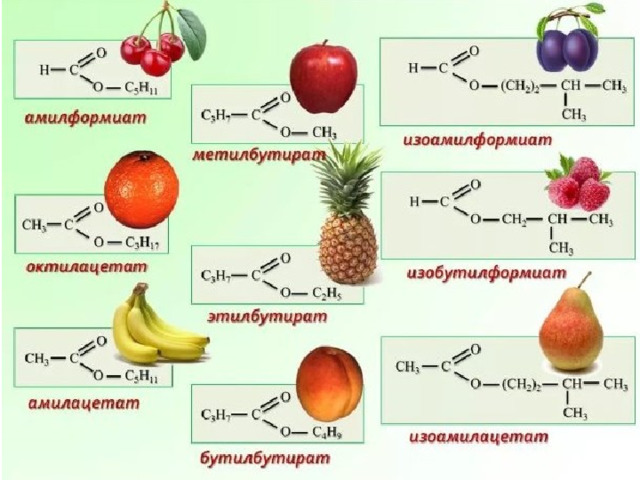
Если число атомов С в исходных карбоновой кислоте и спирте не превышает 6–8, соответствующие сложные эфиры представляют собой бесцветные маслянистые жидкости, чаще всего с фруктовым запахом. Они составляют группу фруктовых эфиров.
Если в образовании сложного эфира участвует ароматический спирт (содержащий ароматическое ядро), то такие соединения обладают, как правило, не фруктовым, а цветочным запахом.
Все соединения этой группы практически нерастворимы в воде, но легко растворимы в большинстве органических растворителей.

При увеличении размеров органических групп, входящих в состав сложных эфиров, до С 15 — С 30 соединения приобретают консистенцию пластичных, легко размягчающихся веществ. Эту группу называют восками , они, как правило, не обладают запахом.
Воски не смачиваются водой, растворимы в бензине, хлороформе, бензоле.

Третья группа – жиры. В отличие от предыдущих двух групп на основе одноатомных спиртов ROH, все жиры представляют собой сложные эфиры, образованные из трехатомного спирта глицерина НОСН 2 –СН(ОН)–СН 2 ОН. Карбоновые кислоты, входящие в состав жиров, как правило, имеют углеводородную цепь с 9–19 атомами углерода.
Животные жиры (коровье масло, баранье, свиное сало) – пластичные легкоплавкие вещества. Растительные жиры (оливковое, хлопковое, подсолнечное масло) – вязкие жидкости.
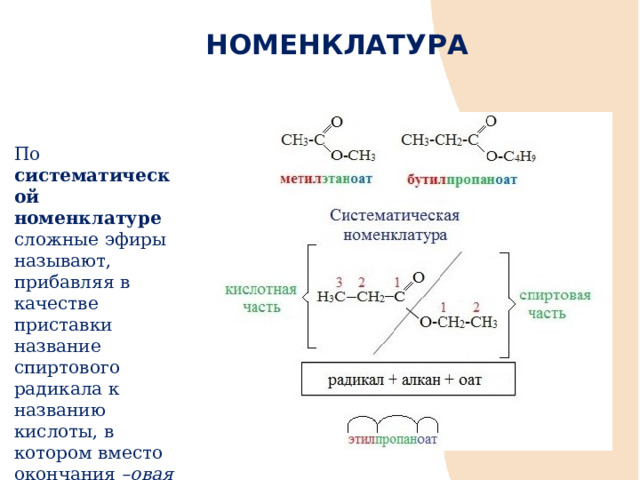
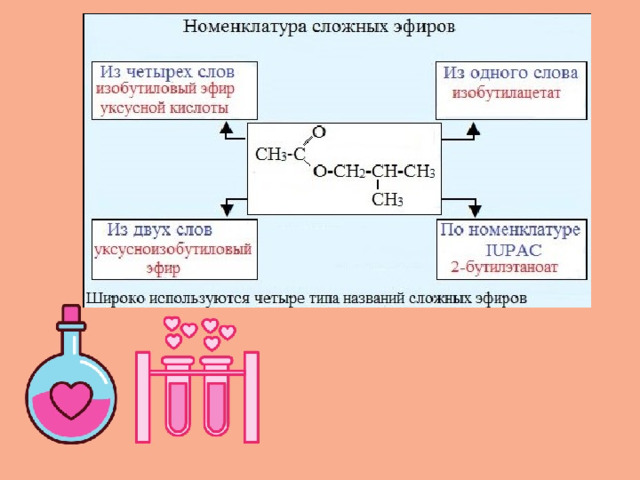
НОМЕНКЛАТУРА
По систематической номенклатуре сложные эфиры называют, прибавляя в качестве приставки название спиртового радикала к названию кислоты, в котором вместо окончания –овая кислота используют суффикс –оaт , например :
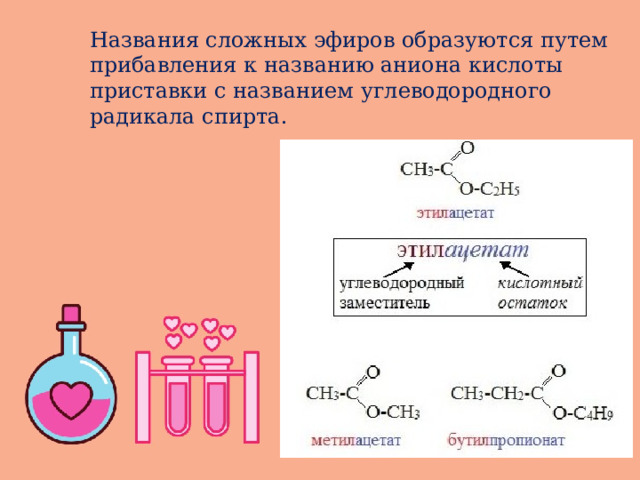
Названия сложных эфиров образуются путем прибавления к названию аниона кислоты приставки с названием углеводородного радикала спирта.
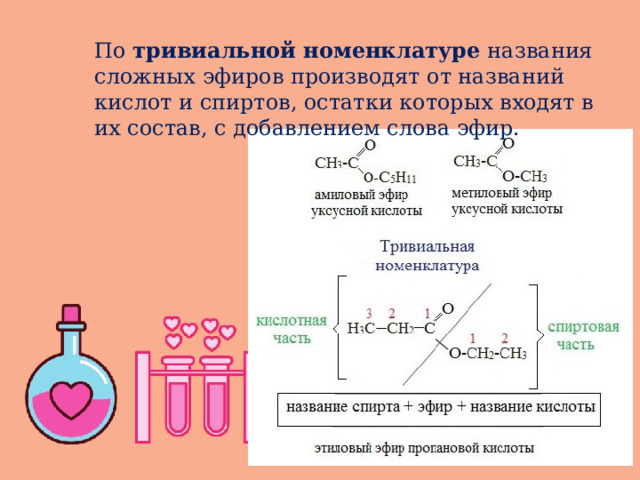
По тривиальной номенклатуре названия сложных эфиров производят от названий кислот и спиртов, остатки которых входят в их состав, с добавлением слова эфир.
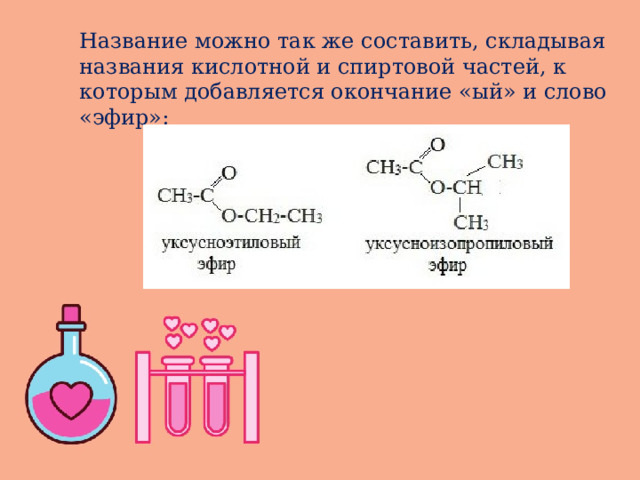
Название можно так же составить, складывая названия кислотной и спиртовой частей, к которым добавляется окончание «ый» и слово «эфир»:


ИЗОМЕРИЯ
1. Изомерия углеродной цепи начинается по кислотному остатку с бутановой кислоты, по спиртовому остатку – с пропилового спирта, например, метилбутирату изомерны метилизобутират, пропилацетат и изопропилацетат .
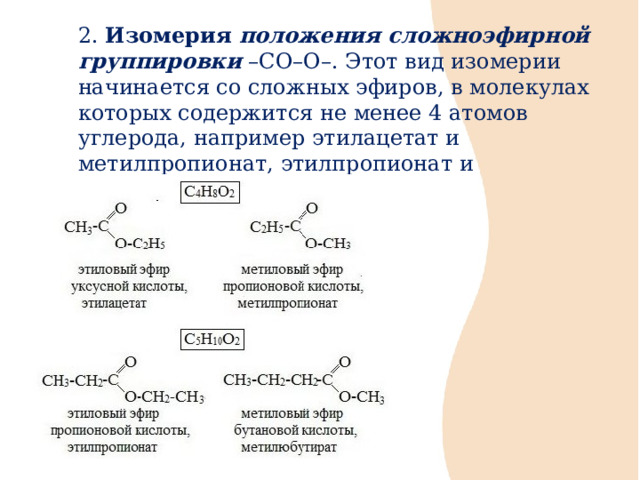
2. Изомерия положения сложноэфирной группировки –СО–О–. Этот вид изомерии начинается со сложных эфиров, в молекулах которых содержится не менее 4 атомов углерода, например этилацетат и метилпропионат, этилпропионат и метилбутират.
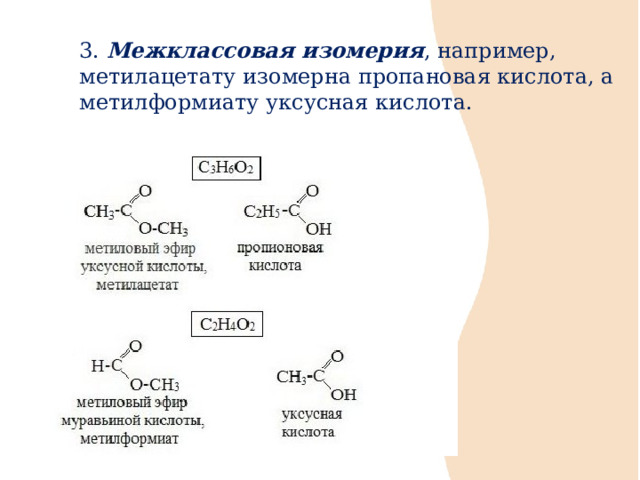
3. Межклассовая изомерия , например, метилацетату изомерна пропановая кислота, а метилформиату уксусная кислота.

Для сложных эфиров, содержащих непредельную кислоту или непредельный спирт, возможны еще два вида изомерии: изомерия положения кратной связи и цис- , транс -изомерия .

ФИЗИЧЕСКИЕ СВОЙСТВА
Сложные эфиры низших карбоновых кислот и спиртов представляют собой летучие жидкости, многие из которых обладают приятным цветочным или фруктовым запахом. Они практически нерастворимы в воде и имеют более низкие температуры кипения, чем изомерные им карбоновые кислоты. Это связанно с тем, что в молекулах сложных эфиров отсутствуют межмолекулярные водородные связи.


Сложные эфиры высших жирных кислот и спиртов – воскообразные вещества , не имеют запаха, в воде не растворимы, хорошо растворяются в органических растворителях.
Воски бывают растительные, животные, ископаемые и синтетические.
Растительные воски
Пальмовый воск находится в углублениях кольчатого ствола восковой пальмы, откуда его соскабливают. Одно дерево дает 12 кг воска. Растительные воски покрывают тонким слоем листья, стебли, плоды и защищают их от размачивания водой, высыхания, вредных микроорганизмов, иногда в качестве резервных липидов входят в состав семян (например, «масло» жожоба).

Животные воски
Пчелиный воск наиболее известный из этого вида восков. Он содержит сложный эфир пальмитиновой кислоты и мирицилового спирта (мирицилпальмитат, пальмитиномирициловый эфир):
CH 3 (CH 2 ) 14 –CO–O–(CH 2 ) 29 CH 3
Из пчелиного воска пчелы строят соты, шерстяной (ланолин) предохраняет шерсть и кожу животных от влаги, засорения и высыхания
Шерстяной (шерстный) воск – ланолин – обильно покрывает шерсть животных.
К воскам относятся кожное сало и ушная сера.
.

Ископаемые воски
Торфяной воск получают экстракцией бензином при 80 0 С верхового битуминозного торфа.
Буроугольный воск (монтан-воск) извлекают бензином из бурого битуминозного угля.
Горный воск (озокерит) – минерал из группы нефтяных битумов.
Синтетическим воски получают на основе нефтяных и смоляных парафинов и их производных.

ХИМИЧЕСКИЕ СВОЙСТВА
1. Реакция гидролиза (омыления)
Сложные эфиры легко гидролизуются (омыляются) на исходный спирт и кислоту водой (обратимо) или щелочами (необратимо, так как образующаяся карбоновая кислота превращается в соль).
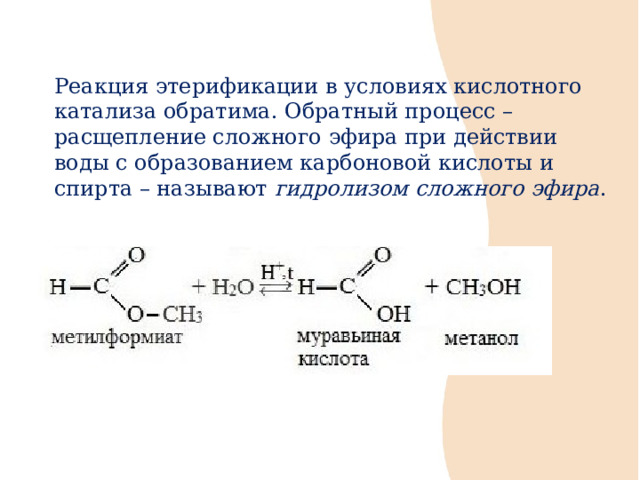
Реакция этерификации в условиях кислотного катализа обратима. Обратный процесс – расщепление сложного эфира при действии воды с образованием карбоновой кислоты и спирта – называют гидролизом сложного эфира .
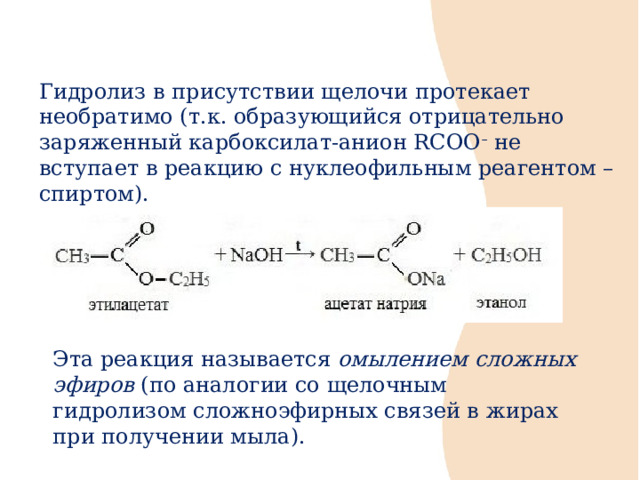
Гидролиз в присутствии щелочи протекает необратимо (т.к. образующийся отрицательно заряженный карбоксилат-анион RCOO – не вступает в реакцию с нуклеофильным реагентом – спиртом).
Эта реакция называется омылением сложных эфиров (по аналогии со щелочным гидролизом сложноэфирных связей в жирах при получении мыла).
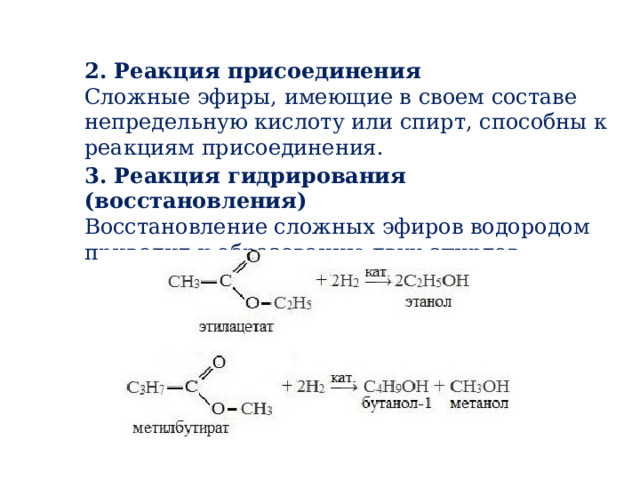
2. Реакция присоединения
Сложные эфиры, имеющие в своем составе непредельную кислоту или спирт, способны к реакциям присоединения.
3. Реакция гидрирования (восстановления)
Восстановление сложных эфиров водородом приводит к образованию двух спиртов:
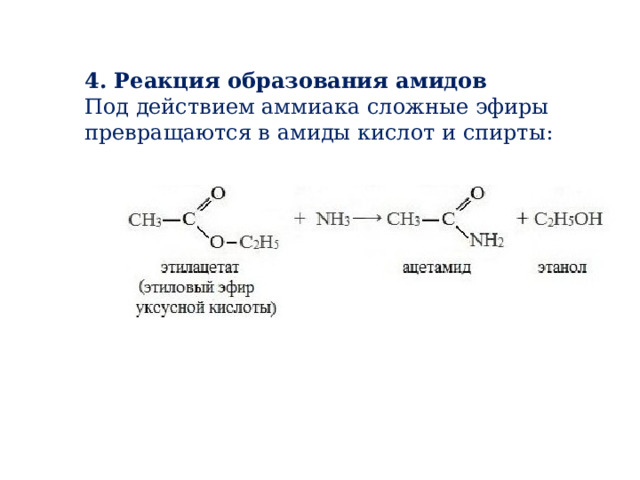
4. Реакция образования амидов
Под действием аммиака сложные эфиры превращаются в амиды кислот и спирты:

5. Реакция горения
Горение сложных эфиров происходит с образованием углекислого газа и воды:





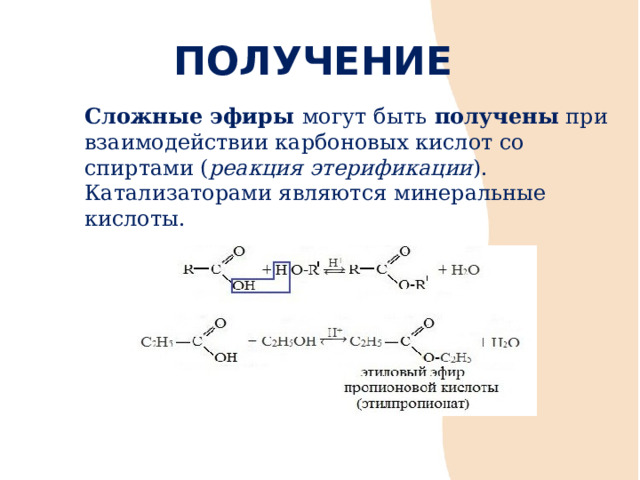
ПОЛУЧЕНИЕ
Cложные эфиры могут быть получены при взаимодействии карбоновых кислот со спиртами ( реакция этерификации ). Катализаторами являются минеральные кислоты.
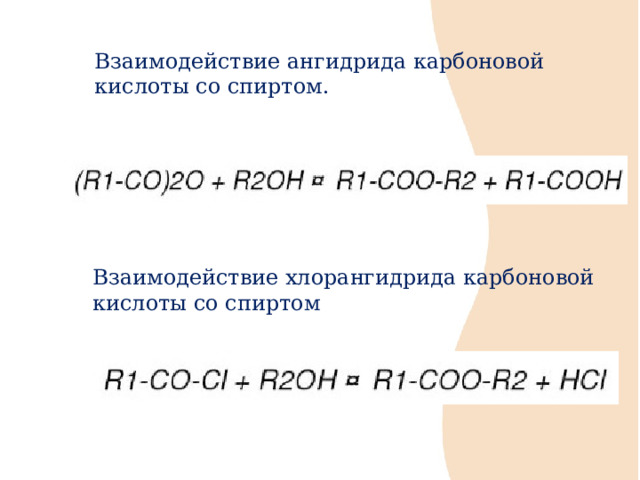
Взаимодействие ангидрида карбоновой кислоты со спиртом.
Взаимодействие хлорангидрида карбоновой кислоты со спиртом
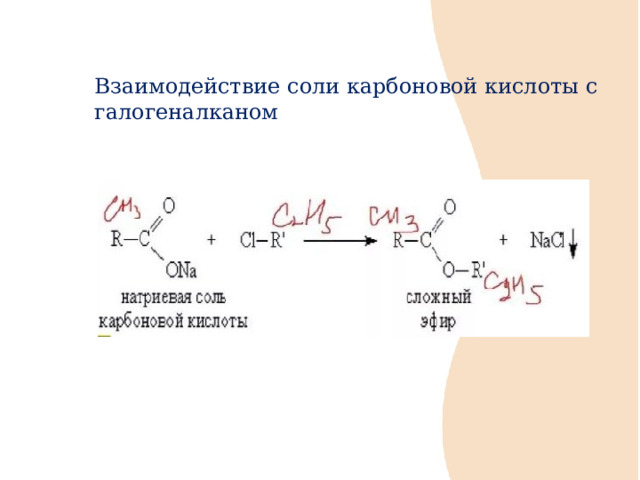
Взаимодействие соли карбоновой кислоты с галогеналканом

ПРИМЕНЕНИЕ
Сложные эфиры используются в парфюмерии, косметике, в качестве пищевых добавок, для изготовления искусственных волокон, краски, лаков, клея. Сложные эфиры служат исходными веществами в производстве многих фармацевтических препаратов
Благодаря тому, что они смешиваются со многими органическими веществами, используются как растворители для лаков и красок.

Этилформиат и этилацетат используются как растворители целлюлозных лаков.
Винилацетат используется для производства поливинилацетатных смол, клеев и красок.
Сложные эфиры на основе низших спиртов и кислот используют в пищевой промышленности при создании фруктовых эссенций, а сложные эфиры на основе ароматических спиртов – в парфюмерной (изготовление мыла, духов, кремов) промышленности.
Из восков изготавливают политуры, смазки, пропиточные составы для бумаги (вощеная бумага) и кожи, они входят и в состав косметических кремов и лекарственных мазей.