Просмотр содержимого документа
«Презентация урока по химии в 8 классе "Ковалентная химическая связь"»

«Ковалентная химическая связь»
Урок химии в 8 классе
2019 год
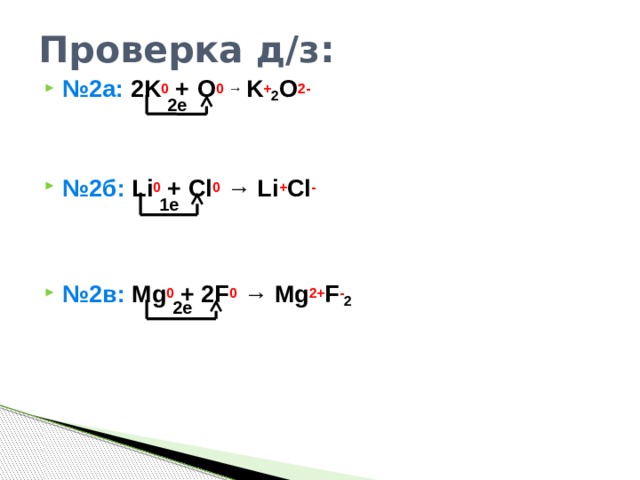
Проверка д/з:
- № 2а: 2K 0 + O 0 → K + 2 O 2-
- № 2б: Li 0 + Cl 0 → Li + Cl -
- № 2в: Mg 0 + 2F 0 → Mg 2+ F - 2
2e
1e
2e

№ 3: Самый типичный металл – Fr,
cамый типичный неметалл - F.
Вещества с ионной связью:
CaH 2 , BaCl 2 , Na 2 O, K 2 S, RbF.

Среди перечисленных элементов
максимальный радиус атома имеет
- Хлор
- Магний
- Натрий
- Алюминий

Радиус атома увеличивается в ряду:
- Be, Mg, Ca
- I, Br, Cl
- B, C, N
- N, P, S

Выберите ионные соединения:
SO 2 , H 2 O, BaO, MgF 2 , O 2 , NH 3 , CH 4 , FeCl 3 , O 3 ,
K 2 O, C 2 H 2 , NaH, CO 2 .
BaO
MgF 2
FeCl 3
K 2 O
NaH

Составьте схемы образования ионной связи
между:
- Натрием и азотом
- Алюминием и фтором
- Кальцием и кислородом

В каком из соединений – LiCl или KCl – связь
более ионная?
KCl

Ковалентная связь
.
.
.
.
.
.
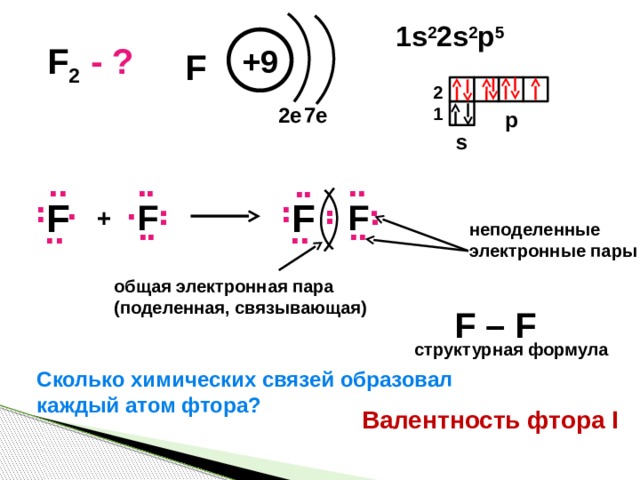
1s 2 2s 2 p 5
F 2
- ?
+9
F
2
7e
2e
1
p
s
.
.
.
.
.
.
.
.
.
.
.
.
.
.
F
F
F
F
+
.
.
.
.
.
.
.
.
неподеленные
электронные пары
общая электронная пара
(поделенная, связывающая)
F – F
структурная формула
Сколько химических связей образовал
каждый атом фтора?
Валентность фтора I

Валентность – это число химических связей
данного атома в соединении.
Химическая связь, возникающая при
образовании общих электронных пар,
называется ковалентной (атомной) связью.
.
.
.
.
.
.
.
.
.
.
.
.
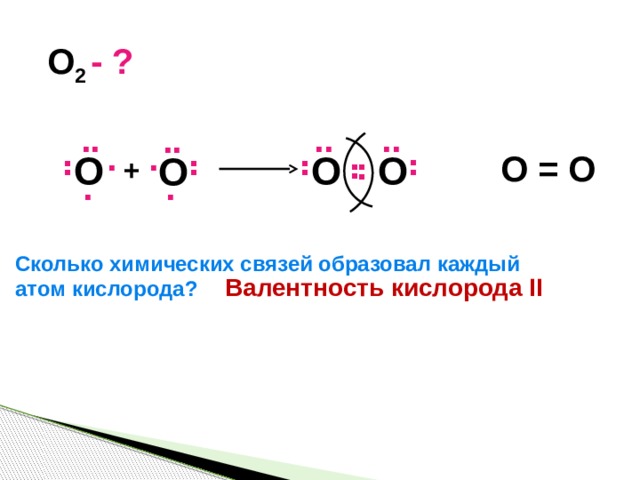
- ?
O 2
.
.
.
.
.
.
.
.
.
.
O = O
O
O
O
O
+
.
.
Сколько химических связей образовал каждый
атом кислорода?
Валентность кислорода II
.
.
.
.
.
.
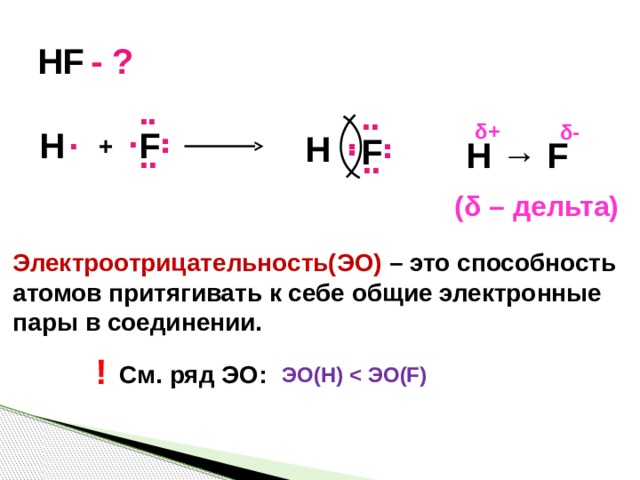
HF
- ?
.
.
.
.
.
.
δ+
δ-
F
H
H
F
+
.
.
H → F
.
.
(δ – дельта)
Электроотрицательность(ЭО) – это способность
атомов притягивать к себе общие электронные
пары в соединении.
!
См. ряд ЭО:
ЭО(H)
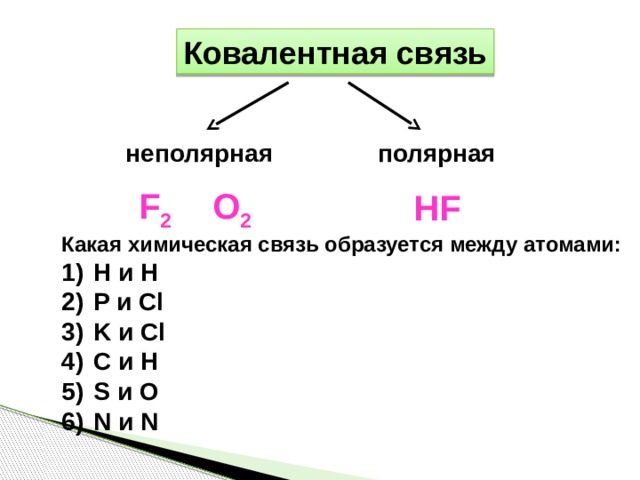
Ковалентная связь
неполярная
полярная
O 2
F 2
HF
Какая химическая связь образуется между атомами:
- H и H
- P и Cl
- K и Cl
- C и H
- S и O
- N и N

Домашнее задание:
- § 11, 12(до стр. 75)
- Стр.70 №2, 3-обязательно, №4-дополнительно

Источники: 1) О.С.Габриелян Химия 8 класс учебник, Москва, «Дрофа», 2013 2) Е.В.Савинкина, Н.Д.Свердлова Сборник задач и упражнений по химии.

































