Просмотр содержимого документа
«Презентация к уроку химии по теме "Аллотропные модификации углерода"»

ГУО «Брестский областной лицей имени П.М. Машерова»
Аллотропные модификации углерода
Подготовили учащиеся 11 «Б» класса Гуринчук Анастасия, Аракелян Карина

УГЛЕРОД
- Углеро́д (химический символ C ; лат. C arboneum ) — химический элемент IVA группы (C, Si, Ge, Sn, Pb) 2-го периода периодической системы химических элементов. Порядковый номер 6, атомная масса — 12,0107.

- Углерод — вещество с самым большим числом аллотропических модификаций (более 9 обнаруженных на данный момент).
- Аллотропные модификации углерода по своим свойствам наиболее радикально отличаются друг от друга, от мягкого к твёрдому, непрозрачного к прозрачному, недорогого к дорогому. Эти аллотропы включают аморфные аллотропы углерода (уголь, сажа), нанопена, кристаллические аллотропы — нанотрубка, алмаз, фуллерены, графит, лонсдейлит и церафит.
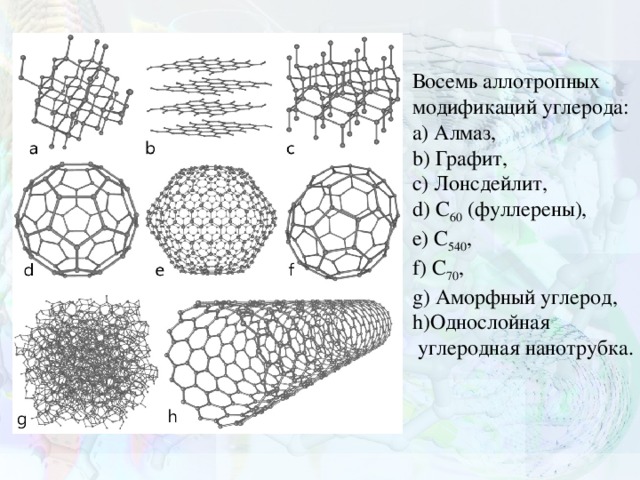
Восемь аллотропных модификаций углерода: a) Алмаз, b) Графит, c) Лонсдейлит, d) C 60 (фуллерены), e) C 540 , f) C 70 , g) Аморфный углерод, h)Однослойная углеродная нанотрубка.
Алмаз
Алмаз – самый твердый из всех природных веществ – используют для резки стекла и для бурения горных пород.
- Физические свойства. Алмаз – прозрачное, бесцветное, кристаллическое вещество, обладающее высокой светопреломляемостью. Алмазы образуют отдельные кристаллы, образующие кубическую гранецентрированную решетку – одна половина атомов в кристалле расположена в вершинах и центрах граней одного куба, а другая – в вершинах и центрах граней другого куба, смещенного относительно первого в направлении его пространственной диагонали. sp3-гибридизация. Атомы образует трехмерную тетраэдрическую сетку, где они связаны ковалентными связями.
- Химические свойства алмаза. Из простых веществ алмаз имеет максимальное число атомов, расположенных плотно друг к другу, отчего он прочный и твердый. Прочность связей в углеродных тетраэдрах обуславливает высокую химическую устойчивость алмаза. На него действует лишь F2 и O2 при 800 °C.
Плавится алмаз (неограненный или ограненный) при температуре 3700-4000°C, полностью сгорает (превращается в углекислый газ) на воздухе уже при температуре 1000°С. Без доступа воздуха алмаз превращается в графит при 2000°С.

Графит
- Графит – кристаллы темно-серого цвета, со слабым металлическим блеском, маслянистый на ощупь. sp3-гибридизация. Каждый атом образует по 3 ковалентных связи с соседними атомами под углом 120° – образуется плоская сетка, состоящая из правильных шестиугольников, в вершинах которых находятся атомы С. Образовавшиеся слои С идут параллельно друг другу. Связи между ними слабые, их обеспечивают электроны, не участвующие в гибридизации орбиталей. Связь атомов С в разных слоях носит частично металлический характер – обобществление электронов всеми атомами.
- Графит обладает относительно высокой электро– и теплопроводностью, стоек к нагреванию. Из графита изготавливают карандаши.
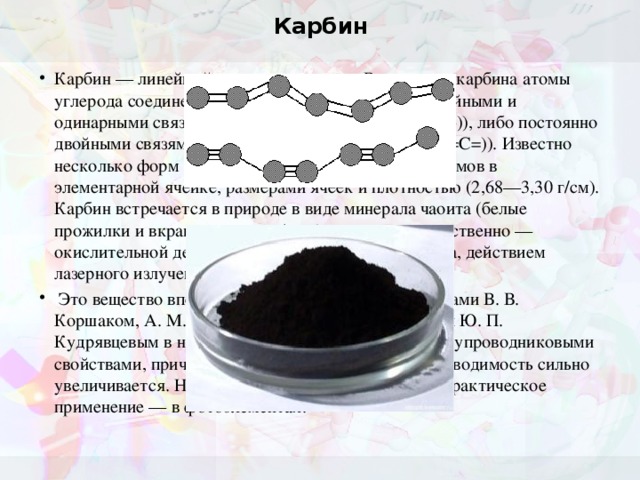
Карбин
- Карбин — линейный полимер углерода. В молекуле карбина атомы углерода соединены в цепочки поочередно либо тройными и одинарными связями (полиеновое строение (—CC—)), либо постоянно двойными связями (поликумуленовое строение (=C=C=)). Известно несколько форм карбина, отличающихся числом атомов в элементарной ячейке, размерами ячеек и плотностью (2,68—3,30 г/см). Карбин встречается в природе в виде минерала чаоита (белые прожилки и вкрапления в графите) и получен искусственно — окислительной дегидрополиконденсацией ацетилена, действием лазерного излучения на графит, из углеводородов.
- Это вещество впервые получено советскими химиками В. В. Коршаком, А. М. Сладковым, В. И. Касаточкиным и Ю. П. Кудрявцевым в начале 60-х гг. Карбин обладает полупроводниковыми свойствами, причём под воздействием света его проводимость сильно увеличивается. На этом свойстве основано первое практическое применение — в фотоэлементах.

- Фуллерены и Углеродные нанотрубки
Углерод известен также в виде кластерных частиц С 60 , С 70 , C 80 , C 90 , C 100 и подобных (Фуллерены), и кроме этого графенов, нанотрубок и сложных структур — астраленов.
- Аморфный углерод (строение)
В основе строения аморфного углерода лежит разупорядоченная структура монокристаллического (всегда содержит примеси) графита. Это кокс, бурые и каменные угли, Техуглерод, Сажа, активный уголь.
Графен (англ. graphene) — двумерная аллотропная модификация углерода, образованная слоем атомов углерода толщиной в один атом, соединенных посредством sp связей в гексагональную двумерную кристаллическую решётку.

Источники:
- http:// polyguanidines.ru
- http:// www.e-reading.club
- https:// ru.wikipedia.org
- https:// www.google.by

























