
Щелочные металлы и их соединения

Щелочные металлы — это элементы IА группы :
Литий, Li
Калий, К
Натрий, Nа
Франций, Fr
Рубидий, Rb
Цезий, Сs

1.Строение и свойства атомов
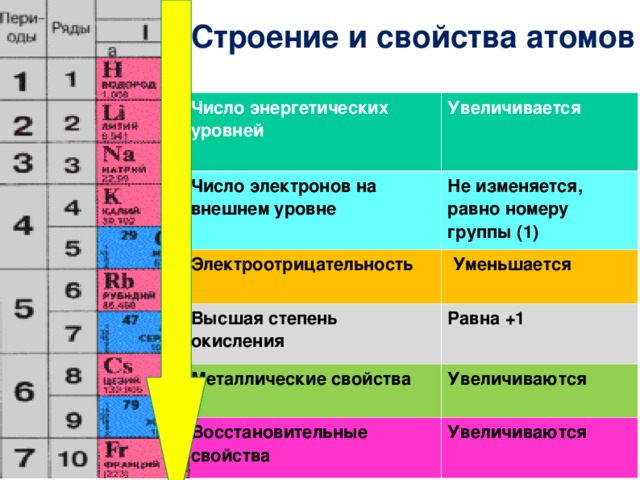
Строение и свойства атомов
Число энергетических уровней
Увеличивается
Число электронов на внешнем уровне
Не изменяется, равно номеру группы (1)
Электроотрицательность
Уменьшается
Высшая степень окисления
Равна +1
Металлические свойства
Увеличиваются
Восстановительные свойства
Увеличиваются

На внешнем энергетическом уровне атомы этих элементов содержат по одному электрону, находящемуся на сравнительно большом удалении от ядра.
Они легко отдают этот электрон, поэтому являются очень сильными восстановителями.
Во всех своих соединениях щелочные металлы проявляют степень окисления +1.
Восстановительные свойства их усиливаются при переходе от Li к Сs, что связано с ростом радиусов их атомов.
Это наиболее типичные представители металлов: металлические свойства выражены у них особенно ярко.

2.Щелочные металлы –
простые вещества

Серебристо-белые или желтоватые мягкие вещества (режутся ножом), с характерным блеском на свежесрезанной поверхности.
Все они легкие и легкоплавкие, причем, как правило, плотность их возрастает от Li к Сs, а температура плавления, наоборот, уменьшается.








3.Нахождение в природе





4.Химические свойства



5.Взаимодействие с неметаллами

Щелочные металлы легко реагируют с кислородом, но каждый металл проявляет свою индивидуальность:
оксид образует только литий:
4Li + O 2 = 2Li 2 O
натрий образует пероксид:
2Na + O 2 = Na 2 O 2
калий, рубидий и цезий – надпероксид:
K + O 2 = KO 2

Взаимодействие с водородом, серой, фосфором, углеродом, кремнием протекает при нагревании:
с водородом образуются гидриды:
2Na + H 2 = 2NaH,
с серой – сульфиды:
2K + S = K 2 S,
с фосфором – фосфиды:
3K + P = K 3 P,
с кремнием – силициды:
4Cs + Si = Cs 4 Si,
с углеродом карбиды образуют литий и натрий:
2Li + 2C = Li 2 C 2

С азотом легко реагирует только литий, реакция протекает при комнатной температуре с образованием нитрида лития:
6Li + N 2 = 2Li 3 N
С галогенами все щелочные металлы образуют галогениды:
2Na + Cl 2 = 2NaCl

6.Взаимодействие с водой

Все щелочные металлы реагируют с водой, литий реагирует спокойно, держась на поверхности воды, натрий часто воспламеняется, а калий, рубидий и цезий реагируют со взрывом:

7.Взаимодействие с кислотами

Щелочные металлы способны реагировать с разбавленными кислотами с выделением водорода, однако реакция будет протекать неоднозначно, поскольку металл будет реагировать и с водой, а затем образующаяся щелочь будет нейтрализоваться кислотой.
При взаимодействии с кислотами-окислителями, например, азотной, образуется продукт восстановления кислоты, хотя протекание реакции также неоднозначно.
Взаимодействие щелочных металлов с кислотами практически всегда сопровождается взрывом, и такие реакции на практике не проводятся.

8.Соединения щелочных металлов и их значение для человека

Гидроксид натрия NаОН в технике известен под названиями едкий натр, каустическая сода, каустик.
Техническое название гидроксида калия КОН — едкое кали.
Оба гидроксида — NaОН и КОН разъедают ткани и бумагу, поэтому их называют также едкими щелочами.
Едкий натр применяется в больших количествах для очистки нефтепродуктов, в бумажной и текстильной промышленности, для производства мыла и волокон.
Едкое кали дороже и применяется реже. Основная область его применения — производство жидкого мыла.

.
Соли щелочных металлов — твердые кристаллические вещества ионного строения.
Nа 2 СO 3 — карбонат натрия , образует кристаллогидрат Nа 2 СO 3 * 10Н 2 O, известный под названием кристаллическая сода, которая применяется в производстве стекла, бумаги, мыла.
Вам в быту более известна кислая соль — гидрокарбонат натрия NаНСO 3 , она применяется в пищевой промышленности (пищевая сода) и в медицине (питьевая сода).
К 2 С0 3 — карбонат калия, техническое название — поташ, используется в производстве жидкого мыла.
Nа 2 SO 4 • 10Н 2 O — кристаллогидратат сульфата натрия, техническое название — глауберова соль, применяется для производства соды и стекла и в качестве слабительного средства.



NаСl — хлорид натрия , или поваренная соль, эта соль вам хорошо известна из курса прошлого года. Хлорид натрия является важнейшим сырьем в химической промышленности, широко применяется и в быту.

9. Получение щелочных металлов
























































