
Хром

ХРОМ
химический элемент VI группы периодической системы Менделеева,
- атомная масса 51,996;
- металл голубовато-стального цвета.
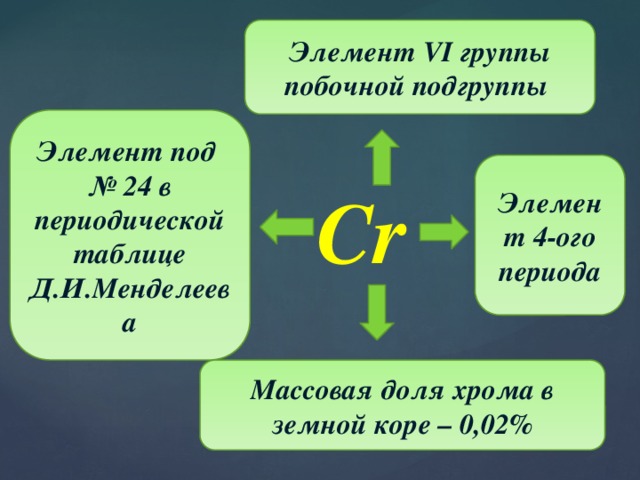
Элемент VI группы побочной подгруппы
Элемент под
№ 24 в периодической таблице Д.И.Менделеева
Элемент 4-ого периода
Cr
Массовая доля хрома в земной коре – 0,02%

Хромистый
железняк
FeO* Cr 2 O 3
Нахождение в природе
Хромит
FeCr 2 O 4
Крокоит
PbCrO 4

Месторождения хрома
- В земной коре хрома довольно много – 0,02%.
- Наша страна обладает огромными запасами хромитов. Одно из самых больших месторождений находится в Казахстане, в районе Актюбинска; оно открыто в 1936 г. Значительные запасы хромовых руд есть и на Урале.
- Большими запасами хромитов располагают Куба, Югославия, многие страны Азии и Африки.

История открытия
- В 1797 г. французский химик Л. Вокелен впервые исследовал красноватый, тяжелый минерал крокоизит, попавший в его руки из далекой Сибири.
-

- Крокоизит, чаще называемый крокоитом (от греческого "крокос" - шафран), -редкий минерал, найденный на Урале в 40-х года XVIII в. и описанный М. В. Ломоносовым .

- Затем он был найден в Сибири петербургским профессором химии И. Леманом в 1762 г. От него попал к Воклену, который открыл в сибирском минерале соединение нового элемента.

- Выделить этот элемент в чистом виде он не смог. Пораженный разнообразием окрасок, образуемых разными соединениями вновь открытого элемента, Воклен назвал его хромом (от греческого слова "хрома" - цвет, краска). В сравнительно чистом виде новый элемент был выделен в 1799 г. Ф. Тассером. Он представлял собой серо-стальной металл с серебристыми блестками в изломе, тугоплавкий (температура плавления 1800° С), не окисляющийся при обычных условиях, с плотностью, почти равной плотности железа.

Металл серебристо-белого цвета
Самый твердый металл
Тем.плавл.
1890 0 C
Физические
свойства
Хрупкий, с плотностью
7,2 г/см 3

Химические свойства хрома
1.Реагирует с неметаллами(при нагревании)
А)4Cr + 3O 2 =2Cr 2 O 3
Б)2Cr + N 2 =2CrN
В)2Cr +3S = Cr 2 S 3
2.Реагирует с парами воды(в раскаленном состоянии)
2Cr + 3H 2 O=Cr 2 O 3 + 3H 2
3.Реагирует с кислотами
Cr + H 2 SO 4 = CrSO 4 + H 2
4.Реагирует с солями менее активных металлов
Cr + CuSO 4 = CrSO 4 + Cu
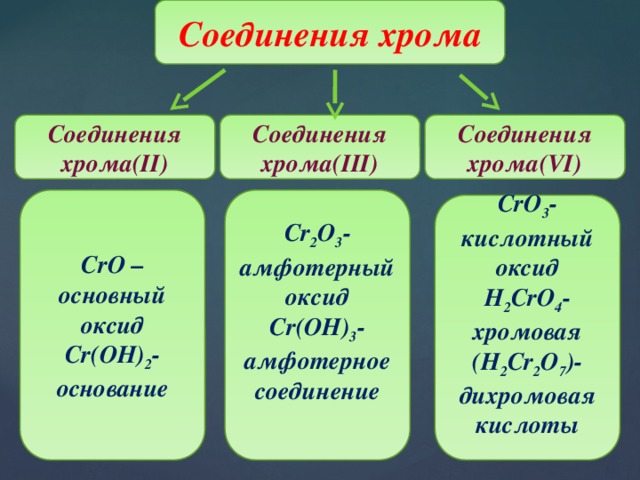
Соединения хрома
Соединения хрома(II)
Соединения хрома(III)
Соединения хрома(VI)
Cr 2 O 3 -амфотерный оксид
CrO –основный оксид
Cr(OH) 3 -амфотерное соединение
Cr(OH) 2 -
основание
CrO 3 -кислотный оксид
H 2 CrO 4 -хромовая
(H 2 Cr 2 O 7 )-дихромовая кислоты

Соединения хрома(II)
1.Реагирует с кислотами
- При нагревании разлагается
CrO+2HCL=
Cr(OH) 2 =CrO + H 2 O
=CrCL 2 +H 2 O
2.Реагирует с кислотами
2.Окисляется кислородом воздуха
Cr(OH) 2 +H 2 SO 4 =
=CrSO 4 +2H 2 O
4CrO + O 2 =2Cr 2 O 3
SO4

Соединения хрома(III)
Cr 2 O 3 –при обычных условиях не реагирует с растворами кислот и щелочей .
1.Реагирует с кислотами
Cr 2 O 3 –реагирует лишь при сплавлении
Cr(OH) 3 + 3HCL=
Cr 2 O 3 +Ba(OH) 2 =
=CrCL 3 + 3 H 2 O
=Ba(CrO 2 ) 2 +H 2 O
2.Реагирует с щелочами
Cr(OH) 3 +3NaOH=
Реагирует с более активными металлами
Cr 2 O 3 + 2Al= Al 2 O 3 + 2Cr
=Na 3 (Cr(OH) 6 )
3.При нагревании разлагается
2Cr(OH) 3 =Cr 2 O 3 + 3H 2 O
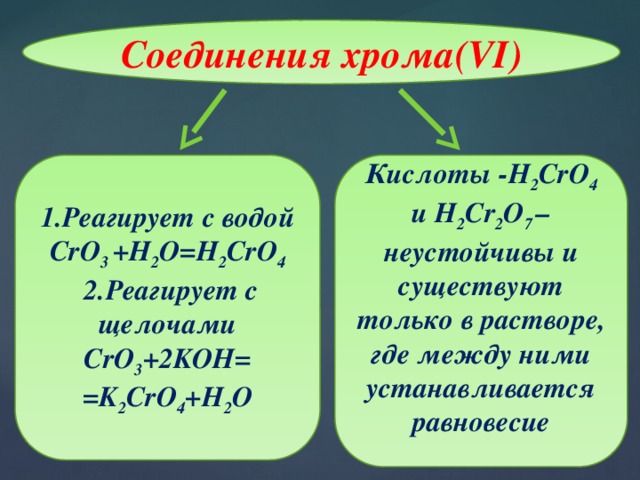
Соединения хрома(VI)
1.Реагирует с водой
Кислоты -H 2 CrO 4 и H 2 Cr 2 O 7 –неустойчивы и существуют только в растворе, где между ними устанавливается равновесие
CrO 3 +H 2 O=H 2 CrO 4
2.Реагирует с щелочами
CrO 3 +2KOH=
=K 2 CrO 4 +H 2 O
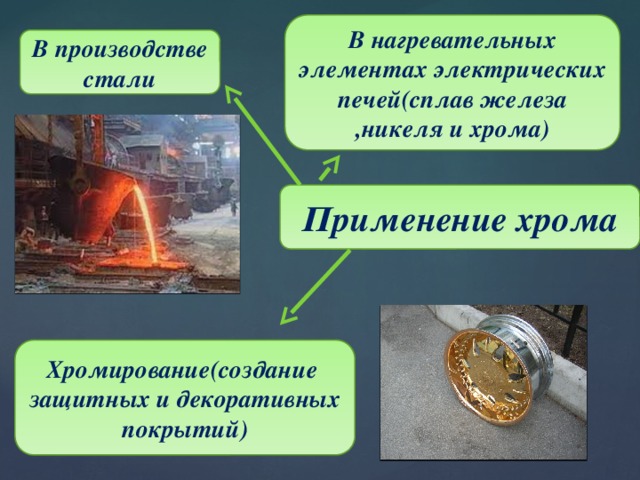
В нагревательных элементах электрических печей(сплав железа ,никеля и хрома)
В производстве стали
Применение хрома
Хромирование(создание
защитных и декоративных покрытий)

Применение хрома
Использование хрома основано на его жаропрочности, твердости и устойчивости против коррозии.
Больше всего хрома применяют для выплавки хромистых сталей. Значительное количество хрома идет на декоративные коррозионно-стойкие покрытия.
Широкое применение получил порошковый хром в производстве металлокерамических изделий и материалов для сварочных электродов. Хром в виде иона Cr3+ - примесь в рубине, который используется как драгоценный камень и лазерный материал.
Соединениями хрома протравливают ткани при крашении.
Из смеси хромита и магнезита изготовляют хромомагнезитовые огнеупорные изделия .

Наглядное применение хрома

Сульфат хрома и хромокалиевые квасцы используют для изготовления прочной хромовой кожи
Применение соединений хрома
Соединения хрома применяют в качестве минеральных красок
Хромовую смесь используют для мытья химической посуды в лабораториях

Роль хрома в живых организмах
Важные факты:
Хром — один из биогенных элементов, постоянно входит в состав тканей растений и животных. У животных хром участвует в обмене липидов, белков (входит в состав фермента трипсина), углеводов. Снижение содержания хрома в пище и крови приводит к уменьшению скорости роста, увеличению холестерина в крови.
В конце 1950-х гг. два исследователя, Шварц и Мерц, сообщили, что у крыс, которые были на рационе, дефицитном по хрому, развивалась непереносимость сахара; при добавлении же хрома в рацион их состояние нормализовалось. Это было первым подтверждением, что хром необходим животным для нормальной жизни. С тех пор исследователи поняли, что хром играет такую же роль и для здоровья человека.

Пищевые источники хрома
- пшеничные ростки, печень, мясо, сыр, бобы, горох, цельное зерно, черный перец, мелисса, пивные дрожжи.

Проверь себя
С какими из перечисленных ниже веществ
будет реагировать хром
H 2 SO 4
Cu(NO 3 ) 2
Al
KCL
NaNO 3
HCL

Проверь себя
Оксид и гидроксид хрома (II) реагируют
со следующими веществами
H 2 SO 4
HNO 3
HCL
CaCL 2
NaOH
CuO

Ссылки на источники информации и изображения:
Википедия
http://im7-tub-ru.yandex.net/i?id=152996174-45-72&n=21
http://im5-tub-ru.yandex.net/i?id=92218102-28-72&n=21
http://im7-tub-ru.yandex.net/i?id=113413894-55-72&n=21
http://im2-tub-ru.yandex.net/i?id=31291566-60-72&n=21
http://dabi.ru/attachments/7044/6952/images/large.jpg
http://im0-tub-ru.yandex.net/i?id=461512314-61-72&n=21
http://im0-tub-ru.yandex.net/i?id=410341235-12-72&n=21
http://im6-tub-ru.yandex.net/i?id=373203664-10-72&n=21
http://im7-tub-ru.yandex.net/i?id=47417297-37-72&n=21









































