Просмотр содержимого документа
«Презентация к уроку Неметаллы. Фосфор»

Фосфор
Открыт в 1669г.
1682 Роберт Бойль
ПОЛУЧЕНИЕ
2Ca 3 (PO 4 ) 2 + 10C + 6SiO 2 →
4P + 10CO + 6CaSiO 3
4HPO 3 + 12C → 4P + 2H 2 + 12CO
Гамбургский купец Хеннинг Бранд

Электронная формула
строения атома фосфора
3d 0
1S 2 2S 2 2P 6 3S 2 3P 3
Степени окисления фосфора
-3 0 +3 +5
Р H 3
Р
Р Cl 3
Р 2 О 5
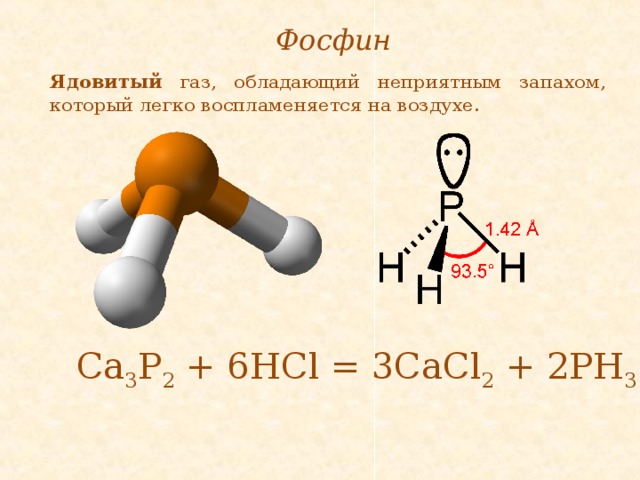
Фосфин
Ядовитый газ, обладающий неприятным запахом, который легко воспламеняется на воздухе.
Са 3 Р 2 + 6НСl = 3CaCl 2 + 2PH 3 ↑

Аллотропные модификации
Красный фосфор — порошкообразное вещество
тёмно-красного цвета, без запаха,
не растворяется в воде и сероуглероде, не ядовит.
Окисление красного фосфора на воздухе протекает очень медленно, самовоспламеняться он не способен, в темноте не светится.
Поджечь чёрный фосфор можно, только предварительно сильно раскалив в атмосфере чистого кислорода до 400 °С.
Удивительным свойством чёрного фосфора является его способность проводить электрический ток и свойства полупроводника.
Белый фосфор представляет собой легкоплавкое, летучее вещество, нерастворимое в воде, но хорошо растворимое в сероуглероде. Белый фосфор очень ядовит, легко окисляется на воздухе. Особым его свойством является способность светиться в темноте вследствие его окисления.
![ФОСФОР в природе Входит в двадцатку наиболее распространенных элементов Солнечной системы. Обнаружен во многих типах метеоритов и на Луне. В атмосфере Земли отсутствует полностью. хлорапатит ( Ca 5 (PO 4 ) 3 (Cl) фторапатиты ( Ca 5 (PO 4 ) 3 F пироморфит коллинсит Ca 2 (Mg, Fe 2+ )[PO 4 ] 2 ·2H 2 O Pb 10 Cl 2 ( PO 4 , AsO 4 ) 6](https://fsd.multiurok.ru/html/2017/07/06/s_595e3f1730d76/img4.jpg)
ФОСФОР в природе
Входит в двадцатку наиболее распространенных элементов Солнечной системы. Обнаружен во многих типах метеоритов и на Луне. В атмосфере Земли отсутствует полностью.
хлорапатит
( Ca 5 (PO 4 ) 3 (Cl)
фторапатиты
( Ca 5 (PO 4 ) 3 F
пироморфит
коллинсит
Ca 2 (Mg, Fe 2+ )[PO 4 ] 2 ·2H 2 O
Pb 10 Cl 2 ( PO 4 , AsO 4 ) 6

Схема круговорота фосфора в природе
P
P
P
P
P
P
P
P
P
P
P

Биологическое значение фосфора
«Элемент жизни и мысли» А.Е.Ферсман
1715г. Генсинг
1769г. Ю.Ган
Тело человека содержит около 1,5 кг фосфора. Из этого количества 1,4кг приходится на кости, около 130г – на мышцы и 12г – на нервы и мозг. Основную роль в превращениях соединений фосфора в организме человека и животных играет печень. Обмен фосфорных соединений регулируется гормонами и витамином D. Суточная потребность человека в фосфоре 1-2 г.

Основные источники фосфора:
Продукт
Фосфор, мг
Икра осетровых рыб
590,0
Грецкий орех
Продукт
560,0
Сыр голландский
Хлеб ржаной
Фосфор, мг
174,0
544,0
Яйцо куринное
Фасоль
Горох
55,0
Картофель
540,0
58,0
329,0
Крупа гречневая
Свекла
43,0
Куриное мясо
Творог
298,0
32,0
290,0
Какао
Капуста
31,0
Телятина
245,0
Треска
208,0
25,0
Говядина
Молоко коровье
188,0
20,0
Колбаса вареная
19,0
Яблоки
11,0

Химические свойства
Легко окисляется кислородом воздуха
Взаимодействует с водой
4P + 5O 2 → 2P 2 O 5 ,
4P + 3O 2 → 2P 2 O 3
4Р + 6Н 2 О → РН 3 + 3Н 3 РО 2
С металлами - окислитель
Взаимодействует со щелочами
2P + 3Ca → Ca 3 P 2
2P + 3Mg → Mg 3 P 2
4Р + 3KOH + 3Н 2 О → РН 3 + 3KН 2 РО 2
С неметаллами - восстановитель
Восстановительные свойства
3P + 5HNO 3 + 2H 2 O → 3H 3 PO 4 + 5NO
2P + 5H 2 SO 4 → 2H 3 PO 4 + 5SO 2 + 2H 2 O
2P + 3S → P 2 S 3
2P + 3Cl 2 → 2PCl 3
6P + 5KClO 3 → 5KCl + 3P 2 O 5
Не взаимодействует с водородом











![ФОСФОР в природе Входит в двадцатку наиболее распространенных элементов Солнечной системы. Обнаружен во многих типах метеоритов и на Луне. В атмосфере Земли отсутствует полностью. хлорапатит ( Ca 5 (PO 4 ) 3 (Cl) фторапатиты ( Ca 5 (PO 4 ) 3 F пироморфит коллинсит Ca 2 (Mg, Fe 2+ )[PO 4 ] 2 ·2H 2 O Pb 10 Cl 2 ( PO 4 , AsO 4 ) 6](https://fsd.multiurok.ru/html/2017/07/06/s_595e3f1730d76/img4.jpg)














