По авторской программе Новошинских в 9 классе рассматривается строение молекул, свойства, получение только двух оксидов - оксида азота (II) и оксида азота (IV). Надеюсь, что данная работа будет полезна учителям, работающим по разным программам.
Просмотр содержимого документа
«Презентация "Оксиды азота"»


1. Приведите формулу иона аммония
2. Как образуется ион аммония? Тип связи?
3. Дайте названия веществам:
NH4NO3
( NH4 )2С O 3
NH4Cl
4. Нашатырный спирт и нашатырь-это одно вещество или разные? Приведите формулу(Ы)
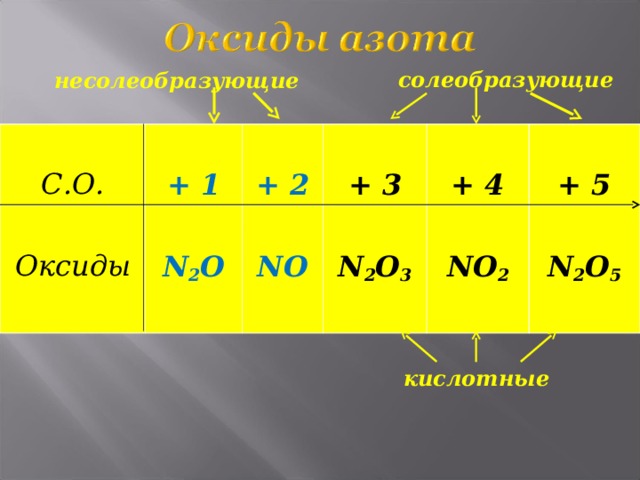
солеобразующие
несолеобразующие
С.О.
Оксиды
+ 1
N 2 O
+ 2
NO
+ 3
N 2 O 3
+ 4
NO 2
+ 5
N 2 O 5
кислотные

N О N +2 = О -2
Сильно ядовит!!!
Физические свойства
Бесцветный газ с неприятным запахом. В воде почти нерастворим. Образуется из азота и кислорода при сильных электрических разрядах (например, во время грозы в воздухе) или при высокой температуре:
N2 + O2 2NO
Получение
В промышленности – каталитическое окисление аммиака:
t, Pt
NH3 + 5O2 → NO + H2O
В лаборатории:
С u + HNO3( разб.) → Cu(NO3)2 + NO + H2O

Окислительно-восстановительная двойственность . Почему?
Восстановитель:
2 NO + O2 = 2NO2 ↑ (легко!)
бурый газ
Окислитель:
2 NO + 2SO2 = 2SO3 + N2 ↑
2NO + 2 Н 2 = N 2 + 2Н 2 О (200 0 С)
2NO + 2Cu = N 2 + 2 CuO ( 5 00 0 С)
2NO + 2H 2 S = N 2 + 2 S + 2Н 2 О ( 3 00 0 С)
Примененяется в производстве азотной кислоты

Совсем недавно оксид азота( II ) считался сильнейшим промышленным загрязнителем и одним из главных «врагов» для всего живого. А сегодня стало известно, что оксид азота( II ) постоянно синтезируется в нашем организме – это защита для сердца и стимулятор мозга, источник для мышечного роста и один из главнейших защитников от бактерий. Учёным присуждена Нобелевская премия за установление роли оксида азота( II ) в работе сердечно - сосудистой системы.
Эта очень маленькая молекула "живёт" всего около 10 секунд

N О 2
О -2 =N + 4 = О -2
- Ядовитый газ бурого цвета, имеет характерный запах. Хорошо растворяется в воде
Ниже 22 0 C молекулы оксида азота( IV) легко соединяются попарно и образуют бесцветную жидкость состава N2O4 , которая при охлаждении до -10,2 0 С превращается в бесцветные кристаллы
«Лисий хвост»

В лаборатории:
В промышленности:
NO + O2 → NO2
С u + HNO3( конц.) → Cu(NO3)2 + NO 2 + H2O
Расставьте коэффициенты методом электронного баланса

1. Растворение в воде:
а) 2NO2 + H2O = HNO2 + HNO3
б) в избытке кислорода
4NO2 + O2 + 2H2O = 4HNO3
2. Взаимодействие со щелочами:
2 NO2 + 2NaOH = NaNO2 + NaNO3 + H2O
N +4 при взаимодействии с
водой и щелочью
выполняет роль ………………..?

NO2
O2
NO

§ 29 , №2,4, с.130


























