Просмотр содержимого презентации
«Свойства металлов 9 класс»

Муниципальное бюджетное общеобразовательное учреждение
Долгокычинская средняя общеобразовательная школа
Свойства металлов
9 класс
Автор:
Учитель химии
Зарубина Наталья Романовна
с. Долгокыча
2017
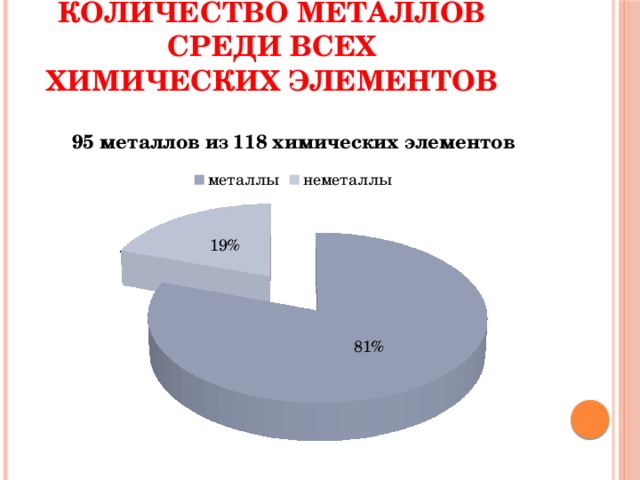
Количество металлов среди всех химических элементов

Расположение
элементов – металлов
в ПСХЭ:
1 группа главная подгруппа – щелочные металлы
2 группа главная подгруппа – щелочно-земельные металлы
3 группа главная подгруппа – все кроме бора
4 группа главная подгруппа – все кроме углерода и кремния
5 группа главная подгруппа – сурьма и висмут
6 группа главная подгруппа – только полоний
Во всех побочных подгруппах – только металлы

Металлы – это химические элементы, атомы которых отдают электроны внешнего ( предвнешнего) электронного слоя, превращаясь в положительные ионы (катионы).
o 2+
Fe – 2e → Fe
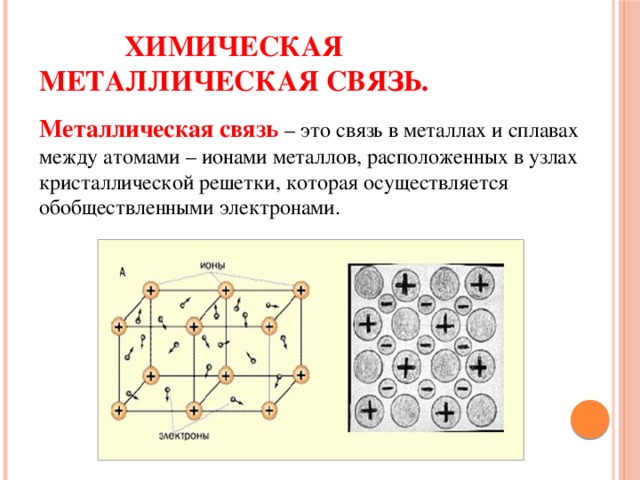
Химическая металлическая связь.
Металлическая связь – это связь в металлах и сплавах между атомами – ионами металлов, расположенных в узлах кристаллической решетки, которая осуществляется обобществленными электронами.


Химические свойства металлов
Взаимодействие металлов с галогенами
o o +1 -1
2Na + Cl 2 → 2NaCl
o +3 -1
2Sb + 2Cl 2 → 2SbCl 3
o o +3 -1
2Fe + 3Cl 2 → 2FeCl 3
Взаимодействие металлов с водой
Взаимодействие металлов с серой
o +1 +1 -1 o
2К + 2H 2 O = 2КOH + H 2
o o +2 -2
Fe + S → FeS
o +2 -1
2Са + Н 2 О → 2Сa(ОН)
2
o o +3 -2
2Al + 3S → Al 2 S 3
(Щелочные и щелочно-земельные металлы)
o +1 t o
3Fe + 4H 2 O → Fe 3 O 4 + 4H 2 ↑
(малоактивные)

Взаимодействие металлов с кислородом
O O +1 -2
4Li + O 2 → 2Li 2 O
o o +2 -2
2Mg + O 2 = 2MgO
o o +1 -1
2Na + O 2 → Na 2 O 2
Активные
металлы
t o
Na 2 O 2 + O 2 → 2Na 2 O
2Na 2 O 2 + 2CO 2 = 2Na 2 CO 3 + O 2 ↑
o o t o +3 -2
4Al + O 2 → 2Al 2 O 3
Малоактивные
металлы
o o t o
3Fe + 2O 2 = Fe 3 O 4

Взаимодействие металлов с кислотами
o +1 -1 +2 -1 o
Zn + 2HCl → ZnCl 2 + H 2
o + +2 o
Zn + 2H → Zn + H 2
o + 2+ o
2CH 3 COOH + Zn → (CH 3 COO) 2 Zn + H 2
o + 2+ o
Zn + 2H → Zn + H 2 ↑
Взаимодействие металлов с солями
Fe + CuSO 4 → Cu↓ +FeSO 4
o 2+ o 2+
Fe + Cu → Cu + Fe
(окислительно-восстановительная реакция)
o
Cu + 2AgNO 3 → Cu(NO 3 ) 2 + 2Ag↓
o + 2+ o
Cu + 2Ag → Cu + Ag↓

Химические свойства металлов
1. Все металлы проявляют только восстановительные свойства
2. Атомы металлов легко отдают электроны внешнего (а некоторые – и предвнешнего) электронного слоя, превращаясь в положительные ионы.
3. Металлы имеют большой атомный радиус и малое число электронов (от 1 до 3) на внешнем слое.
Исключение:
Ge, Sn, Pb ─ 4 электрона;
Sb, Bi ─ 5 электронов;
Po ─ 6 электронов.

Проверь себя:
Какие из соединений вступают
в реакцию с металлами:
K 2 O
BaSO 4
О 2
H 2 SO 4
S
Fe 2 O 3
H 2 O
Cr
CuSO 4

Спасибо за внимание!




























