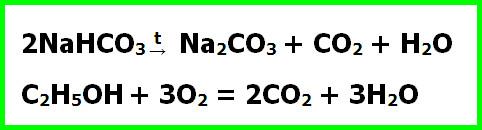Муниципальное бюджетное общеобразовательное учреждение
Летневская средняя школа
Проект

Автор: учитель химии Милицкая Я.А
д.Летнево
2018
«Ни одна наука не нуждается
в эксперименте в такой степени, как химия»
Майкл Фарадей
В школьной программе нет более интересного предмета, чем химия. Но для того чтобы дети не боялись этой сложной науки, учитель должен уделять в своей работе достаточное времени занимательным опытам и необычным экспериментам. Именно практические навыки, которые формируются в ходе такой работы, и помогут стимулировать интерес к предмету.
Занимательные опыты, являясь частью эксперимента, прививают любовь к химии, формируют интерес к предмету в дополнительное от занятий время, способствуют более успешному усвоению химии, углублению и расширению знаний, формированию навыков самостоятельной творческой работы, привитию практического опыта работы с химическими реактивами и оборудованием.
Самое главное — это заинтересовать ребенка и донести ему, что химия окружает нас повсюду, поэтому процесс ее изучения может быть очень увлекательным. Здесь на помощь придут домашние химические опыты. Наблюдая такие эксперименты, можно в дальнейшем искать объяснение, почему происходит так, а не иначе. А, когда на школьных уроках юный исследователь столкнется с подобными понятиями, объяснения учителя ему будут более понятны, так как у него уже будет свой собственный опыт проведения домашних химических экспериментов и полученные знания.
Многие полагают, что настоящая химия это вредные вещества, экспериментировать с ними опасно, тем более в домашних условиях. Есть много очень увлекательных опытов, которыеможно провести дома со своим ребёнком, не навредив здоровью. И эти домашние химические опыты будут не менее увлекательные и поучительные, чем те, которые идут с взрывами, едкими запахами и клубами дыма.
Сейчас накопилось большое количество химических опытов, поэтому моей основной задачей было их систематизирование.
Конечным продуктом моей работы предполагается методическое пособие для учащихся 8 классов и «Книга волщебства» для учеников младших классов. Также может использоваться для учащихся младшего, среднего и старшего звена. Некоторые опыты можно провести для дошкольников.
Считаю, что данная работа принесет пользу не только учителю и ученикам, но и просто заинтересованным людям, родителям.
Эта разработка будет полезна для применения в своей педагогической деятельности: как на уроках в классе, так и во внеклассных и внеурочных мероприятиях.
Проблема: Отсутствие интереса у учащихся к естественнонаучному образованию.
Гипотеза: Применение занимательных опытов дома и в школе, способствует развитию интереса к предмету химия.
Цель проекта: Побуждение интереса учащихся к предмету через занимательные опыты.
Задачи проекта:
- формирование определенных умений и навыков;
- расширение кругозора и развитие внимания;
- повышение творческой деятельности учащихся;
- проверка освоенности пройденного материала;
- связь химии и повседневной жизни человека.
Перед любым педагогическим проектом стоят проблемные вопросы. Так и в данном проекте, они были следующими:
- Какой будет иметь вид?
- Какова будет структура пособия?
- Как соответствует знаниям учащихся?
- Как соответствует возрасту учащихся?
- Будут ли химические эксперименты интересны для учащихся?
План реализации проекта
| № п/п | Этапы реализации проекта | Ответственные | Деятельность | Сроки |
| 1 | Подготовительный | Учитель | Формулировка цели и задач проекта | сентябрь |
| 2 | Планирование - Определение источников информации - Определение способов сбора и анализа информации - Распределение задач (обязанностей) между членами команды - Вид конечного продукта проекта | Учитель Учащиеся
| Вырабатывают план действий | ноябрь |
| 3 | Сбор информации
Корректировка | Учащиеся
Учитель
| Сбор материала, соответствующего тематики проекта | Ноябрь-март |
| 4 | Формирование итогового (скорректированного) варианта, его защита
| Учитель Учащиеся | Корректируют разработанные материалы, оформляют проект, презентуют его Проводят внеклассное мероприятие для школьников и дошкольников | Апрель-май |
Представленные в методическом пособии эксперименты должны дать учащимся дополнительные практические навыки в обращении с веществами, посудой и принадлежностями, навыки собирания приборов, проведения химических операций и некоторые навыки распознания веществ.
Данный проект можно дополнять с учащимися на уроке, ведь сюда я вложила только малую часть химических опытов.
Работая над проектом, мы издали «Книгу волшебства», которую размножили и раздали учащимся начальных классов, для которых устроили праздник. Результаты опроса показывают, что ребятам стал интересен такой предмет, как химия.
Список использованных источников
Г. И. Штремплер «Химия на досуге»: Домашняя химическая лаборатория. Москва «Просвещение» - «Учебная литература», 1996. – 94 с., 27 с.
В.Н. Алексинский «Занимательные опыты по химии». Москва «Просвещение» - АО «Учебная литература»1995. – 96 с¸, 88 с.
Том Тит «Научные забавы»: Физика без приборов, химия без лаборатории. Москва «Издательский дом Мещерякова, 2007, 2-е издание – 224 с.
Интернет-источники
https://www.moirebenok.ua/age3-6/razvitie/15-porazitelnyh-razvivayushhih-opytov-dlya-detej/
http://globuss24.ru/doc/zanimatelynie-opiti-po-himii
https://azbyka.ru/deti/domashnie-himicheskie-opy-ty-dlya-detej




Методическое пособие
«Занимательная химия»
для учащихся 8-11 классов

«ХРУПКИЕ МЫЛЬНЫЕ ПУЗЫРИ»
Вам понадобится: мыльные пузыри, мороз на улице.
Все, что понадобится для опыта — выйти на улицу в морозную погоду с баночкой мыльных пузырей. Когда вы начнете выдувать пузырь, на его поверхности будут появляться маленькие кристаллики, а через несколько секунд он полностью замерзнет.
Если вы хотите провести такой опыт, когда погода не очень морозная, выдуйте мыльный пузырь и аккуратно стряхните на него с руки снежинку. Когда она соприкоснется с поверхностью, шар начнет кристаллизоваться и постепенно замерзать.
«РЫБАЛКА»
Вам понадобится: вода, кубики льда, ворсистая нить
Чтобы провести такой эксперимент, наберите в любую глубокую емкость воду, бросьте в нее заранее подготовленные кубики льда. Поверх емкости положите нитку так, чтобы она прикасалась хотя бы к одной льдинке. Затем насыпьте на лед немного соли и подождите 5 минут. Теперь, потянув нитку за другой край, можно вытащить лед из воды! Секрет такого опята очень прост: от соли поверхность льдинки немного тает, а вода, которая образовалась, вскоре примораживает веревку к кубику.
«ТОРНАДО В БУТЫЛКЕ»
Вам понадобится: вода, прозрачная стеклянная или пластиковая бутылочка/баночка, средство для мытья посуды, блестки.
Для такого «торнадо» нужно набрать в бутылку воды, но не до самого горлышка. Затем капните в бутылку немного средства для мытья посуды. Осталось просто закрыть бутылку, вращать ее против часовой стрелки и любоваться вихрем внутри нее. Чтобы вихрь был зрелищней, добавьте в воду блестки и несколько капель пищевого красителя.
«ИЗВЕРЖЕНИЕ ВУЛКАНА»
Вам понадобится: сода, красная или оранжевая краска, вода, моющее средство, уксус.
Этот эксперимент в домашних условиях всегда был одним из самых любимых для детей! Чтобы создать «вулкан», соорудите из картона конус, склейте его скотчем и отрежьте острый его конец. На любую бутылку, которая у вас есть, оденьте конус и облепите его сверху коричневым или любым темным пластилином, имитируя вид горы. Эту конструкцию лучше поставить на большую тарелку или противень, чтобы потом ничего не вылилось. Через горлышко в бутылку, что стоит внутри конуса, засыпьте соду, краску красного цвета, каплю средства для мытья посуды и долейте воду. Размешайте эту смесь внутри емкости, а потом попросите малыша долить туда немного уксуса. Когда бурная химическая реакция начнется, вулкан будет «извергаться» красной «лавой» из пены!
«БУМАЖНАЯ КРЫШКА»
Вам понадобится: стакан, вода, лист бумаги.
Это даже не опыт, а, скорее, занимательный эксперимент. Для этого всего лишь нужно вырезать квадрат из бумаги и накрыть им стакан с водой. Когда вы перевернете стакан вверх дном, бумага прилипнет к ободку и не отпадет! С одной стороны на такую «крышку» будет давить вода, а с другой — воздух, давление которого намного больше давления жидкости.
«САМОНАДУВАЮЩИЙСЯ ШАРИК»
Вам понадобится: воздушные шарики, пластиковая бутылка, бытовая воронка, уксус, пищевая сода.
Заполните бутылку уксусом на 1/3. Поставьте воронку и засыпьте в бутылку 3-4 чайных ложки пищевой соды. Теперь быстро натяните воздушный шарик на горлышко и наблюдайте, как он надувается без чьей-либо помощи! После того, как шарик надуется, снимите его с бутылки, завяжите и потрите о синтетическую ткань. Благодаря этому шарик поднимется к потолку и будет держаться там несколько часов!
«МНОГОСЛОЙНАЯ ЖИДКОСТЬ»
Вам понадобится: фруктовый сок, растительное масло, спирт, высокая стеклянная ваза.
Это опыт будет не только познавательным с точки зрения азов химии, но и порадует глаз! Налейте на дно вазы сок, затем постепенно влейте растительное масло, по стенке вазы. Добавьте в спирт краску или пищевой краситель любого цвета, чтобы было интересней, и налейте его поверх масла в вазу. Вы увидите, что жидкости не смешались и можно наблюдать красивую трехслойную палитру!
«СЕКРЕТНОЕ ПОСЛАНИЕ»
Вам понадобится: лимон ватные палочки бутылка блестки, бусины, конфетти.
Выдавите сок лимона в небольшую мисочку, мокните в него ватную палочку и напишите ею на листе бумаги. Сок высохнет и на бумаге ничего не будет видно, но с помощью духовки или утюга ее можно будет проявить! Для этого достаточно прогладить лист или подержать в тепле некоторое время. Также, лимонный сок можно заменить уксусом, и эффект будет такой же.
«ГОРЯЧИЙ ЛЕД»
Реакция получения ацетата натрия называется «горячий лед». Несмотря на непонятные слова получить ацетат натрия легко и дома, ведь это не что иное, как результат реакции обычной пищевой соды и уксусной кислоты.
Вам понадобятся: сода (200 гр), соль, 70% уксусная кислота (200 мл), горячая кипяченая вода, кастрюля и банка.
Выливаем в кастрюлю уксус и, помешивая, постепенно добавляем соду. Пойдет реакция с выделением пузырьков газа. После прекращения выделения пузырьков, ставим кастрюлю на плиту и, постоянно помешивая, выпариваем лишнюю влагу до тех пор, пока на стенках кастрюли не станут появляться белые кристаллы. Таким образом, мы получили перенасыщенный раствор ацетата натрия. Даем раствору остыть. Сигналом, что мы делаем все правильно, служит образование на поверхности раствора корки. Если она не появляется, придется еще продолжить выпаривание. После образования корки начинаем очень небольшими порциями подливать горячую воду, до тех пор, пока раствор не станет однородным, а корка не исчезнет.
Переливаем раствор в банку и кладем на некоторое время в холодильник и охлаждаем до комнатной температуры. Затем достаем банку и добавляем щепотку соли. Раствор начинает мгновенно кристаллизоваться и становится очень похожим на лед, который совершенно нехолодный.
«ПОТОМУ ЧТО БЕЗ ВОДЫ – И НИ ТУДЫ И НИ СЮДЫ»
Вода-это жидкое химическое вещество, состоящее из двух элементов, а также газов, растворенных в ней. Человек тоже содержит воду. Известно, что там, где нет воды, нет и жизни. Без пищи человек может прожить около месяца, а без воды — всего лишь несколько суток.
Вам понадобится: 2 пробирки (маленькие стаканы), сода, лимонная кислота, вода.
Взять две пробирки. Насыпать в них в равных количествах соду и лимонную кислоту. Затем в одну из пробирок налить воды, а в другую нет. В пробирке, в которой вода была налита вода, стал выделяться углекислый газ. В пробирке без воды — ничего не изменилось.
Данный эксперимент объясняет тот факт, что без воды невозможны многие реакции и процессы в живых организмах, а также вода ускоряет многие химические реакции. Произошла обменная реакция, в результате которой выделился углекислый газ.
«ЧТО РАСТВОРЕНО В ВОДОПРОВОДНОЙ ВОДЕ»
Вам понадобится: прозрачный стакан, водопроводная вода.
Налить в прозрачный стакан водопроводную воду и поставить ее в теплое место на час. Через час вы увидите на стенках стакана осевшие пузырьки.
Пузырьки – это не что иное как газы, растворенные в воде. В холодной воде газы растворяются лучше. Как только вода становится теплой, газы перестают растворяться и оседают на стенки. Подобный домашний химический опыт позволяет также познакомить с газообразным состояние вещества.
«ЧТО РАСТВОРЕНО В МИНЕРАЛЬНОЙ ВОДЕ ИЛИ ВОДА — УНИВЕРСАЛЬНЫЙ РАСТВОРИТЕЛЬ»
Вам понадобится: пробирка (стакан), минеральная вода, свеча, лупа.
Налить в пробирку (стакан) минеральную воду и медленно выпаривать ее над пламенем свечи (опыт можно делать на плите в кастрюле, но кристаллы будут хуже видны). По мере испарения воды на стенках пробирка останутся мелкие кристаллы, все они разной формы.
Кристаллы – это соли, растворенные в минеральной воде. У них разная форма и размер, так как каждый кристаллик носит свою химическую формулу.
«ФИЛЬТРОВАНИЕ ВОДЫ, СМЕШАННОЙ С ПЕСКОМ»
Вам понадобится: 2 стакана, воронка, бумажный фильтр, вода, речной песок.
Налить в стакан воду и опустить туда немного речного песка, перемешать. Сделать фильтр из бумаги. Медленно выливать смесь песка с водой через воронку с бумажным фильтром во второй стакан. Речной песок останется на фильтре, а во втором стакане вы получите чистую воду.
Химический опыт позволяет показать, что существуют вещества, не растворяющееся в воде, например, речной песок. Также опыт знакомит с одним из метод очистки смесей веществ от примесей. Здесь можно внести понятия чистые вещества и смеси, которые даются в учебнике химия 8 класса. В данном случае смесью является песок с водой, чистым веществом — фильтрат, речной песок – это осадок.
Это Интересно!
Процессы фильтрования применялись еще в 8-7 веках до н.э. в государстве Урарту (ныне это территории Армении) для очистки питьевой воды. Её жители осуществили постройку водопроводной системы с применением фильтров. В качестве фильтров использовали плотную ткань и древесный уголь. Подобные системы из переплетённых водосточных труб, глиняных каналов, снабженные фильтрами были и на территории древнего Нила у древних египтян, греков и римлян. Воду пропускали через такой фильтр несколько раз, в конечном итоге добиваясь наилучшего качества воды.
«ВЫРАЩИВАЕМ КРИСТАЛЛЫ САХАРА»
Одним из самых интересных опытов является выращивание кристаллов. Опыт очень нагляден и дает представление о многих химических и физических понятиях.
Вам понадобится: два стакана воды, сахар — пять стаканов, деревянные шпажки, тонкая бумага, кастрюля, прозрачные стаканчики, пищевой краситель (пропорции сахара и воды можно уменьшить).
Опыт следует начинать с приготовления сахарного сиропа. Берем кастрюлю, выливаем в нее 2 стакана воды и 2,5 стакана сахара. Ставим на средний огонь и, помешивая, растворяем весь сахар. В получившийся сироп высыпаем оставшиеся 2,5 стакана сахара и варим до полного растворения.
Теперь приготовим зародыши кристаллов – палочки. Небольшое количество сахара рассыпаем на бумажке, затем обмакнем палочку в получившейся сироп, и обваляем ее в сахаре.
Берем бумажки и протыкаем шпажкой дырочку посередине таким образом, чтобы бумажка плотно прилегала к шпажке.
Затем разливаем горячий сироп по прозрачным стаканам (важно, чтобы стаканы были прозрачными — так процесс созревания кристаллов будет более увлекателен и нагляден). Сироп должен быть горячим, иначе кристаллы не будут расти.
Можно сделать цветные сахарные кристаллы. Для этого в получившейся горячий сироп добавляют немного пищевого красителя и размешивают его.
Кристаллы будут расти по-разному, некоторые быстро, а некоторым может понадобиться больше времени. По окончании опыта получившиеся леденцы ребенок может съесть, если у него нет аллергии на сладкое.
Если у вас нет деревянных шпажек, то опыт можно повести с обычными нитками.
Это Интересно!
Кристалл — это твердое состояние вещества. Он имеет определенную форму и определенное количество граней вследствие расположения своих атомов. Кристаллическими считаются вещества, атомы которых расположены регулярно, так что образуют правильную трёхмерную решётку, называемую кристаллической. Кристаллам ряда химических элементов и их соединений присущи замечательные механические, электрические, магнитные и оптические свойства. Например, алмаз – природный кристалл и самый твердый и редкий минерал. Благодаря своей исключительной твердости алмаз играет громадную роль в технике. Алмазными пилами распиливают камни. Существует три способа образования кристаллов: кристаллизация из расплава, из раствора и из газовой фазы. Примером кристаллизации из расплава может служить образование льда из воды (ведь вода – это расплавленный лёд). Пример кристаллизации из раствора в природе – выпадение сотен миллионов тонн соли из морской воды.
«ПОЛУЧЕНИЕ КРИСТАЛЛОВ ЙОДА»
Вам понадобится: настойкой аптечного йода, вода, стакан или цилиндр, салфетка.
Смешиваем воду с настойкой йода в пропорции:10мл йода и 10мл воды. И ставим всё в холодильник на 3 часа. В процессе охлаждения йод выпадет в осадок на дне стакана. Сливаем жидкость, вынимаем осадок йода и кладем на салфетку. Выжимаем салфетками до тех пор, пока йод не станет рассыпаться.
Данный химический эксперимент называется экстрагированием или извлечением одного компонента из другого. В данном случае вода экстрагирует йод из раствора спиртовки.
О пользе йода для дезинфекции ран ваш ребенок уже узнает из фильма. Таким образом, вы покажите, что между химией и медициной есть неразрывная связь. Однако, оказывается, что йод можно применять в качестве индикатора или анализатора содержания другого полезного вещества – крахмала. Следующий опыт познакомит юного экспериментатора с отдельной очень полезной химией – аналитической.
Это Интересно!
Французский ученый Бернар Куртуа в годы наполеоновских войн заметил, что в продуктах, получаемых из золы морских водорослей, которые выбрасывались на берег Франции, находится какое-то вещество, которое разъедает железные и медные сосуды. Но ни сам Куртуа, ни его помощники не знали, как выделить это вещество из золы водорослей. Ускорению открытия помог случай.
На своем небольшом заводе по производству селитры в г. Дижоне Куртуа собирался провести несколько опытов. На столе стояли сосуды, в одном из которых была настойка морских водорослей на спирту, а в другом — смесь серной кислоты с железом. На плечах у ученого сидела его любимая кошка.
В дверь постучали, и напуганная кошка спрыгнула и убежала, хвостом смахнув колбы на столе. Сосуды разбились, содержимое смешалось, и внезапно началась бурная химическая реакция. Когда небольшое облачко из паров и газов осело, удивленный ученый увидел на предметах и обломках какой-то кристаллический налет. Куртуа начал его исследовать. Кристаллы никому до этого неизвестного вещества получили название «йод».
Так был открыт новый элемент, а домашняя кошка Бернара Куртуа вошла в историю.
«ЙОД – ИНДИКАТОР СОДЕРЖАНИЯ КРАХМАЛА»
Вам понадобится: свежая картошка, кусочки банана, яблока, хлеба, стакан с разведенным крахмалом, стакан с разведённым йодом, пипетка.
Разрезаем картофель на две части и капаем на него разведенный йод – картошка синеет. Затем капаем несколько капель йода в стакан с разведенным крахмалом. Жидкость тоже синеет. Капаем с помощью пипетки растворенный в воде йод на яблоко, банан, хлеб, по очереди.
Наблюдаем: Яблоко — не посинело вообще. Банан – слегка посинел. Хлеб – посинел очень сильно. Эта часть опыта показывает наличие крахмала в различных продуктах.
Крахмал, вступая в реакцию с йодом, дает синюю окраску. Это свойство дает нам возможность выявить наличие крахмала в различных продуктах. Таким образом, йод является как бы индикатором или анализатором содержания крахмала.
Как известно, крахмал может преобразовываться в сахар, если взять неспелое яблоко и капнуть йода, то оно посинеет, так как яблоко еще не созрело. Как только яблоко созреет весь содержащийся крахмал перейдет в сахар и яблоко при обработке йодом не синеет вообще.
«ОКРАШИВАНИЕ ПЛАМЕНИ ИЛИ РЕАКЦИЯ СОЕДИНЕНИЯ»
Вам понадобится: пинцет, поваренная пищевая соль, спиртовка
Возьмем пинцетом несколько кристалликов крупной поваренной соли. Подержим их над пламенем горелки. Пламя окрасится в желтый цвет.
Данный эксперимент позволяет провести химическую реакцию горения, которая является примером реакции соединения. Благодаря наличию натрия в составе поваренной соли, при горении происходит его реакция с кислородом. В результате образуется новое вещество – оксид натрия. Появление желтого пламени свидетельствует о том, что реакция прошла. Подобные реакции является качественными реакциями на соединения, содержащие натрий, то есть по ней можно определить содержится натрий в веществе или нет.
4Na+O2=2Na2O
«СОЗДАНИЕ МОРОЗНОГО УЗОРА»
Налейте в склянку теплую воду, не очень много, не больше столовой ложки. Небольшими порциями, каждый раз хорошо размешивая, всыпьте нашатырь. Как только он перестанет растворяться, кисточкой нанесите раствор на кусок стекла или на зеркальце (осторожно, не порежьтесь!). Теперь придется подождать, пока вся вода не испарится. А когда воды не останется, на стекле появится узор, очень похожий на морозный. Только вместо льда - кристаллы хлорида аммония. Тепло им не страшно, но нельзя, чтобы на них попадала вода. Несколько капель - и конец чуду.
«НАДПИСЬ НА МЕТАЛЛЕ»
Реакцию взаимодействия металла с галогеном йодом можно провести в домашних условиях. Йодная настойка, которая есть у каждого в аптечке, представляет собой раствор галогена йода в спирте. Пластинку можно взять из любого металла или сплава.
Методика проведения эксперимента: Металлическую поверхность, на которой будет рисунок, прошлифуйте наждачной шкуркой до блеска, зажгите свечку и наклоните ее так, чтобы парафин капал на блестящую поверхность. Слегка нагрейте металл, тогда парафин растечется тонким слоем. А когда он охладится и застынет, иглой процарапайте какую-нибудь надпись так, чтобы бороздки от иголки доходили до слоя металла. Наберите пипеткой аптечный йод и капните на нацарапанные буквы. Через несколько минут раствор йода побледнеет, и тогда надо вновь нанести его на царапины. Примерно через час снимите слой парафина: вы увидите на металле ясные следы, они точь-в-точь повторяют рисунок на парафине.
Железо вступает в реакцию с йодом, в результате образуется соль - иодид железа. А эта соль - порошок, который легко удаляется с поверхности. И там, где были царапины, образовались углубления в металле. Такой процесс называют химическим травлением. Таким образом можно травить разные предметы из меди и медных сплавов.
«ФАРАОНОВЫ ЗМЕИ»
Фараоновы змеи — это не рептилии, как можно было бы подумать, а группа химических реакций, в ходе которых из совсем небольшого объема реактива образуется пористая масса, похожая на змею. Некоторые из таких процессов осуществимы только в лаборатории в силу токсичности реагентов или отсутствия их в свободной продаже. Однако несколько разновидностей «змей» можно получить и дома.
1 СПОСОБ:
Самый доступный вариант этого опыта — змея из пищевой соды и сахара. Для ее получения вам понадобятся:речной песок; чайная ложка сахара, измельченного в пудру; четверть такой же ложки пищевой соды; немного этилового спирта (96% будет достаточно); тарелка; спички или зажигалка.
Речной песок насыпьте горкой на тарелку и пропитайте ее спиртом. В вершине насыпи сделайте углубление. В него поместите смесь из сахара и соды. Подожгите горку. Спирт, которым она пропитана, загорится. Спустя несколько минут, когда он почти догорит, из песчаного конуса поползет черная, извивающаяся масса, очень напоминающая гадюку.
Опыт имеет простое обоснование. Сахар и спирт сгорают, а сода при нагревании разлагается. Все эти процессы сопровождаются выделением углекислого газа и паров воды. Они-то и придают пористость горящей массе. Сама «змея» состоит из смеси карбоната натрия, образующегося при разложении соды, с углем, полученными при сгорании сахарной пудры:
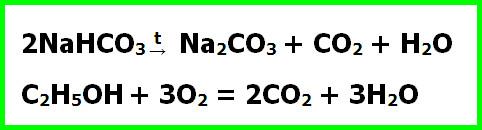
2 СПОСОБ:
Ещё одну «рептилию» можно получить из сухого горючего и глюконата кальция. Последний представляет собой таблетки, которые продаются в любой аптеке без рецепта и стоят совсем недорого.
На таблетку сухого горючего поместите глюконат кальция, подожгите. Из таблетки поползет серая змея. В этом опыте можно обойтись и без горючего. Достаточно поднести таблетку глюконата кальция к пламени.
При нагревании лекарство разлагается на углекислый газ, воду, оксид кальция, уголь. Последние два вещества и образуют основу змеи, а углекислый газ и парообразная вода делают ее пористой и заставляют ползти:

«ТАНЕЦ БАБОЧЕК»
Для опыта заранее делают «бабочек». Крылья вырезают из папиросной бумаги и приклеивают к тельцу (обломки спички или зубочистки) для большей устойчивости в полете.
Приготовляют широкогорлую банку, закрытую герметически пробкой, в которую вставлена воронка. Диаметр воронки вверху должен быть не больше 10 см. В банку наливают уксусной кислоты (CH3COOH) столько, чтобы нижний конец воронки не доставал до поверхности кислоты примерно на 1 см. Затем через воронку в банку с кислотой бросают несколько таблеток гидрокарбоната натрия (NaHCO3), а «бабочек» помещают в воронку. Они начинают «танцевать» в воздухе.
«Бабочек» удерживает в воздухе струя углекислого газа, образующегося в результате химической реакции между гидрокарбонатом натрия и уксусной кислотой:
NaHCO3 + CH3COOH = CH3COONa + CO2 + H2O
«РАДУГА НА БУМАГЕ ИЛИ КАК СВЕТ ОТРАЖАЕТСЯ НА РОВНОЙ ПОВЕРХНОСТИ»
Вам понадобится: миска с водой, прозрачный лак для ногтей, маленькие кусочки черной бумаги.
1. Добавьте в миску с водой 1-2 капли прозрачного лака для ногтей. Посмотрите, как лак расходится по воде.
2. Быстро (спустя 10 секунд) окуните кусок черной бумаги в миску. Выньте его и дайте высохнуть на бумажном полотенце.
3. После того, как бумага высохла (это происходит быстро) начните поворачивать бумагу и посмотрите на радугу, которая отображается на ней.
* Чтобы лучше увидеть радугу на бумаге, смотрите на нее под солнечными лучами.
«ДОЖДЕВОЕ ОБЛАКО В БАНКЕ»
Когда маленькие капли воды скапливаются в облаке, они становятся все тяжелее и тяжелее. В итоге они достигнут такого веса, что больше не смогут оставаться в воздухе и начнут падать на землю – так появляется дождь.
Это явление можно показать с помощью простых материалов.
Вам понадобится:пена для бритья, банка, вода, пищевой краситель.
1. Наполните банку водой.
2. Сверху нанесите пену для бритья – это будет облако.
3. Начните капать пищевой краситель на “облако”, пока не начнется “дождь” – капли красителя начнут падать на дно банки.
«МАГИЧЕСКИЕ КРИСТАЛЛЫ В СТАКАНЕ»
Вам понадобится: стеклянный стакан или миска,пластиковая миска, вилка, чашка соли Эпсома (сульфат магния) – используется в солях для ванн, 1 чашка горячей воды, пищевой краситель.
1. Насыпьте соль Эпсома в миску и добавьте горячей воды. Можете добавить в миску пару капель пищевого красителя.
2. В течение 1-2 минут размешивайте содержимое миски. Большая часть гранул соли должна раствориться.
3. Налейте раствор в стакан или бокал и поместите его в морозилку на 10-15 минут. Не волнуйтесь, раствор не настолько горяч, чтобы стакан треснул.
4. После морозилки переместите раствор в основную камеру холодильника, желательно на верхнюю полку и оставьте на ночь.
Рост кристаллов будет заметен лишь спустя несколько часов, но лучше переждать ночь.
Помните, что кристаллы очень хрупки. Если дотронуться до них, они вероятнее всего сразу сломаются или рассыплются.
«ШИПЫ НА ВЕРЕВКЕ»
Вы научитесь делать шипы, которые будут расти из обыкновенной веревки!
Вам понадобится: два пластиковых стакана, шесть чайных ложек пищевой соды, длинная веревка, вода, ложка.
Заполните каждый пластиковый стакан одинаковым количеством воды. Поместите 3 чайных ложки пищевой соды в каждый стакан и тщательно перемешайте. Положите концы веревки в каждый пластиковый стаканчик и оставьте их там, на 1-2 дня.
В каждый пластиковый стаканчик обязательно налейте одинаковое количество воды и одинаковое количество соды. После того, как Вы добавите пищевую соду в воду, очень тщательно перемешайте ее в воде, ведь от этого будет зависеть результат опыта «Шипы на веревочке»!
После того, как Вы приготовили раствор и поместили в него веревку, через 1-2 дня на ней появятся небольшие колючие шипы.
Вода проходит через веревку и захватывает с собой частички пищевой соды, что в последствии создает шипы на веревочке.
«ЛАВОВАЯ ЛАМПА»
Это интересно!
Лавовая лампа была изобретена Эдвардом КрэйвеномУолкером в 1963 году. Для тех, кто не знаком с лавовыми лампами, они были главным декором квартир в 60-х годах. «Лампа» состоит из немного треугольного лабораторного стеклянного стакана, который заполнен жидкой «лавой». При включении «лава» начинала плавать.
Вам понадобится: соль, водопроводная вода, чашка оливкового или растительного масла, несколько пищевых красителей, большой прозрачный стакан.
Заполните на 2/3 стакан водой. Позже Вам нужно будет добавить масло, поэтому убедитесь, что для масла есть место. Вылейте масло в стакан. Масло будет плавать на поверхности воды, не пытайтесь смешать его с водой. Добавьте несколько капель различных красителей к воде и маслу. Медленно высыпите 1 чайную ложку соли в стакан с водой и маслом. Наблюдайте, что происходит с масляной и водной смесью.
Добавьте несколько капель пищевого красителя для лучшего эффекта. Это сделает практически настоящий вид лавовой лампа в Вашем стакане!
Масло легче воды, поэтому плавает на ее поверхности. С другой стороны соль более тяжелее, чем масло. Когда Вы добавляете соль в стакан, она опускается на дно стакана, беря с собой частички масла. Когда соль распадается, она отпускает частицы масла и те поднимаются на поверхность. Опыт «Лавовая лампа» схож с концепцией лавовой лампы и показывает, как она работает. Шарик в лампе состоит из воска, который танцует вниз и вверх. Он расширяется, становясь менее плотным, чем жидкость вокруг него, вызывая последовательность.
«ИЗВЕРЖЕНИЕ ВУЛКАНА»
Углекислый газ - газ без цвета и запаха, его химическое соединение состоит из двух атомов кислорода, связанного с одним атомом углерода. Диоксид углерода можно найти в безалкогольных напитках и газированной воде.
Вам понадобится: одна упаковка Ментоса, двухлитровая бутылка газировки (желательно Coca-Cola), листок бумаги, свернутый в трубочку, небольшой кусочек картона.
Откройте газировку и встряхните ее немного. Достаньте все конфетки Mentos из упаковки и аккуратно поместите их столбцом в трубочку листа. Кусочек картона, удерживая, поместите наверх бумажной трубочки с Ментосом и переверните ее.
Извержение пройдет очень быстро, поэтому убедитесь, что Вы готовы. Поместите бумажную трубочку на горлышко Вашей газировки и аккуратно уберите картонку под трубочку, чтобы конфеты плавно упали на дно бутылки.
Сразу же отойдите в сторону и смотрите, как происходит опыт «Извержение вулкана»!
Опыт «Извержение вулкана» лучше всего проводить на открытом пространстве. Используйте 2-х литровую газировку и конфеты Mentos для лучшего эффекта.
Когда конфеты Ментос падают в газировку, которая заполняется с помощью углекислого газа, желатин и гуммиарабик от растворения конфет создает дефицит энергии, что разрушает поверхностное натяжение газировки. Когда Ментос достигает дна бутылки, углекислый газ освобождается и толкает всю газировку из бутылки в воздух, на удивительную высоту.
«РЕЗИНОВОЕ ЯЙЦО»
Кальций – химический элемент с атомным номеров 20 и символом Ca. Он 5-ый самый распространенный элемент по массе в земной коре. Кальций - важный компонент здорового питания, он необходим для здоровых и крепких зубов и костей. Кроме того, постоянные недостатки кальция могут привести к нарушению функции почек, нарушению состояния костей и зубов.
Вам понадобится: яйцо, стакан, уксус.
Поместите яйцо в пустой стакан. Налейте уксуса в стакан, пока яйцо полностью не покроется им. Подождите несколько дней и достаньте яйцо из уксуса.
При проведении опыта «Резиновое яйцо» важно, не беспокоить яйцо несколько дней, пока оно лежит в уксусе. После 3-4 дней яйцо будет готово для наблюдения.
Уксус вступает в реакцию с кальцием в яичной скорлупе, в результате чего кальций растворяется. Это делает скорлупу эластичной (мягкой). Также это свидетельствует о том, как важен кальций для костей и зубов. Так что, когда Вы будете покупать газировку, вспомните опыт «Резиновое яйцо» и купите лучше бутылку молока!




Самодельный огнетушитель.
Налейте в пластмассовый флакон из-под шампуня до половины насыщенный раствор соды. Добавьте в раствор чайную ложку стирального порошка и хорошо перемешайте. В пузырек из-под пенициллина налейте (до 1/3 объема) раствор какой-либо кислоты и закройте (неплотно) бумажным тампоном. В крышке флакона проделайте отверстие и вставьте гибкий шланг, чтобы он плотно входил в него. Осторожно опустите пузырек с кислотой в раствор соды (пузырек должен плавать) и завинтите крышку со шлангом, чтобы он доходил до дна флакона. Если резко повернуть флакон вверх дном, то кислота вступит в контакт с раствором соды, образуется углекислый газ, который будет вместе с пеной выходить через шланг. Пену направьте на горящую свечу. Пламя гаснет.
Для горения нужен воздух.
Насыпьте на противень равномерным слоем песок и поставьте на лист на некотором расстоянии друг от друга небольшие огарки свечи. Свечи зажгите и накройте (одновременно) стеклянными банками разных размеров. Первой гаснет свеча, накрытая самой маленькой баночкой; последней - свеча, накрытая самой большой банкой.
Получение дистиллированной воды.
Налейте в эмалированный чайник на 1/3 объема воды и поставьте на газовую плиту так, чтобы носик чайника выступал за край плиты. Когда вода закипит, нацепите на носик чайника стеклянную банку- холодильник, под которую приспособьте вторую банку для сбора капелек воды (конденсата). Для того, чтобы банка–холодильник не перегревалась, на нее можно положить мокрую холодную салфетку или лед.
Ныряющее яйцо.
В высокий сосуд налейте слабый раствор кислоты. Затем в раствор опустите неочищенное куриное яйцо, которое опускается на дно сосуда. Через некоторое время на поверхности скорлупы появятся пузырьки углекислого газа, которые поднимут яйцо на поверхность. Если яйцо слишком тяжелое, то чуть посолите раствор.
Приготовление лимонада.
Налейте в стакан охлажденную кипяченую воду, добавьте немного варенья или сиропа, щепотку лимонной кислоты и хорошо перемешайте. Добавьте немного пищевой соды, энергично перемешайте. Лимонад готов.
Химические водоросли.
Купите пару флаконов силикатного клея (бумажного). Разбавьте клей водой (1:1) и налейте в стеклянную банку. Предварительно на дно банки положите насколько крупных кристаллов медного купороса (спросите в садовом магазине). Вы увидите растущие на глазах водоросли.
Несгораемый платочек.
Небольшой носовой платок из ткани погрузите в раствор бумажного клея из предыдущего опыта, хорошо смочите платочек и отожмите. Затем платок берут пинцетом за уголок, погружают в бензин или спирт, быстро вынимают и тут же поджинают с помощью длинной палочки. Сосуд с бензином или спиртом предварительно убирают подальше от пламени. При выполнении этого опыта будьте осторожны и делайте его вместе со взрослыми.
Йод и крахмал.
Добавьте несколько капель йодной настойки из аптечки к воде до получения слабо-желтой окраски. Этим раствором смочите кусочек хлеба, муку, сырой картофель на срезе. Если появляется синяя окраска, значит, в продуктах есть крахмал.
Горение сахара.
К кусочку сахара-рафинада поднесите горящую спичку. Сахар плавится, но не загорается. Если же на сахар посыпать немного пепла от сигарет (спросите у курильщика), то сахар загорается спичкой. Пепел ускоряет реакцию.
Извержение вулкана.
В широкий стеклянный сосуд, наполненный водой, поставьте пузырек спиртовой туши (продается в магазина канцтоваров). В пробке пузырька должно быть небольшое отверстие. Можно сделать из песка гору, в которой будет спрятан пузырек с тушью. Через маленькое отверстие из вершины горы будет подниматься цветная струйка. Ты можешь сделать ветер, слегка покачивая сосуд с водой.
Взрыв цвета в молоке.
Берем пищевые красители, моющее средство, молоко, ватную палочку.
Молоко выливаем в миску, добавляем 4 различных красителя. В середину каждой капли красителя добавляем ватную палочку, смоченную в моющем средстве. Без движения палочки, с помощью силы натяжения красители начинают двигаться.
Аспириновый коктейль.
Нужно 3 стакана, красители, солёная вода, масло растительное, спирт, стеклянная палочка.
В стаканы наливаем равное количество масла, спирта и соленой воды. В стакан со спиртом и соленой водой добавляем немного пищевого красителя разных цветов .Аккуратно переливаем в один большой стакан солёную воду, потом масло, затем спирт. Добавить одну таблетку шипучего аспирина. И мы увидим красочное смешение жидкостей.
Тайнопись.
Берем лист белой бумаги, ватную палочку, молоко и спиртовку.
Напишем ватной палочкой на белом листе бумаге любое слово, поднесем к горящей спиртовке. Мы будем наблюдать, как будут проявляться буквы, написанные молоком.
Домашний каучук.
В химический стакан налить бумажный клей и спирт, быстро размешать стеклянной палочкой. Достать образовавшийся комочек и промокнуть в салфетке.
Самовозгорание бумаги.
На бумажную салфетку насыпать сухой марганцовки, добавить концентрированную серную кислоту.
«Взрыв».
В стеклянную колбу добавить крепкий раствор гидропирита, затем моющее средство и раствор марганцовки.
Несгораемые деньги.
Тщательно обмокнуть бумагу в силикатном клее, затем в спирте. Поджечь над пламенем спиртовки бумагу.
Лакмусовые бумажки из сока свеклы
Нарезаем на несколько полосок фильтровальную бумагу, промачиваем в соке свеклы и даем высохнуть. Капаем раствором гидроксида натрия на одну из полосок, на другую соляной кислотой. Наблюдаем за изменением окраски полосок.
Зеленая съедобная яичница-глазунья.
Возьмем яйцо и разобьем его. Отделим белок от желтка. Тщательно перемешаем сок краснокочанной капусты с белком. На раскаленную сковороду добавим масло и выльем белок. Далее в центр аккуратно выложим желток и поджарим яйцо до готовности. Несмотря на зеленый цвет белка, яйцо вполне съедобно. Приятного аппетита! Красим живые цветы. Для этого опыта нам понадобятся 3 стакана с водой, 3 разных красителя, любой белый цветок, нож. В стаканы с водой добавляем красители. Аккуратно разрезаем вдоль стебель цветка на 3 части. Каждую из частей стебля опускаем в один из стаканов. Спустя 24 часа наш цветок окрасится в цвета данных красителей.
Окисление глюкозы.
Для опыта возьмем глюкозу (в аптеке) и растворим в воде. Добавим раствор медного купороса и немного раствора щелочи. Мы увидим ярко-синюю жидкость, которая при нагревании над спиртовкой изменяет свою окраску на кирпично-красную.