

СДЕЛАЙТЕ СВОИ УРОКИ ЕЩЁ ЭФФЕКТИВНЕЕ, А ЖИЗНЬ СВОБОДНЕЕ
Благодаря готовым учебным материалам для работы в классе и дистанционно
Скидки до 50 % на комплекты
только до
Готовые ключевые этапы урока всегда будут у вас под рукой
Организационный момент
Проверка знаний
Объяснение материала
Закрепление изученного
Итоги урока

Профессиональная проба – это профиспытание (профпроверка), моделирующая элементы конкретного вида профессиональной деятельности, имеющая завершенный вид, способствующая сознательному, обоснованному выбору профессии.
Профессиональная проба – это профиспытание (профпроверка), моделирующая элементы конкретного вида профессиональной деятельности, имеющая завершенный вид, способствующая сознательному, обоснованному выбору профессии.
Просмотр содержимого документа
«Профессиональная проба – это профиспытание (профпроверка), моделирующая элементы конкретного вида профессиональной деятельности, имеющая завершенный вид, способствующая сознательному, обоснованному выбору профессии.»
Предисловие.
Данные центра социально-профессионального самоопределения молодежи ИОСО РАО указывают на далеко не благоприятную обстановку с выбором выпускниками общеобразовательных школ своего профессионального пути:
- 50% учащихся, как правило, выбор профессионального будущего не связывают со своими реальными возможностями и потребностями рынка труда;
- 46% респондентов ориентированы в выборе профессии на поддержку со стороны взрослых – родителей, родственников или знакомых;
- 67%, не имеют представления о научных основах выбора профессии, в т. ч. не владеют информацией о требованиях профессии к ее соискателю и умениями анализа своих возможностей в профессиональном выборе;
- 44% респондентов не обеспечены сведениями о возможностях обучения в интересующей сфере труда.
Сельские старшеклассники, как правило, также неадекватно оценивают свои профессиональные перспективы: профессии, которые в их глазах имеют высокий рейтинг, считаются, по их мнению, престижными, не соответствуют потребностям рынка.
Основой профессиональной ориентации школьников является деятельность по выбору профессии, ее конкретные формы и те связи, в которые вступает школьник в поиске своего профессионального выбора.
М.С. Каган1 определяет четыре вида деятельности в связи с профессиональным самоопределением:
познавательная деятельность, призванная обеспечить профессиональное просвещение;
преобразовательная деятельность, связанная с практической пробой сил;
ценностно-ориентационная деятельность, обеспечивающая самопознание и саморегуляцию, выработку системы ценностей, поиск своего призвания;
коммуникативная деятельность, являющаяся основным условием познания, выработки системы ценностей и установления отношений с другими участниками процесса
Широкие возможности подросткам в расширении их профессиональной ориентации предоставляет профессиональная проба, назначение которой - создание максимально приближенной ситуации профессиональной деятельности. Именно через участие в профессиональной пробе можно сделать правильный для себя выбор.
Положительные аспекты профессиональной пробы для подростков заключаются в приобретении жизненного опыта, установлении деловых связей, утверждении себя среди друзей и близких, рождении уверенности в себе, формировании организаторских способностей и умений конкурировать с другими, оказании помощи семье.
Профессиональная проба – это профиспытание (профпроверка), моделирующая элементы конкретного вида профессиональной деятельности, имеющая завершенный вид, способствующая сознательному, обоснованному выбору профессии.
В условиях предпрофильной подготовки профессиональная проба выполняет следующие функции:
обучающую (формирование у учащихся целостного представления о конкретной профессии, группе смежных профессий, сфере труда, требованиях к профессиональным качествам личности);
диагностическую (диагностика общих и специальных профессионально значимых качеств личности);
практическую (получение завершенного продукта деятельности-изделия, выполнение функциональных обязанностей профессионала-специалиста);
развивающую (развитие интересов, способностей, склонностей, определенных качеств личности школьников, достигаемое за счет постепенного усложнения выполнения практических заданий в ходе пробы в соответствии с уровнем подготовленности учащихся, внесения в содержание пробы элементов творчества и самостоятельности).
Профессиональная проба выступает как важное условие формирования готовности школьников к выбору профессии. Она интегрирует знания о мире профессий, готовит психологически к принятию специфических особенностей выбранного вида профессиональной деятельности, осуществляет практическую проверку соответствия индивидуальных качеств личности школьника к требованиям профессии, отношения к выбранной сфере профессиональной деятельности.
Представленный материал по теме «Химия и профессия» показывает творческое применение результатов исследования особенностей сельской среды учителем химии в разработке элективных курсов. Форма профессиональной пробы находит реальное воплощение в обыденной жизни сельчан и представляет интерес для учащихся 9 классов.
Программа
Цикла элективных курсов «Химия в профессиях»
Пояснительная записка
Выбор профессии очень важный и сложный этап в жизни человека. В современных социально-экономических условиях нашей страны перед сельским школьником стоит проблема профессионального самоопределения, выбора места самореализации. Большая часть выпускников сельских школ покидает свою малую родину в поисках лучшей жизни в городе.
Вместе с тем, сельская школа в процессе образовательной подготовки учащихся не достаточно уделяет внимания изучению возможностей обеспечения жизнедеятельности в условиях села.
Ориентация школы на требования современного общества ставит перед ней новую цель - создание условий для формирования жизнеспособной, социально активной личности.
Достижению поставленной цели будет способствовать решение следующих задач:
формирование у школьников представлений о широком спектре профессий, реализуемых в данной местности;
развитие умений социально-экономического прогнозирования на основе изучения возможностей для создания малых предприятий и рабочих мест;
реализация реального выбора профиля и уровня обучения в соответствии с выбранной профессией и местом её осуществления.
Представленный цикл элективных курсов «Химия в профессиях» имеет своей целью оказание помощи выпускникам основной общеобразовательной школы:
- определиться в выборе направления и рода будущей трудовой деятельности через диагностику на профпригодность к химическим специальностям;
- познакомиться с профессиями, основанными на химических знаниях через информированность учащихся об особенностях и требованиях к ним, соответствующих учреждениях профессионального образования;
- испытать себя в роли соответствующего специалиста-химика.
Цикл «Химия в профессиях» состоит из четырёх самостоятельных и взаимодополняющих друг друга курсов по 8 учебных часов каждый и предлагается в качестве курсов по выбору учащимся 9 класса в ходе предпрофильной подготовки.
Основная идея цикла заключается в моделировании элементов конкретного вида профессиональной деятельности, основанных на использовании имеющихся знаний по химии за курс основной школы с расширением информированности учащихся о возможностях химического производства для развития малого бизнеса, индивидуального использования практических умений по химии в быту в условиях сельской среды.
Практическая ориентированность курсов цикла, обязательность получения конечного результата с апробацией его в реальных условиях определяют его как профессиональную пробу.
Основное содержание цикла:
- сведения о химических профессиях и специальностях (содержание профессиональных обязанностей, условий труда специалистов, требования к личности специалиста, адреса и названия образовательных учреждений, осуществляющих подготовку специалистов данного профиля);
- условия, содержание и организация профессиональной пробы (целеполаганиие, планирование, организация, контроль и оценка своих действий);
- приемы и способы проведения экспериментальных работ в нестандартных ситуациях (наблюдения, описание, сравнение, оценка полученных результатов, обоснование выводов);
- условия безопасного обращения со специальным лабораторным оборудованием, реактивами.
Особенности организации и проведения спецкурсов цикла:
1. В ходе реализации спецкурсов разрабатывается комплекс теоретических и практических заданий, моделирующих основные характеристики предмета труда, условий трудовой деятельности, орудий труда.
2. Спецкурсы ориентированы на углубленное изучение химиии, совершенствование и систематизацию предметных и надпредметных знаний и умений.
3. В процессе выполнения практических заданий используются утилитарные знания и умения учащихся, их субъектный опыт.
4. Практические задания выполняются с использованием доступной учебной и материально-технической базы школы (учебной и научно-популярной литературы, набора химических реактивов и оборудования).
5. Субъектная позиция учащихся в процессе осуществления профессиональной пробы предполагает применение современных образовательных технологий (метода проектов, деловых и ролевых игр, обучающего эксперимента).
6. Окончание профпробы завершается обязательностью оценки социально-экономической значимости полученного результата и самооценкой на профпригодность.
Основные требования к уровню подготовки учащихся.
По окончании изучения одного или всех спецкурсов цикла «Химия в профессиях», учащиеся должны знать:
- общие теоретические сведения, связанные с характером выполняемой профессиональной пробы (указанные в программе);
- алгоритмы решения необходимых расчётных задач (указанные в программе);
- правила безопасности обращения с химическими веществами и оборудованием;
- меры оказания первой медицинской помощи при термических и химических ожогах;
- области применения в повседневной жизни полученных знаний и умений;
- содержание, характер труда в сфере деятельности (указанной в программе), требования и профессиональные качества, предъявляемые к личности.
должны уметь:
- выполнять операции, связанные с профессиональной деятельностью (указанной в программе);
- осуществлять наблюдения, описания и делать выводы при выполнении экспериментальных работ;
- пользоваться химическими реактивами и оборудованием;
- соблюдать технику безопасности при выполнении практических работ;
- выполнять простейшие вычисления и измерительные операции;
- соотносить свои индивидуальные особенности с профессиональными требованиями;
- применять в повседневной жизни полученные знания и умения;
- рационально организовывать свою деятельность.
Содержание элективных курсов (профессиональных проб)
«Химия в профессиях»
Профессиональная проба 1
Открой свой завод
Особенность элективного курса
Данный элективный курс ставит учащегося в позицию частного предпринимателя, который хочет открыть своё дело и начинает с составления бизнес-плана на примере аммиачного производства (см. учебник «Неорганическая химия» / авт. Рудзитис Г.Е., - М.: «Просвещение, 1998).
Предполагается, что учащийся должен изучить все этапы химического производства аммиака и познакомиться со всеми профессиями.
Далее ему будет предложено «открыть свой завод», а вот, где: в сельской местности или в городе - он выбирает сам. Учитель лишь акцентирует внимание на том, как важно развивать социально-экономическую сферу своей малой родины.
Тематическое планирование
| № | Тема | Количество ч. | Основное содержание (понятийный аппарат) |
| 1 | Введение. Знакомство с программой, целями и задачами курса. Значение правильного выбора профессии для личности. Диагностические тесты «Гожусь ли я в химики?» | 1 | Значение правильного выбора профессии для самореализации личности. Комплекс профессиональных качеств специалиста-химика. |
| 2
| Важнейшие составляющие химического производства. Защита окружающей среды и охрана труда. Химико-технологические процессы в производстве аммиака. | 1 | Сырьё, энергия, оборудование. «Предельно-допустимая концентрация», идея безотходного производства. Свойства и применение аммиака (повторение). Основы производства аммиака. |
| 3 | Профессии, связанные с аммиачным производством. | 1 | Основные профессии работников аммиачного производства их характеристики: оператор, компрессорщик, аппаратчик, катализаторщик, лаборант, инженер-технолог, эколог, инженер по охране труда, менеджер. |
| 4
| Химические предприятия родного края. Образовательные учреждения химического профиля. | 1 | Химический завод: составляющие производства, технология основных процессов, специальности (отчет по итогам экскурсии или просмотру рекламных фильмов и буклетов). Учреждение профессионального образования, их видовая классификация (начального, среднего, высшего профессионального образования) и профилизация. |
| 5-8 | Профессиональная проба по теме (на выбор): Производство меди. Производство железа. Производство глюкозы.
| 4 | Проект. Бизнес-план «Я открою завод по производству….»: Значение данного вещества в жизни общества. Способы получения, их приемлемость к местным условиям. Оборудование и специалисты по производству вещества. Технология основных процессов. Модель (схема) производства вещества. Практическое получение данного вещества. Расчёты получения вещества. |
| Итого: | 8 |
| |
План отслеживания результатов прохождения курса
Водный контроль. Диагностический тест «Гожусь ли я в химики?».
Промежуточный контроль. Практические упражнения по решению проблемных ситуаций на аммиачном производстве.
Итоговый контроль. Отчёт об экскурсии. Защита проекта. Анкетирование «Что дал мне этот элективный курс?».
Примерное содержание элективного курса.
Занятие 1.
Учитель. Наш элективный курс называется «В мире химических профессий». Вы познакомитесь с химическими специальностями, узнает, какими способностями должен обладать химик, попробуете себя в роли химиков, сделаете для себя вывод - какой род деятельности нужно выбрать в будущем. Если даже вы не хотите быть химиками, узнаете, что во многих профессиях также необходимы знаниях по химии.
Проверим, с помощью теста, какие у вас интересы и склонности.
Учитель. Вы, ребята, выбрали профессии, которые хотите получить. Давайте посмотрим, есть ли у вас к ним склонности.
Тест 1 (Журнал «Химия и жизнь», № 5, 1981, Лисичкин Г.В., Коробейникова Л.А.)
Интересы и склонности.
С левой стороны листа напишите одно под другим числа от 1 до13. Для ответов на вопросы используйте такие обозначения: очень нравится ++; нравится +; не нравится -; очень не нравится --. Записав сверху вниз ответы на первые 13 вопросов, начинайте вновь с верхней строки, с 14-го вопроса; процедура повторяется с 27-го, 40-о, 53-го и 66-говопросов. Отвечайте по возможности быстро, чтобы на тест ушло не более 10 мин.
Нравится ли вам:
Читать книги по занимательной физике или математике?
Читать книги о химических открытиях?
Выяснять устройство электрических приборов?
Читать журналы «Техника - молодежи» и «Юный техник»?
Узнавать о жизни народов и государственном устройстве зарубежных стран?
Знакомится с жизнью растений?
Читать классиков литературы?
Обсуждать текущие события в нашей стране и за границей?
Читать книги о сверстниках?
Знакомиться с работой врачей.
Заботится о домашнем уюте?
Ходить в театры и на выставки?
Читать военные мемуары?
Читать книги об открытиях в физике?
Выполнять домашние задания по химии?
Чинить бытовые приборы?
Слушать и смотреть передачи о новинках техники?
Ходить в походы, чтобы изучать родной край?
Делать уроки по биологии?
Читать критические статьи о литературе?
Участвовать в общественной работе?
Объяснять товарищам домашние задания?
Читать о том, как люди научились бороться с болезнями?
Готовить пищу и наводить в доме порядок?
Читать об искусстве?
Знакомиться с военной техникой?
Ставить опыты по физике?
Делать химические опыты?
Читать о новинках радио?
Чинить велосипед?
Коллекционировать камни и минералы?
Работать в огороде и в саду?
Письменно излагать свои мысли и наблюдения?
Читать книги по истории?
Заниматься с младшими школьниками?
Ухаживать за больными?
Помогать по хозяйству?
Заниматься в литературном, театральном или художественном кружке?
Участвовать в военных играх?
Заниматься в математическом кружке?
Готовить растворы для опытов?
Собирать радиоприемники?
Собирать модели машин?
Участвовать в географических и геологических экскурсиях?
Наблюдать за жизнью животных?
Изучать иностранный язык?
Выступать с политинформациями?
Работать вожатым?
Возиться с маленькими детьми?
Делать покупки для семьи?
Беседовать с товарищами об искусстве?
Заниматься спортом?
Участвовать в физических или математических олимпиадах?
Решать химические задачи?
Работать с измерительными приборами?
Конструировать модели, применяя расчеты?
Знакомиться с географическими открытиями?
Работать на пришкольном участке?
Обсуждать с товарищами прочитанные книги?
Изучать политический строй зарубежных стран?
Обсуждать вопросы воспитания?
Наблюдать за поведением животных?
Убеждать в чем – либо товарищей?
Знакомиться с историей искусств?
Быть организатором в играх и походах?
Вычислять по формулам?
Находить и наблюдать химические явления в окружающем мире?
Разбираться в радиосхемах?
Чертить?
Снимать план местности?
Ухаживать за животными?
Готовить доклады по книгам?
Знакомиться с историей культуры?
Отвечать на вопросы младших?
Узнавать о причинах разных болезней?
Знакомиться и общаться с новыми людьми?
Участвовать в художественной самодеятельности?
Соблюдать режим дня?
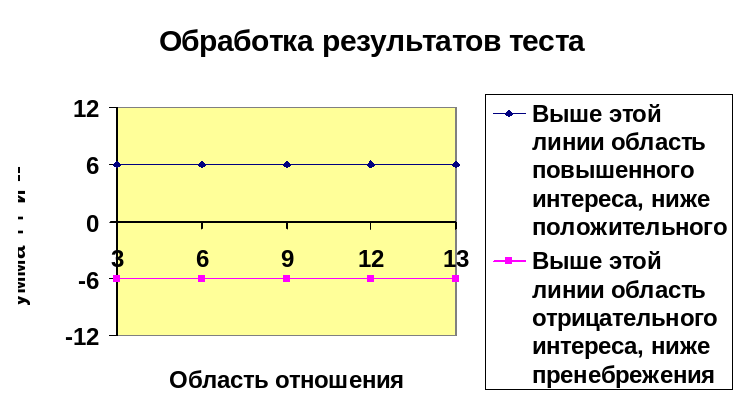
Обработка результатов: в каждой горизонтальной строке подсчитайте алгебраические суммы плюсов и минусов, результаты внесите в график, показанный на рисунке. Номера строк, отложенные на горизонтальной оси, означают при расшифровке: 1 – физика и математика, 2 – химия, 3 – электро- и радиотехника, 4 – техника, 5 – геология и география, 6 – биология и сельское хозяйство, 7 – филология и журналистика, 8 – история, 9 – педагогическая и воспитательная работа, 10 – медицина, 11 – сфера обслуживания, 12 – искусство, 13 – военное дело.
Следующий тест позволит определить особенности интереса к химии.
ТЕСТ. ОСОБЕННОСТИ ИНТЕРЕСА К ХИМИИ.
С левой стороны листа проставьте столбиком цифры от 1 до 8. Для ответов используйте те же оценки, что и в тесте Интересы и склонности. С верхней строки начинайте ответы на вопросы 1, 9, 17, 25, 33, 41 и 49. Отвечайте быстро, тест должен отнять не более 5—7 минут.
Нравится ли вам:
Точно отмерять вещества?
Пользуясь книгами, получать вещества, не изучаемые в школе?
Обращаться к вузовским учебникам?
Строго соблюдать условия химического эксперимента?
Знакомиться с техникой и автоматикой на производстве?
Возможность сочетать работу на производстве с учебой?
Знакомиться с педагогической деятельностью ученых?
Брать пример с человека, способного повести за собой других?
Работать с лабораторным оборудованием и приборами?
Ставить опыты в домашней лаборатории?
Представлять в уме, как взаимодействуют частицы при химических реакциях?
Знакомиться с продукцией химических предприятий?
Разбираться в схемах химических аппаратов?
Начинать и заканчивать работу ежедневно в одно и то же время?
Объяснять опыты товарищам?
Возглавлять работу, выполняя поручение учителя?
Помогать учителю готовить и проводить опыты?
Решать экспериментальные задачи по анализу и синтезу веществ?
Графически и схематически оформлять результаты опытов?
Составлять схемы промышленного получения веществ?
. Бывать в цехах на экскурсии?
Решать задачи с младшими школьниками?
Содержать рабочее место в чистоте?
Записывать лабораторные работы в тетради?
Выполнять опыты на занятиях химического кружка?
Использовать знания по физике и математике для объяснения химических опытов?
Узнавать, как организовано химическое производство?
Разбираться в устройстве химических аппаратов?
Узнавать подробности о работе на химическом заводе?
31. Наблюдать за поведением собеседника?
32. Многократно повторять опыт, пока он не пойдет безупречно?
Поддерживать порядок в кабинете химии и на лабораторном столе?
Разбираться в причинах неудачи опыта?
Изучать теорию, чтобы понять ошибку в опыте или в решении задачи?
Проводя опыты, строго соблюдать предписания?
Перерисовывать химические приборы?
Узнавать об условиях труда на химических предприятиях?
Читать книги о жизни подростков?
Приводить в порядок оборудование школьного кабинета химии?
Обращаться к учителю, если что-то неладится в опыте?
Подбирать химические реактивы, прежде чем делать опыт?
Искать объяснения явлениям природы?
Решать расчетные задачи по химии?
Чертить, разбираться в схемах?
Строго соблюдать распорядок дня?
Слушать ответы товарищей на уроках?
Носить спецодежду?
Выполнять обязанности лаборанта?
Сопоставлять результаты опытов, искать в них сходство и различие?
Заниматься умственным трудом?
Сравнивать внешний вид и качество промышленных изделий?
Знакомиться с материалами, из которых сделаны химические аппараты?
Заниматься физическим трудом?
Разъяснять сущность химических явлений, если к вам обращаются с вопросами?
Планировать свои действия?
Обработка результатов: та же, что и в тесте склонности, только на горизонтальной оси графика будет восемь точек. Они означают: 1 — лаборант, 2 — экспериментатор-исследователь, 3 — теооетик, 4 — технолог, оператор, 5 — техник, конструктор, 6 —— рабочий, 7 — преподаватель химии, 8 — организатор. Заключение выносится по двум-трем точкам с максимальными оценками. Ровные оценки означают скорее всего, что интересы еще не определились.
Учитель. Спасибо за работу. Теперь проведем тест: Черты характера. Помните, какими чертами характера должен обладать химик?
ТЕСТ: ЧЕРТЫ ХАРАКТЕРА
Попробуйте честно оценить по обычной пятибалльной системе некоторые свои действия и привычки. Для большей объективности попросите товарища, учителя, родителей выставить вам оценки за то же самое.
А. Аккуратность, собранность, трудолюбие
Оцените баллами от 1 до 5:
Использование тетрадей и блокнотов (до конца ли они заполнены записями).
Чистоту своей обуви.
Чистоту и порядок в комнате.
Порядок на рабочем столе.
Выполнение домашних обязанностей.
Помощь семье по хозяйству.
Порядок в размещении книг и коллекций.
Состояние портфеля.
Подготовку учебников и тетрадей к предстоящему учебному дню.
10. Аккуратность записей в тетрадях.
11 Систематичность записей в дневнике
Чистоту школьной формы.
Систему в приготовлении домашних заданий.
Организацию свободного времени.
15. Состояние учебников
Обработка результатов: сложите все баллы, разделите сумму на 75 и умножьте на 100. Вычислите средний показатель из оценок, которые вам дали разные люди.
Б.Самостоятельность, настойчивость, целеустремленность
Продолжаете ли вы работу, даже если она наскучила?
Составляете ли план устного ответа или сочинения?
Соблюдаете ли режим дня?
Систематически ли делаете утреннюю гимнастику?
Заглядываете ли в конец книги, не дочитав ее?
Добиваетесь ли во всех случаях решения задачи, если она не получается?
Добиваетесь ли положительного результата опыта, если он первый раз получился неудачно?
Усидчивы ли вы?
Можете ли утверждать, что у вас есть твердая и ясная цель в жизни?
10. Ежедневно ли выполняете домашние задания?
Обработка результатов: сложите оценочные баллы, разделите сумму на 50 и умножьте на 100. Если оценки вам выставляли и другие, то подсчитайте средний показатель.
Если показатель успешности выполнения того или иного теста лежит в пределах от 75 до 100, то это значит, что данное качество развито у вас* очень хорошо. Оценка 50—75 свидетельствует о нормальном, а меньше 50 — о недостаточном развитии. В последнем случае необходимы постоянные упражнения и тренировки.
Учитель. Не придавайте слишком большого значения вычисленным показателям. Во-первых, самооценка способностей не самый точный метод, а для более строгой оценки тесты должен предъявлять опытный специалист. Во-вторых, недостаточно развитые компоненты способностей часто можно скомпенсировать, интенсивно развивая другие компоненты, например, воспитывая волю или тренируя память.
Выполнив задания, обратите внимание на следующее: уточнили ли вы свои интересы и склонности; совпали ли оценки, полученные при выполнении тестов, с результатами самонаблюдения, мнением родителей, учителей-, товарищей; стало ли вам яснее, что следует развивать и совершенствовать.
И еще: не полагайтесь только на собственное мнение, даже если оно подкреплено результатами тестов. Особенно когда речь идет о выборе профессии. Посоветуйтесь с учителем, с родителями, с профессиональными химиками. Учтите состояние здоровья и советы врача. Если есть возможность поговорить с консультантом по профориентации — очень хорошо. И только потом сделайте окончательный выбор.
Если вы и не годитесь в химики, есть много других очень хороших профессий. Но было бы приятно, если на вопрос, гожусь ли я в химики, вы могли бы твердо ответить: да.
ТЕСТ: ОЩУЩЕНИЕ И ВОСПРИЯТИЕ
ВЕЩЕСТВА
Гравитационные ощущения
Отсыпьте на глаз по 5 г поваренной соли и свинцового глета. Точность проверьте взвешиванием, результат подсчитайте по тем же формулам, что и прежде.
Б. Глазомерная оценка массы.
Исследователь предлагает испытуемому навески хорошо известных веществ — сахарного песка, поваренной соли, муки и т. п. Вещества находятся в одинаковых коробочках или чашках; в руки не брать! Определите на глаз массу. Вычисления- — по тем же формулам.
В. Глазомерная оценка объема
Налейте из-под крана в большие конические колбы по 1 40 мл воды, желтого раст
вора К2СгО4 , зеленого раствора NiSO4 .
Три раствора — бесцветный, красный и голубой — разделите пополам (результат
вычисляется по меньшей из частей).
Проверьте свою точность с помощью мерного цилиндра. Формулы те же.
Г. Линейный глазомер
На чистом листе бумаги проведите отрезок прямой длиною 1 2,5 см.
Изобразите углы в 65° и 115°.
3. Нарисуйте окружность диаметром 5,5 см. Замеры — линейкой и транспортиром.
Подсчеты прежние.
Д. Цветоощущение и цветовосприятие
Исследователь готовит: а) набор из 10 цветных растворов (всех цветов радуги); б) шка-лы окрашенных растворов — перманганата калия и сульфата меди. Для приготовления шкал надо разбавить в пробирках 1 %-ные растворы обоих веществ в таком отношении:
| Раствор | 10 | 8 | 6 | 5 | 4 | 2 | 1 | 0,5 | 0,1 | 0 | |
| Вода | 0 | 2 | 4 | 5 | 6 | 8 | 9 | 9,5 | 9,9 | 10 | |
Пробирки ставят в произвольном порядке.
Найдите переходный цвет между синим и красным.
Найдите переходный цвет между синим и зеленым.
Найдите переходный цвет между желтым и красным.
Составьте радугу.
Расположите пробирки с раствором перманганата калия по убыванию интенсив-
ности окраски.
Расположите пробирки с раствором сульфата меди по возрастанию интенсивно-
сти окраски.
Задания 1,2 и 3 имеют две оценки: правильно — 100, неправильно — 0. Задания 4, 5 и 6 оцениваются по числу правильно расположенных пробирок.
Е. Обоняние
Исследователь заготовляет два набора бесцветных пахучих веществ: винного спирта, ацетона, керосина, эфира, бензина, уксусой кислоты, одеколона и др.; один набор — с названиями веществ, другой — в склянках под номерами. Кроме того, из 10%-ных растворов уксусной кислоты и водного аммиака надо приготовить по указанной в пре-дыдущем задании схеме две шкалы.
1. Понюхайте известное вещество, затем отыщите его по запаху в склянках под
номерами. Повторите тех же с другим веществом. Правильно — 100, неправильно — 0 баллов.
2. Расположите по убыванию интенсивности запаха пробирки с растворами уксусной кислоты и аммиака. Оценка и расчет — прежние.
Ж. Тепловые ощущения
Определите на ощупь температуру воды из водопроводного крана и воды, согре
той на плитке.
На сколько примерно градусов повысилась температура воды в стакане, когда
растворили несколько гранул щелочи?
3. На сколько примерно градусов понизилась температура воды в стакане, когда
в ней растворили чайную ложку аммиачной селитры? Проверка — термометром, результат — по тем же формулам.
ТЕСТ. ОБЪЕМ ВНИМАНИЯ
Требуется участие второго человека — исследователя. Он должен приготовить две коллекции: 1) из 20 предметов — веществ, посуды и приспособлений, применяемых в химической лаборатории; 2) из 20 веществ — твердых и жидких, белых и цветных, в различной упаковке.
1. Осмотрев первую коллекцию в течение минуты, составьте, не подглядывая, список предметов.
Обработка результатов: число правильно названных предметов разделите на 20 и умножьте на 100. Если названы предметы, отсутствующие в коллекции, их число сначала вычитается из суммы правильно названных.
2. Осмотрев в течение минуты вторую коллекцию, ответьте на два вопроса (по выбору исследователя): сколько всего веществ, сколько в стеклянной посуде, сколько в полиэтиленовой упаковке, сколько твердых веществ, сколько жидких, окрашенных, белых, прозрачных и т. п.
Обработка результатов. Относительный балл вычисляется по формулам:
А/В∙100 или 100 –((А-В)/В∙100)
где А — названное число, В — правильное число. Первая формула применяется в том случае, если А меньше В, вторая — если А больше В. Оценочные баллы складываются и делятся на число задани'й — так вычисляется показатель успешности выполнения теста.
ТЕСТ. НАБЛЮДАТЕЛЬНОСТЬ И ЗРИТЕЛЬНАЯ ПАМЯТЬ
Повторите за демонстратором какое-либо целесообразное сложное действие
(например, отмеривание жидкости дозатором или включение клавиш и тумб
леров на панели прибора). Словесное пояснение исключается. Учитывается
число правильно и последовательно проведенных действий.
Нарисуйте контур рамы мужского и женского велосипедов.
Перечислите изменения, которые можно последовательно наблюдать при растворении комочка соли в холодной воде.
Где собираются плавающие на поверхности сухие чаинки, когда чай перемешивают в стакане?
5. Где скапливается сыворотка после створаживания молока в бутылке?
6. Демонстратор показывает опыт с нагреванием основного карбоната меди в пламени горелки. Назовите последовательно наблюдаемые изменения. Задания 2, 4 и 5 имеют две оценки: правильный ответ — 100, неправильный — 0. В заданиях 1,3 и 6 результаты подсчитывают по приведенным выше формулам. Показатель успешности вычисляют так же, как раньше.
ТЕСТ. ПАМЯТЬ
1. На изучение набора из 50 слов дается
две минуты:
мензурка, холодильник, портфель, атом, одежда, директор, осадок, умывальник, таблица, реакция, обувь, учитель, катализатор, ковер, прибор, пробирка, радио, тетрадь, реактив, мебель, урок, молекула, телевизор, учебник, лакмус, шкаф, парта, индикатор, часы, авторучка, раствор, семья, ученица, лаборатория, посуда, пионер, кислота, телефон, звонок, фильтр, комната, урок, основание, замок, комсомолец, термостат, водопровод, мел, портрет, штатив.
Запомнившиеся слова воспроизведите на бумаге в любой последовательности. Число слов, названных, но отсутствующих в списке, вычитается из числа правильно названных слов. Результат вычисляется по тем же формулам, что и раньше.
Исследователь читает, испытуемый повторяет по памяти: «В науке должно
искать идеи. Нет идеи, нет и науки! Знание фактов только потому и драгоценно,
что в фактах скрываются идеи; факты без идей — сор для головы и памяти»
(В. Г. Белинский).
То же, но цитата стихотворная:
«Слепые не могут смотреть гневно. Немые не могут кричать яростно. Безрукие не могут держать оружие. Безногие не могут итти вперед. Но - слепые могут кричать яростно. Но — немые могут глядеть гневно. Но — безрукие могут шагать вперед. Но — безногие могут держать оружие». (Г. Головатый)
Дословное воспроизведение текстов в заданиях 2 и 3 оценивается числом 100, близкое к тексту — 70, правильное изложение смысла словами текста — 50, произвольное изложение смысла — 30, все, что хуже,— 0. Чтобы вычислить показатель успешности, разделите сумму баллов на число выполненных заданий.
ТЕСТ. ПРОСТРАНСТВЕННОЕ ВООБРАЖЕНИЕ
Изобразите на бумаге линию пересечения двух одинаковых конусов,
стоящих на плоскости; оси конусов параллельны.
Две лежащие на земле одинаковые трубы пересекаются под углом. Как будет выглядеть сверху линия их пересечения?
Нарисуйте линию, которую описывает точка на ободе малого колеса, катящегося по большому колесу.
Напишите печатными буквами слово «реакция» так, чтобы его можно было правильно прочесть в зеркале.
Напишите печатными буквами слово «человек» так, чтобы его можно было правильно прочесть на просвет с оборота листа.
6. Сделайте зеркальное изображение Фигуры, показанной на рисунке. Вариант: по негативу нарисуйте позитив

Обработка результатов. В заданиях 1, 2 и 3 только две оценки: 100 за правильный ответ, 0 — за неправильный. Задания 4, 5 и 6 оцениваются так: число правильно выполненных элементов (букв в слове, частей фигуры) делится на число всех элементов и умножается на 100. Все шесть оценок складываются и делятся на число заданий, то есть на 6. Полученное число — средний показатель успешности для данного теста.
Занятие 2
Учитель. Сегодня Вы попробуете себя в роли частных предпринимателей. Попробуете открыть химический завод. Как вы думаете, что для этого нужно?
Ученик. (Предполагаемый результат) Сырье, деньги, аппаратура, энергия, рабочие. Транспорт, знать химические процессы, условия протекания химических процессов, рынок сбыта, очистные сооружения, чтобы не отравлять окружающую среду и людей.
Учитель. Верно! Деньги мы возьмем в банке! Но для этого нужно составить бизнес – план. Чем мы с вами и займемся ближайшие занятия.
Начнем с анализа сырья. (Смотрите учебник Химия 11 кл, Габриелян О.С.) В нашем регионе есть месторождения глины, известняка. Других месторождений нет. Так, что же мы будем выпускать? Можно кирпич, стекло. Но уже есть такие заводы. Это конкуренты.
Можно начать производить аммиак, тем более, что для этого нужен азот, а его в воздухе 78% по объему. Также нужен водород, который можно получить из воды, разложением ее под действием электрического тока, из природного газа, путем разложения в присутствии определенных катализаторов и нагревании. Аммиак нужен для получения азотной кислоты, которая необходима для получения минеральных удобрений. Вот и рынок сбыта. Аммиак вернется к нам в виде минеральных удобрений.
Сырье мы нашли, что дальше?
Ученик. (Предполагаемый результат) Нужно узнать какие химические процессы лежат в основе получения аммиака.
Учитель. Верно! 3H2 + N2↔ 2NH3 + Q Обратимая, экзотермическая реакция. Значит надо создать условия для того, чтобы реакция шла в одном направлении. Какие это условия?
Ученик. (Предполагаемый результат) Это высокое давление и не высокая температура. Но чтобы ускорить реакцию нужно использовать катализаторы.
Учитель. Верно! Куда девать тепло, которое выделяется в результате реакции, и как поступить с исходными веществами, которые не прореагировали, ведь 100% выход продуктов не бывает.
Ученик. (Предполагаемый результат) Нужно использовать тепло для нагревания исходных веществ. А не прореагировавшие вещества использовать еще раз.
Учитель. Верно! Таким образом, мы с вами применяем принцип безотходного производства. А также принцип теплообмена. Как же отделить продуты реакции (аммиак) от оставшихся исходных веществ?
Ученик. (Предполагаемый результат) Использовать физические свойства всех этих веществ, например, температуру сжижения. По справочным данным Н2 – 0С , N2 – (-210)0С, NH3 - 0С.
Учитель. Верно! Таким образом, мы добрались до аппаратуры. Какое оборудование необходимо? Надо учитывать все условия и свойства.
Ученик. (Предполагаемый результат) Так как реакция экзотермическая, значит, аппарат должен выдерживать высокую температуру. Если, для ускорения реакции используется катализатор, значит, для него в аппарате нужны полки. Так как исходные вещества газообразные, значит, нужен компрессор. Используя принцип теплообмена – нужен теплообменник. Для отделения продуктов реакции от не прореагировавших исходных веществ, на основе их физических свойств, необходим холодильник. Для получения газа водорода из воды электролизным методом, нужно использовать электролизер.
Учитель. Верно! Давайте посмотрим, какие аппараты используются на настоящих заводах. (Смотрите учебник химии 9 кл, Рудзитис Г.Е.)
Занятие 3
Учитель. Теперь мы знаем, где добыть сырье для нашего производства, какие аппараты необходимы. Что же дальше? (При ведении этого занятия рекомендуется использовать наглядные пособия_ картинки, видео материал, компьютерные презентации, а так же держать в поле зрения схему технологической цепочки производства аммиака и показывать участок работы того или иного специалиста.)
Ученик. (Предполагаемый результат) Нам нужны специалисты.
Учитель. Верно! Какие специалисты необходимы? Прежде всего, это – инженер-технолог.
Инженер-технолог на химическом заводе или комбинате — главный специалист. Под руководством технолога происходит пуск установки, вывод на оптимальный режим ее работы, то есть создание таких условий или параметров, когда при наименьших затратах сырья и энергии получается наибольшее количество нужного продукта и с самым высоким качеством.
Инженер-технолог всегда в поиске. Как улучшить экономические показатели производства, повысить качество получаемых веществ, как использовать отходы, чтобы они тоже приносили пользу, а не отравляли окружающую природу? Изменились показатели исходного сырья — ведь природа, дающая его, не придерживается стандартов: перед технологом возникает задача найти такие параметры технологического процесса, чтобы конечный продукт по качеству не отличался от требуемого. Решение этих задач основано на опыте и больших знаниях. Инженеру-технологу требуется знание физики, математики и, конечно, химии, общих технических и инженерных дисциплин: черчения, теоретической механики, теории машин и механизмов, сопротивления материалов. Будущие технологи изучают общую химическую технологию, основы химического анализа, процессы и аппараты химической промышленности, контрольно-измеритель- ные приборы и автоматику, основы работы с электронно-вычислительными машинами.
Инженер-технолог должен обладать интеллектуальными и специальными умениями и навыками, применять знания, пользоваться логическими приемами: сравнения, обобщения, анализ. Также должен обладать наблюдательностью, ситуативной сообразительностью, быстротой реакции.
Аппаратчик (химического производства). Представьте себе наш завод по синтезу аммиака: ряд соединенных трубами больших резервуаров (емкостью в десятки, сотни или тысячи кубометров), систему их загрузки, подогрева (печи, паропроводы), приборы контроля, вентили (краны), переключатели, рукоятей управления загрузкой, подогревом, охлаждением и т. п. Вся совокупность технических сооружений и средств, обеспечивающих нормальные режимы протекания определенных химических реакций, называется аппаратом, а управляющие им люди — аппаратчиками.
Процессы превращения веществ, протекающие в химических аппаратах, не наблюдаемы. Чтобы управлять этими процессами, о них приходится судить в основном по показаниям приборов, по лабораторным пробам. В зависимости от показаний приборов, анализов, а также опираясь на инструкции, правила, свои познания (в области химической технологии и т. п.), аппаратчик рассчитывает и регулирует подачу химического сырья, полуфабрикатов, электроэнергии и обеспечивает другие факторы (условия) протекания химических реакций. Основная цель — обеспечить получение определенного вещества (например, аммиака) в требуемом количестве и заданного качества (без примесей \ и т. д.).
Начавшийся химический процесс активно идет по своим законам. Его также нельзя просто «остановить» без ущерба для результата, как нельзя остановить начатый прыжок с трамплина. Его нужно бдительно регулировать по определенным правилам и довести до конца. Если не следить за ходом химического процесса, он может выйти из нормальных режимов, и, как следствие, произойдет брак или даже авария (взрыв, пожар, утечка вредных газов и т. п., в зависимости от обстоятельств).
Аппаратчик должен многое знать, а главное — уметь быстро
принимать правильное решение по ходу технологического про-
цесса. От него требуется хорошее оперативно-практическое
мышление, способность не теряться в аварийной обстановке.
Машинист-компрессорщик – его работа требует знаний основ механики и химии, законов термодинамики и электротехники. Он должен знать устройство, принцип работы и правила эксплуатации оборудования, контрольно-измерительных приборов и автоматов, сущность и схему технологического процесса синтеза аммиака и его зависимость от режима работы компрессоров, физико-химические свойства сжимаемых газов. Он должен знать возможные типичные неполадки в работе оборудования, причины их возникновения и способы устранения, систему сигнализации и блокирования. Он должен уметь читать чертежи и схемы, знать слесарное дело, потому что в его обязанности | входит участие в профилактическом и капитальном ремонте.
Катализаторщик, для успешного выполнения своих функций должен знать как состав различных катализаторов, их свойства, требования, предъявляемые к катализаторам, так и закономерности протекания каталитических процессов. Отмечаем, что в обязанности катализаторщика входит приготовление и замени отработанного катализатора. Поэтому он должен: а) знать технологию приготовления; б) уметь готовить контактную массу; в) знать технологию замены катализатора; г) обладать навыком- менять катализатор.
В настоящее, время. все цеха синтеза аммиака переведены на автоматическое управление.
Работник, ведущий технологический процёсс центрального пульта управления, называется оператором. В его обязанности входит контролировать и координировать работу отдельных узлов производства. С помощью_ контрольно-измерительных приборов он непрерывно получает информацию о расходе сырья и вспомогательных материалов, температуре и давлении в колонне синтеза, уровне жидкого аммиака в сепараторе, составе газовой смеси, скорости передвижения веществ и т. д., записывает необходимые данные, анализирует их и управляет работой автоматических регуляторов. Он непрерывно осмысливает технологическую ситуацию и находится в состоянии постоянной готовности принять решение.
Оператор должен знать химическое строение веществ, их состояние, плотность, относительную атомную и относительную молекулярную массу, основные законы химии, а также химические формулы, состав и свойства всех веществ, с которыми работает. Кроме того, ему необходимо знать устройство, принцип действия и правила эксплуатации оборудования, назначение контрольно-измерительных приборов. Оператор должен быть наблюдательным, уметь распределять свое внимание, обладать хорошей памятью, сообразительностью, быстро ориентироваться в сложившейся технологической ситуации, принимать экстренные решения в аварийных условиях и вместе с тем быть уравновешенным, спокойным, дисциплинированным, ибо ему приходится иметь дело с легковоспламеняющимися и взрывоопасными веществами.
Лаборанты заводской лаборатории играют важную роль. Так как, все процессы происходят в закрытых аппаратах, т. е. не наблюдаемы, все вышеуказанные специалисты судят о протекающих реакциях только по приборам или на основе лабораторных анализов. В нашем случае – катализаторщик узнает об отравлении катализатора, инженер-технолог и оператор – о выходе продукта и степени его чистоты, компрессорщик – о составе и качестве исходной смеси. Поэтому лаборанты должны уметь выполнять эксперимент, соблюдать правила работы с веществами и приборами, готовить растворы, составлять графики, выполнять вычисления…
Эколог – специалист, который проводит экспертизу и прогноз (оценку влияния производственных процессов на окружающую среду, природохозяйственные объекты человека), участвует в экологической оценке различных хозяйственных мероприятий и проектов. Он должен знать такие науки – биология, климатология, метеорология, технология производства, правовые нормы охраны природы. Также уметь аналитически мыслить, наблюдать, уметь убеждать. К слову об охране окружающей среды: конечно же, наилучшим способом решения проблемы снижения вредности производства, служит применение безотходного производства. В нашем случае – непрореагировавшие газы многократно возвращаются в производство. В других случаях к современным методам относятся фильтрация, пыле-, газоуловители, обезвреживание, биологическая очистка, осаждение в специальных отстойниках, химические методы и т.д… Все равно это не панацея, необходимо систематически контролировать состояние окружающей среды.
Инженер по охране труда и технике безопасности – этот специалист, который контролирует обеспечение безопасности труда работников. Ему необходимо следить за предельно допустимыми концентрациями (ПДК) вредных веществ в воздухе производственных помещений и на территории предприятий, а так же за строгое соблюдение мер для предотвращения пожаров и быстрой ликвидацией возможных возгораний. Он контролирует обеспечение работников индивидуальными средствами защиты от вредных веществ.
Менеджер - специалист, который занимается поиском рынка сбыта продукции, а также сырья и оборудования. Должен знать экономику, технологию производства.
Учитель. Подведем итог, вернемся к нашему бизнес-плану. Итак, что нам нужно для открытия химического завода по производству аммиака?
Ученик. (Предполагаемый результат) 1. Сырье: Н2 из природного газа, N2 из воздуха, Н2О,
2. Оборудование: компрессор, колонна синтеза, теплообменник, холодильник, сепаратор, печь для разложения природного газа и получения водорода, газоуловители, винтеляторы, средства спец защиты.
3. Специалисты: Технолог, оператор, аппаратчик, катализаторщик, менеджер, лаборант.
4. Аренда или строительство помещения, лучше за городом.
5. Социальный пакет: Охрана здоровья работников (санатории, дома отдыха), повышение квалификации.
Учитель. Сейчас Вы попробуете себя в роли этих работников. (Раздаются карточки в которых указаны специальность с кратким описанием обязанностей применительно к производству аммиака.)
Содержание Карточек.
Инженер-технолог – должен знать реакцию процесса и условия его протекания: N2 + 3H2↔2NH2+Q. Т=4000С – 5000С, Р= 5 – 100 мПа, кат: Fe, K2O, Al2O3, Т(сжижения аммиака).
Аппаратчик – должен знать и следить за режимом работы, т.е. Т=4000С – 5000С, Р= 5 – 100 мПа, температура воды в холодильнике и сепараторе.
Каталтзаторщик - в обязанности катализаторщика входит приготовление и замена отработанного катализатора. Поэтому он должен: а) знать технологию приготовления; б) уметь готовить контактную массу; в) знать технологию замены катализатора; г) обладать навыком менять катализатор. Используемые катализаторы Fe, K2O, Al2O3.
Эколог - специалист, который проводит экспертизу и прогноз (оценку влияния производственных процессов на окружающую среду, природохозяйственные объекты человека), участвует в экологической оценке различных хозяйственных мероприятий и проектов.
Оператор – находится в центре управления всем оборудованием. В его обязанности входит контролировать и координировать работу отдельных узлов производства. С помощью_ контрольно-измерительных приборов он непрерывно получает информацию о расходе сырья и вспомогательных материалов, температуре и давлении в колонне синтеза, уровне жидкого аммиака в сепараторе, составе газовой смеси, скорости передвижения веществ и т. д., записывает необходимые данные, анализирует их и управляет работой автоматических регуляторов. Он непрерывно осмысливает технологическую ситуацию и находится в состоянии постоянной готовности принять решение.
Лаборант заводской лаборатории – выполняют различные анализы. Вычисляют по данным анализа выход продукта.
Инженер по охране труда - этот специалист, который контролирует обеспечение безопасности труда работников. Ему необходимо следить за предельно допустимыми концентрациями (ПДК) вредных веществ в воздухе производственных помещений и на территории предприятий, а так же за строгое соблюдение мер для предотвращения пожаров и быстрой ликвидацией возможных возгораний. Он контролирует обеспечение работников индивидуальными средствами защиты от вредных веществ. Должен знать, аммиак – это газ, легче воздуха (прятаться нужно на нижних этажах), ядовит, раздражает слизистую дыхательных путей, вызывает ожог и отек легких, хорошо растворяется в воде (мокрые марлевые повязки), доврачебная помощь – свежий воздух. Он оповещает МЧС, пожарную и медицинскую службы в случае аварийных ситуаций, до их приезда, силами завода организует и проводит эвакуацию работников.
Менеджер - специалист, который занимается поиском рынка сбыта продукции, а также сырья и оборудования. Должен знать экономику, технологию производства. Аммиак применяют при производстве азотной кислоты, удобрений, медицинских препаратов.
Учитель. Теперь рассмотрим работу завода и действия работников в различных ситуациях.
Ситуации.
Ситуация 1. Лаборант вычисляет выход продукта реакции по сравнению с теоретическим. (Исходные данные: 30 л водорода, 10 л азота, получилось 15 л аммиака.)
(Решают задачу все вместе.) Он же докладывает, что ранее выход аммиака при Т=4000С и Р=100мПа составлял 79,2%, а теперь согласно ответу решенной задачи. Что же произошло?
Учитель. Как вы думаете, что произошло и как устранить причину?
Ученик. (Предполагаемый результат)
Компрессорщик – может, упало давление в компрессоре? Поэтому идет малая подача азотоводородной смеси? Нужно увеличить давление в компрессоре.
Катализаторщик – может, катализатор потерял свою активность, т.е. «отравился», из за посторонних примесей в исходных газах. Надо заменить катализатор.
Оператор – нужно проверить показания холодильника, может температура воды высокая и аммиак не сжижается.
Аппаратчик сепаратора – может, утечка в сепараторе. Нужно проверить давление с сепараторе и уровень ПДК по аммиаку в сепараторном цехе.
Ситуация 2. Эколог сообщает, что обнаружено превышающее ПДК содержание ионов аммония в почве и воде на прилежащих к заводу территориях.
Ученик. (Предполагаемый результат)
Оператор – в сепараторе постоянно падает давление, очевидно есть повреждение и это дает утечку аммиака.
Ситуация 3. Оператор – В сепараторе падает уровень аммиака, сейчас может произойти утечка аммиака!
Ученик. (Предполагаемый результат)
Инженер по охрана труда и ТБ: Эвакуация работников, одеть средства индивидуальной защиты, вентиляция помещений, оповещение служб МЧС, ПС, МС.
Ситуация 4. Докладывает Оператор: авария на газопроводе, поэтому газ – водород не будет поступать.
Ученик. (Предполагаемый результат) Технолог – временно будем получать водород из воды путем электролиза.
Ситуация 5. Завод по производству азотной кислоты, куда мы поставляется произведённый аммиак, обанкротился. Что делать?
Ученик. (Предполагаемый результат) Менеджер – Будем договариваться с фармацевтической фабрикой.
Занятие 4
Экскурсия на завод или любое производственное предприятие, где есть химическая составляющая производства, или просмотр рекламных фильмов и буклетов. Знакомство с химической составляющей производства, технологическими процессами, специалистами. Отчёт об экскурсии. Вставить из моей книги форму отчёта.
Занятие 5
Экскурсия в ОУ, или просмотр рекламных фильмов и буклетов. Вставить
Занятие 6-8.
Теперь Вам предстоит выбрать темы проектов. Подумайте! Какое предприятие можно открыть в нашем посёлке, чтобы появились новые рабочие места.
Работа над учебным проектом проходит на занятиях.
Темы:
Получение меди из её оксида.
Получение глюкозы из картофеля.
Проект оформить в виде бизнес-плана «Я открою завод по производству….»:
Необходимость данного вещества.
Как его можно получить.
Какие способы подходят к нашим условиям.
Какое оборудование и специалисты нужны.
Технологические процессы.
Построение модели (схема).
Получение данного вещества практически.
Представление всех необходимых расчётов.
Оценка и Самооценка.
Ответить на вопросы анкеты.
Твое отношение к элективному курсу (выбери вариант ответа):
А) отличный, интересный, захватывающий;
Б) хороший, содержательный, заставляющий работать;
В) нормальный обычный;
Г) скучный, работа без интереса;
Д) Бесполезный, совсем не интересный.
Написать свой ответ.
Какая цель стояла перед тобой.
Какие события, факты, закономерности, формулы, явления, правила ты усвоил на курсе.
Чему новому ты научился на курсе.
Какие были главные мысли на курсе?
Какие ранее полученные знания ты использовал на курсе?
Литература.
Габриелян О.С, Лысова Г. Г. Химия,11 кл.-М.: Дрофа,2002.
Климов Е. А. Путь в профессию. – Л.: Лениздат,1974.
Человек и профессия. / Под ред. Е.А.Климова. - Л.: Лениздат,1975.
Справочник химика. – М: Высшая школа, 1995.
Фельдман Ф.Г, Рудзитис Г.Е. Химия, 9 кл, 10 кл.. – М.: Просвещение,1990.
Лурье Ю.Ю. Аналитическая химия промышленных сточных вод. – М.: Химия, 1984.
Прощицкая Е.Н. Выбирай профессию. – М.: Просвещение, 1991.
Бурицкая Н.Н. Политехническое образование и профориентация учащихся в процессе обучения химии. – М.: Просвещение,1983.
Журнал «Химия в школе № 5. 1999 г.
Прохорова И.А. Программа элективного курса «Я химия и профессия…», Организация предпрофильной подготовки в сельских школае., ВИПКРО, Владимир 2005.
Профессиональная проба 2
Растворы в саду
Воздадим должное сельской жизни, хотя бы такой, какую ведет садовод-любитель, выращивающий на своем участке смородину, морковку, цветы. Садоводство - прекрасная возможность заняться посильным физическим трудом на свежем воздухе, в надежде получить отдачу от своих зеленых питомцев.
Не будем ждать, когда вы закончите сельскохозяйственную академию. Попробуем себя в роли агронома сейчас, работая на садовом участке, на школьной грядке, ухаживая за комнатными растениями.
Тематическое планирование
| № | Тема | Количество ч. | Основное содержание (понятийный аппарат) |
| 1 | Введение. Знакомство с программой, целями и задачами курса. Значение правильного выбора профессии для личности. Диагностические тесты «Гожусь ли я в химики?» | 1 | Значение правильного выбора профессии для самореализации личности. Комплекс профессиональных качеств специалиста-химика. |
| 2-3
| Профессия агроном. Питание растений. Чем кормить растения? | 2 | Перечень требований, предъявляемый к профессии агроном. Учреждение профессионального образования, их видовая классификация (начального, среднего, высшего профессионального образования) и профилизация. Микро- и макроэлементы в питании растений, минеральные удобрения, норма и форма внесения удобрений в почву (отчет по итогам экскурсии в лабораторию СПК). |
| 4 | Практическая работа: Приготовление раствора удобрения заданной концентрации из кристаллогидрата. Практическая работа: Приготовление раствора удобрения заданной концентрации методом разбавления. | 1 | Кристаллогидрат. Раствор, массовая доля вещества в растворе (повторение). Расчёт массовых долей веществ в растворах. Приёмы работы с оборудованием и реактивами при получении растворов. |
| 5 | Болезни растений. Как лечить растения? Практическая работа. Приготовление медно-мыльного раствора для борьбы с мучнистой росой. | 1 | Виды вредителей и болезни растений, способы лечения. Пестициды. |
| 6-8 | Профессиональная проба по теме (на выбор): 1. Агрономия ухода за овощными культурами. 2. Агрономия ухода за плодово-ягодными культурами. 3. Агрономия ухода за цветочными культурами. | 3 | Проект «Добрые ли у Вас удобрения?» 1. Модель условий труда агронома. 2. Выбор и испытания удобрения. Народные рецепты плодородия. 3. Оборудование и технология производства раствора удобрения. 4. Практическое использование удобрений. 5. Расчёты получения раствора удобрения. |
| Итого: | 8 |
| |
План отслеживания результатов
Водный контроль. Диагностический тест «Гожусь ли я в химики?», Анкетирование «Что я знаю о профессии агроном?».
Промежуточный контроль. Практические упражнения по решению расчётных задач к практическим заданиям. Наблюдения за выполнением практической работы.
Итоговый контроль. Отчёт об экскурсии. Защита проекта. Анкетирование «Что дал мне этот элективный курс?».
Примерное содержание элективного курса.
Занятие 1. Применить диагностические тесты из первой части.
Занятие 2-3.
«… Но садит он в саду своем
Кусты и овощи цветущи;
Иль диких древ, кривым ножом
Обрезав пни, и плод дающи
Черенья прививает к ним.»
(Г.Р. Державин, «Похвала сельской жизни»)
Воздадим должное сельской жизни, хотя бы такой, какую ведет садовод-любитель, выращивающий на своем участке смородину, морковку и цветы. Садоводство - это прекрасная возможность заняться посильным физическим трудом на свежем воздухе в надежде получить отдачу от своих зеленых питомцев.
Что может лучше помочь городскому жителю избавиться от стрессового состояния и дать разгрузку психике?
Результат успешного садоводства - большой выбор витаминной продукции на семейном столе.
Кому же мало заниматься садоводством любительски, может заняться – профессионально и стать агрономом. Его обязанность знать и приумножать природу, создавать новые сорта культур, защищать растения от вредителей.
Агроном свою деятельность основывает на знаниях биологии, химии, физики, математики, геодезии, метеорологии, механики и других наук.
Он создает условия для жизни растений, регулирует водный, светотепловой и питательные режимы. Изучив состав почв и условия климата, он проектирует технологические приемы обработки почвы. Растения хорошо растут и развиваются, если они обеспечены азотом, фосфором, калием, серой, кальцием, магнием, железом. Им нужен углерод, кислород, водород, и микроэлементы (бор, марганец, медь, молибден, …) Д. И. Менделеев отмечал, что если ничего не делать для пополнения веществ, необходимых растениям, то почва, лишаясь их, с каждым урожаем будет истощаться. Агроном проводит расчеты потребности в удобрениях на основе химических анализов почвы, определяет дозы и сроки, способы внесения удобрений в почву.
В летний период большое внимание уделяется уходу за растениями, проведению наблюдений за их ростом и развитием. Агроном должен знать и проводить мероприятия по защите их от вредителей и болезней. И это только часть обязанностей агронома, но уже видно, что эта профессия многообразна, творческая и оперативная.
Подготовку агрономов с высшим образованием осуществляют высшие сельскохозяйственные учебные заведения, а со средним образованием – сельскохозяйственные техникумы.
Не будем ждать, когда вы закончите сельскохозяйственную академию. Попробуем себя в роли агронома сейчас, работая на садовом участке, на школьной грядке, ухаживая за комнатными растениями.
Чтобы наши зеленые питомцы радовали нас – нужно быть, и сторожем, и врачом, т.е. держать наготове «оружие и лекарство» - различные химические вещества.
Чем кормить и как лечить растения? Какие препараты наиболее эффективны? Как их применить? Ответы на эти вопросы мы будем искать.
Химическим анализом установлено, что в состав растений входят около 70 элементов. Некоторые из них – макроэлементы – необходимые растениям в больших количествах; другие же – микроэлементы – требуются в незначительных количествах.
1. Макроэлементы – С, О, Н, Р, N, S, Mg, K, Ca.
2. Микроэлементы – Fe, Mn, Cu, B, Zn, Mo, Co, и др.
Азот входит в состав белков. При его недостатке задерживается образование зеленой массы, растения плохо растут, их листья становятся бледно – зелеными и даже желтеют.
Фосфор содержится в нуклеиновых кислотах, которые участвуют в окислительно-восстановительных процессах, протекающих в растениях. Фосфор особенно необходим при росте и развитии репродуктивных органов (цветки, плоды).
Калий ускоряет процесс фотосинтеза и содействуют накоплению углеводов (сахара – в сахарной свекле, крахмала – в картофеле). У злаковых он способствует укреплению стебля и тем самым устраняет их полегание.
Железо, марганец, бор и другие микроэлементы играют определенную роль в жизни растений. Так, например, при наличии микроэлемента бора растения лучше усваивают азот, фосфор и калий. Медь, марганец и цинк ускоряют окислительно-восстановительные процессы и тем самым способствуют росту растений. Железо участвует в синтезе хлорофилла.
Растения безмолвны. Они не умеют говорить о своих бедах. Как определить, хватает ли "зеленым господам" сада - растениям - того или иного "блюда" их рациона? Об этом лучше всех расскажут внешние признаки. Научимся их определять. Вовремя и верно определив «болезнь», можно найти верное лечение.
В этой таблице указаны внешние признаки нехватки химических элементов, чем они вызваны, и чем их можно устранить.
| Недостаток элемента | Признак у растения | Чем восполнить |
| Фосфор | Если недостаток, то листья мелкие, темно-зеленые с голубым, а иногда с бронзовым или пурпурным оттенком. Засыхающие листья становятся очень темными, часто даже черного цвета. При остром недостатке начинается преждевременный листопад. Цветение, задерживается, а плоды получаются кислыми. | Суперфосфат Ca(H2PO4)2•2H2O, CaSO4•2H2O (до 20% Р2О5), Двойной суперфосфат Ca(H2PO4)2•H2O (40% Р2О5)
|
| Калий | При недостатке листья сначала становятся голубовато-зелеными, а потом пятнистыми, морщинистыми и закручиваются по краям. Сухие листья осенью опадают не сразу, а еще некоторое время остаются висеть на ветках, как будто подают сигнал бедствия. Плоды мелкие, да и созревают медленно. А когда в почве калия достаточно, растения приобретают морозоустойчивость, хорошо сопротивляются грибковым болезням и засухе. Зато избыточное количество калия в почве сразу даст о себе знать: участок очень быстро зарастает лебедой.
| Калийная селитра KNO3, Хлорид калия KCl (60% К2О), Сульфат калия K2SO4 |
| Магний | При недостатке (магниевом голодании) плохо образуется хлорофилл, поэтому листья приобретают светло-зеленую окраску с красным и фиолетовым оттенком по краям и вдоль жилок; в течение лета они постепенно желтеют, а потом опадают. На старых листьях между жилками появляются светло-зеленые пятна.
| Сульфат магния MgSO4 |
| Кальций | Если нехватка, у растений повреждаются и отмирают верхушечные почки побегов и увядает цветоножка, а это значит, урожая не жди...
| Нитрат кальция Ca(NO3)2 |
| Азот | При недостатке - листва у них бледно-зеленая, рано желтеет и опадает, рост веток слабый. При излишке - рост веток буйный, листья крупные и темно-зеленые, зато цветение и плодоношение слабое, причем плоды рано опадают. | Карбамид (мочевина) CO(NH2)2 (46% N), Нитрат натрия (натриевая селитра) NaNO3, Нитрат аммония (аммиачная селитра) NH4NO3, Сульфат аммония (NH4)2SO4 |
| Марганец | Если марганца в почве слишком мало, растения дают об этом знать: листья их становятся желтоватыми из-за "межжилкового хлороза", который начинается с краев листа и идет к его центру. | Сульфат марганца MnSO4 |
| Цинк | Если цинка в почве недостаточно, растения страдают розеточностью и некрозом (омертвлением) листьев | Сульфат цинка ZnSO4 |
| Бор | при "борном голодании" на растениях появляются пустоцветы, завязи опадают, листья становятся уродливыми: края и верхушки их отмирают, а жилки приобретают красный цвет; отмирают и верхушки почек. | Борная кислота, бура |
| Медь | Недостаток в почве дает о себе знать тем, что на молодых листьях растений появляются коричневые пятна, а кончики их белеют. Верхушки побегов увядают и отмирают. Картофель и помидоры при нехватке меди склонны к заболеванию фитофторой. | Сульфат меди CuSO4 |
Помимо этого, необходимо знать дозы удобрений, которыми подкармливают растения. Как сказал Парацельс: «Все есть яд и ничего не лишено ядовитости, одна лишь доза – делает яд незаметным».
Подкармливать растения можно двумя способами: а) рассыпать сухие удобрения по диаметру корневой системы; б) опрыскивать растения растворенными в воде удобрениями. Остановимся подробнее на последней.
В следующей таблице представлены нормы удобрений необходимых для растений.
| Название удобрений | Необходимая норма в ω% |
| Борная кислота | 0,08 – 0,12 |
| Мочевина | 0,32 – 0,4 |
| Сульфат меди | 0,02 – 0,04 |
| Нитрат аммония | 0,12 – 0,16 |
| Сульфат калия | 0,08 – 0,12 |
| Сульфат магния | 0,12 – 0,16 |
| Сульфат цинка | 0,04 – 0,08 |
| Хлорид калия | 0,04 – 0,08 |
| Двойной суперфосфат | 0,16 – 0,24 |
| Сульфат марганца | 0,04 – 0,08 |
| Сульфат железа (III) | 0,04 – 0,08 |
Занятие 4.
Наши зеленые подопечные очень нуждаются в нашей заботе. Нам уже известно как узнать, чего им не хватает, какими порциями подкармливать. Теперь нужно научиться приготавливать питательные растворы. Рассмотренные выше удобрения, можно купить в специализированных магазинах в расфасованных пакетиках по 10 - 20- граммов.
Некоторые из них существуют в виде кристаллогидратов: ZnSO4•5H2O, Cu SO4•5H2O,
Mn SO4•7H2O, Fe SO4 •7H2O, Mg SO4•2H2O.
Кристаллогидрат – это вещества, в которых молекулы соли образуют связи с молекулами воды.
Практическая работа. Приготовление раствора из кристаллогидрата.
Реактивы и оборудование. Вода, кристаллогидрат, химический стакан, весы, разновесы, шпатель, мерный цилиндр, стеклянная палочка.
Ход работы.
1. Вычислить массу воды и кристаллогидрата необходимые для приготовления 50 г раствора с массовой долей растворенного вещества 5%.
2. Взвесить на весах рассчитанную массу кристаллогидрата и перенести в химический стакан.
3. Отмерить необходимую массу воды и перелить ее в химический стакан с кристаллогидратом, хорошо перемешать с помощью стеклянной палочки.
Согласно таблице, в которой указаны нормы удобрений, они очень малы. Взвешивать на весах такие маленькие количества неудобно, тем более, если удобрение надо использовать только для одного или двух любимых горшечных растений. Надо заметить, что некоторые удобрения при хранении во влажном помещении слеживаются, что затрудняет взвешивании в маленьких количествах. Как поступить? Для решения этой проблемы, поступим следующим образом: растворим все, что есть в пакетике, а затем будем брать порции из концентрированного раствора и разбавлять.
Практическая работа. Приготовление раствора соли методом разбавления более концентрированного.
Реактивы и оборудование. Вода, более концентрированный раствор соли, химический стакан, мерный цилиндр, пипетка, ареометр, стеклянная палочка.
Ход работы.
1. Вычислить массу воды и концентрированного раствора соли (взять ранее приготовленный раствор). При вычислении предлагается применить правило креста или графический метод. (Смотрите приложение.)
2. С помощью ареометра измерить плотность концентрированного раствора соли. Пересчитать массу этого раствора на его объем, измерить и перелить в стакан.
3. Отмерить мерным цилиндром необходимое количество воды, учитывая ее плотность и перелить в химический стакан, перемешать. Перелить в стеклянный пузырек для хранения.
Хранить растворы удобрений лучше всего в стеклянной или пластмассовой посуде (так как в емкостях из алюминия, оцинкованного железа многие из них могут вступать в химическое взаимодействие) темного цвета. Если таковой нет, можно затемнить емкость самостоятельно: обмотать темной бумагой или тканью. Беречь от нагревания и детей. Обязательно сделать надпись.
Умея определять по внешним признакам нехватку элементов у растений и умея приготавливать нужные питательные растворы, можно приступать к опрыскиванию наших зеленных питомцев.
Приложение.
1. Правило креста.
Задача. Для подкормки растений применяют раствор натриевой селитры. Сколько надо взять воды, чтобы и 2% раствора нитрата натрия приготовить 5л 0,2% раствор? (Плотность раствора принять за единицу.)
Решение.
2% - - 0,2 1. Определим количество массовых частей исходных растворов,
0,2% пошедших на приготовление заданного раствора.
0% - - 1,8
2. Числа 0,2 и 1,8 показывают. В каком массовом отношении надо
взять растворы с ω=2% и воды ω=0%. 2% раствора надо взять 0,2
массовые части, а воды 1,8 массовые части.
Занятие 5.
Растения надо не только кормить, но еще лечить от болезней, а также защищать от врагов и непрошеных нахлебников - насекомых-вредителей. Для этого люди с давних пор используют ядохимикаты - медный купорос, золу, а также серу, мыло и керосин.
Медный купорос был среди первых химических веществ, примененных для борьбы с болезнями растений. Купоросное производство в России возникло несколько раньше, чем в Европе, в 1725 году на Лялинском медеплавильном заводе в Пермской губернии. В Европе же первая "купоросная мануфактура" была основана только в 1769 году во французском городе Руане. Медный купорос в то время называли в России синим или "турецким". Однако медеплавильные производства и в Западной Европе были распространены довольно широко.
Считается, что полезные свойства медного купороса как защитника растений были открыты случайно, когда Ирландию постиг голод, вызванный массовым поражением картофеля картофельной гнилью (фитофторой). Наблюдательный репортер провинциальной газеты заметил, что этой болезни не подвержен картофель на полях вблизи медеплавильных заводов, тогда как в других местах он превратился в вонючую гниющую массу.
Позднее химики доказали, что катионы меди Cu2+ успешно "воюют" с грибковыми микроорганизмами, вызывающими многие болезни растений. Небольшие содержания меди в почве для растений полезны, а избыток меди вреден. Как тут не вспомнить слова Парацельса: "Все есть яд и ничто не лишено ядовитости, одна лишь доза делает яд незаметным".
Другой "медный" ядохимикат для защиты растений появился совсем не случайно. Виноградари Франции однажды обратились к химику Жозефу-Луи Прусту, который в то время был уже маститым ученым, с просьбой приготовить какое-нибудь снадобье, чтобы отпугивать воров от плантаций созревающего винограда. Пруст откликнулся на просьбу и вскоре предложил для этой цели использовать смесь растворов сульфата меди и гашеной извести.
"Бордосская смесь" - сине-голубого цвета и выглядит на ягодах винограда точь-в-точь как ядовитая плесень, но не причиняет винограду никакого вреда. Любителей срывать кисти винограда с такой "плесенью" действительно не нашлось.
Прошло немало времени, пока в 1882 году французский химик Миллярде, проезжая мимо виноградников, где особенно часто использовалась смесь Пруста, обратил внимание, что здесь нет даже следов виноградной гнили. Бордосская смесь, или бордосская жидкость (так ее стали теперь называть) в рекордный срок распространилась по всему миру, причем ею стали опрыскивать не только виноград, но и картофель, помидоры, лук, яблони и груши. Чтобы бордосская смесь дольше хранилась, и при опрыскивании соединения меди лучше прилипали к листве растений, к ней добавляли сахар или мыло. Впрок бордосскую смесь не готовят: при хранении взвешенные частицы довольно быстро слипаются и оседают, и она становится непригодной.
Если нет гашеной извести, зато есть сода, то готовят бургундскую смесь. Этот препарат появился позже бордосской смеси, когда в Европе появилась дешевая сода - карбонат натрия.
Очень распространенный "ядохимикат" - древесная зола. В ней содержатся все химические элементы, необходимые растениям: калий, фосфор, кальций, магний, сера и другие. Больше всего в золе кальция (23-40%), калия (6-12%) и фосфора (2-6%). Азота в золе нет, но в присутствии золы возникают благоприятные условия для жизнедеятельности клубеньковых бактерий, которые улучшают азотное питание растений.
Состав золы зависит от породы сгоревшей древесины. Зола от сжигания листьев, ветвей, молодой поросли и деревьев лиственных пород содержит больше полезных растениям веществ, чем зола древесины хвойных пород и старых деревьев. Больше всего калия (в виде карбоната калия) в золе клена и березы, много его в золе подсолнечника и картофельной ботвы.
Но зола - не только удобрение, но и самый доступный и безопасный ядохимикат и издавна служила средством защиты растений от вредителей. Для этого охлажденной золой посыпали ботву на огороде, листву ягодников и плодовых деревьев.
Сера, мыло и керосин
Сера была известна человеку еще в глубокой древности. Гомер в "Одиссее" упоминал о том, как горящей серой окуривали помещения: уже тогда ее использовали против вредных насекомых. Более того, сера считалась средством чудодейственным. Плиний Старший (23-79 гг. н.э.) в "Естественной истории" писал: "Сера применяется для очищения жилищ, так как многие держатся мнения, что запах и горение серы могут предохранить от всяких чародейств и прогнать нечистую силу". При сжигании серы образуется сернистый газ - диоксид серы, который убивает болезнетворные микроорганизмы в воздухе и уничтожает насекомых-паразитов.
Но сера защищала от болезней не только людей, но и растения. Ею окуривали виноградники, когда в них заводились вредители, а серным цветом (тончайшим порошком серы) посыпали листву растений. Самое интересное, что серный цвет успешно применяют для защиты садов и огородов до сих пор. Для этого используется готовая "коллоидная сера" - тончайший порошок, который смешивают с мыльной водой и опрыскивают им растения. Сера как ядохимикат хороша тем, что практически безвредна для человека, не накапливается в организме и легко удаляется с листьев и плодов растений обычной водой. Мыло и керосин тоже с давних времен применяются для борьбы с вредителями сада и огорода. Давно известное - далеко не всегда значит устаревшее. Простые и дешевые препараты, которые любой, даже начинающий, садовод легко приготовит из указанных веществ, успешно защищают растения от многих вредителей и болезней.
Известково-серный отвар хорошо очищает кору деревьев от лишайников и мхов, смертоносен для большинства вредителей; особенно эффективен он летом для борьбы с клещами плодового сада. Отвар готовят следующим образом: в небольшом ведре или кастрюле подходящей емкости смешивают 0,6 кг гашеной извести с 0,5 л горячей воды, а потом добавляют небольшими порциями при перемешивании 0,4 кг порошка серы ("серного цвета"). Затем приливают еще 1,5 л горячей воды, и полученную смесь кипятят в течение четверти часа, закрыв ведро крышкой.
При нагревании смеси серы и гашеной извести (гидроксида кальция) в воде протекает химическая реакция образования пентасульфида кальция CaS5 и тетрасульфида кальция CaS4, придающих отвару красный цвет, и тиосульфата кальция CaS2O3, которые являются ядами для микроорганизмов, вызывающих грибковые заболевания растений, и клещей - вредителей сада.
Известково-серный отвар хранят в плотно закрытых стеклянных или пластмассовых банках, заливая его сверху слоем машинного масла, чтобы приготовленный препарат не портился из-за окисления кислородом воздуха. В алюминиевой, оцинкованной и даже медной посуде отвар хранить нельзя - он разъедает эти металлы. Перед тем как слить отвар на хранение, ему дают остыть, а потом осторожно переливают в банки (особенно надо беречь глаза и руки; лучше всего, если вы наденете резиновые перчатки и защитные очки).
Густой осадок нерастворившейся серы и гашеной извести можно выбросить на компостную кучу. Перед использованием известково-серный отвар разбавляют водой; для опрыскивания берут 1 стакан отвара на ведро воды. Разбавленный водой отвар долго хранить нельзя, на воздухе он разлагается и теряет свои полезные свойства.
Тонкоизмельченную коллоидную серу применяют для лечения растений от мучнистой росы, парши, для защиты от клещей, губящих яблони и смородину. Важно, что коллоидная сера безвредна для человека и животных, более того, прием ее внутрь в умеренных количествах даже считается полезным (способствует рассасыванию нарывов и действует как легкое слабительное). Растения накапливают связанную серу в семенах и листьях в виде белковых веществ (например, в капусте до 0,8% серы в расчете на сухое вещество).
Коллоидная сера бывает в продаже в виде пасты с содержанием серы 35% ("сульфарид") или 70%, и обычно упакована в банки или полиэтиленовые пакеты. Для опрыскивания растений берут 50-100 г такой пасты на ведро воды; получается молочно-белая взвесь (суспензия) серы, которая хорошо уничтожает клещей. Чтобы избавиться от мучнистой росы или парши, достаточно развести в ведре воды 30-80 г 70%-й коллоидной серы. Сульфарид используют для опрыскивания пораженных паршой огурцов, дынь и арбузов в теплицах и в открытом грунте и берут на ведро воды 40-100 г готового препарата.
Если не удается приобрести готовую коллоидную серу, ее можно получить, используя известково-серный отвар (см. выше) и раствор цинкового или железного купороса (сульфатов цинка или железа). Для этого 20 мл известково-серного отвара разбавляют 4,5 л воды и понемногу при постоянном перемешивании добавляют к нему заранее приготовленный раствор купороса (30 г сульфата цинка или 16 г сульфата железа в 4 л воды). Получается взвесь желтоватого или бурого цвета, которая, помимо серы, содержит малорастворимые соли - сульфат кальция и сульфид цинка или железа.
Для уничтожения клещей и мучнистой росы пригодится и "серный цвет" - очень тонкий порошок серы. Все культуры плодового сада, кроме крыжовника, можно опыливать таким порошком во время периода роста.
"Зеленое мыло", которое известно в России еще с 1670 г., варят, используя поташ (карбонат калия) вместо обычно применяемой соды (карбоната натрия), и оно часто получается жидким. Раствор зеленого мыла (200--400 г на ведро воды), имеющий щелочную реакцию, используют для обработки растений, страдающих от нашествия тли и других сосущих вредителей. Такая обработка проводится во время ростового периода не более трех раз; последнее опрыскивание допускается за пять дней до сбора урожая.
Ранней весной, пока не раскрылись почки, яйца и личинки вредителей сада уничтожают керосиново-мыльной эмульсией. Получить такую эмульсию (взвесь мельчайших капелек керосина в воде) можно, если растворить в литре кипятка 40-50 г зеленого мыла или стружки хозяйственного мыла, охладить раствор до 50--60 (С, а потом влить в него при непрерывном перемешивании 2 л керосина. При этом должна получиться однородная смесь, похожая на сметану. Если эмульсия приготовлена правильно, она сохраняется несколько дней, не расслаиваясь на керосин и мыльную воду, и на поверхности ее нет "блесток" керосина. Керосиново-мыльную эмульсию разбавляют вдвое теплой водой и используют для опрыскивания деревьев. Если такую эмульсию собираются применять для опрыскивания "по зеленым листьям", ее надо разбавить гораздо сильнее в 12-13 раз, а саму обработку сада вести в пасмурную, но не дождливую погоду или в вечерние часы и очень мелкими капельками смеси.
Практическая работа. Приготовление медно-мыльного препарата для борьбы с мучнистой росой.
Оборудование и реактивы. Медный купорос, жидкое или хозяйственное мыло, вода, кальцинированная сода, весы, мерная емкость, эмалированное или бак.
Ход работы.
1. В 0,5 л горячей воды растворить 10 г медного купороса.
2. В 10 л теплой воды растворить 100 г мыла. Если вода жесткая, предварительно добавить к ней 50 г кальцинированной соды.
3. Раствор медного купороса тонкой струей при помешивании влить в раствор мыла.
Правильно приготовленная эмульсия должна иметь зеленоватый цвет и не образовывать хлопьев. Препарат готовят перед опрыскиванием.
Примечание. Для выполнения этой работы в классе объемы растворов можно уменьшить в 10 раз.
При отсутствии жидкого мыла можно использовать хозяйственное мыло, которое, натерев на крупной терке, заливают на несколько часов горячей водой, смягченной содой, до растворения. Полученный раствор используют как выше.
Медно-мыльный препарат можно готовить и в более высоких концентрациях (20 – 30 г медного купороса и 200 -300 г мыла на 10 л воды). Этот препарат используют для борьбы с мучнистой росой крыжовника, земляники, роз.
Для обсуждения результатов работы можно предложить ответить на вопросы:
1. Какие реакции протекают в растворе, который приготовили?
2. Почему не желательно готовить этот раствор и тем более хранить его в емкостях из алюминия, оцинкованного железа, эмалированных с поврежденной эмалью?
3. Приготовленный препарат содержит мыло, которое, как известно, является органическим соединением. Но сам препарат по классификации относится к неорганическим пестицидам. Почему?
Занятие 6-8.
Выполнение профессиональной пробы агронома в рамках учебного проекта.
Выберите тему проекта
1. Добрые ли у Вас удобрения?
Задания и вопросы
1. Проанализируйте сложившуюся практику применения удобрений в вашей семье и запишите собранные данные в таблицу.
| Название удобрения |
|
|
|
| Действующее вещество |
|
|
|
| Под какие культуры вносят |
|
|
|
| Даты внесения удобрения |
|
|
|
| Дозы, г/м2 |
|
|
|
| Общий расход |
|
|
|
| Стоимость, р.* |
|
|
|
| Сколько элементов питания внесено: N, К2О |
|
|
|
Какие удобрения (из перечисленных в таблице относят к азотным, фосфорным,
минеральным,органическим?
Найдите в справочной литературе рекомендуемые дозы удобрений для выращиваемых вами культур и сравните их с теми дозами, которые восят в вашей семье. Соответствуют ли применяемые вами дозы нормам?
Опишите, как обычно в вашей семье определяют дозы удобрений для внесения. Если у вас
есть опыт выращивания каких-либо культур с применением удобрений и без них, сравните полуденные результаты.
Вспомните, приходилось ли вам сталкиваться с последствиями избыточного внесения удобрений (минеральных или органических). Опишите эти случаи.
Составьте список использованной литературы и словарик новых слов, которые вы узнали.
2. И битва за урожай.
Задания и вопросы
Выясните, какие пестициды применяют в личном подсобном хозяйстве вашей семьи.
Найдите на упаковках, влистовках-вкладышах или в справочниках информацию о химиче
ском составе применяемых в вашем хозяйстве пестицидов. Определите, к каким группам пестицидов они относятся. Ознакомьтесь со сроками и нормами обработки растений. Рассчитайте,какоеколичествопрепаратов расходует ваша семья ежегодно.Изучите экономический аспект применения пестицидов в хозяйстве вашей семьи.Сколько средств расходует ваша семья на приобретение ядохимикатов ежегодно (последние2—3года)?
Пересчитайте на единицу какой-либо продукции, например на 100 кг картофеля. Есть ли у вас опыт применения растительных препаратов вместо ядохимикатов? Каких именно?
Как вы оцениваете результаты применения растительных препаратов (какие у них преимущества и недостатки по сравнению с ядохимикатами)?
Подумайте и обсудите с родителями, нельзя ли отказаться от применения какого-либо из пестицидов или заменить его растительным препаратом?
Попробуйте объективно оценить, насколько грамотно с точки зрения охраны своего здоровья и окружающей среды используются в вашем хозяйстве ядохимикаты (как они хранятся, как моется опрыскиватель и куда выливается вода после мойки, какими индивидуальными средствами защиты пользуются члены вашей семьи при работе
с пестицидами).
Ответить на вопросы анкеты.
Твое отношение к элективному курсу (выбери вариант ответа):
А) отличный, интересный, захватывающий;
Б) хороший, содержательный, заставляющий работать;
В) нормальный обычный;
Г) скучный, работа без интереса;
Д) Бесполезный, совсем не интересный.
Написать свой ответ.
Какая цель стояла перед тобой.
Какие события, факты, закономерности, формулы, явления, правила ты усвоил на курсе.
Чему новому ты научился на курсе.
Какие были главные мысли на курсе?
Какие ранее полученные знания ты использовал на курсе?
Литература.
1. Пичугина Г.В. «Химия в технологиях сельского хозяйства», Владос, Москва, 2003, с 107 - 108.
2. Попова М.П., Соболева В.П, «Вредители и болезни плодово-ягодных культур», Сельхозгиз,1955, с 22 – 25.
3. «Мир профессий: человек – природа», Москва, «Молодая гвардия», 1988 г, с 21 - 24.
4. Фельдман Ф.Г, Рудзитис Г.Е. «Химия», 9 кл. – М.: Просвещение,1990.
5. Пропалов Н.И. и др, «Сборник дифференцированных задач и упражнений по химии с решениями», Владимир, 2001 г.
6. Интернет – сайт «Алхимик», рассылки Subscribe.ru
Профессиональная проба 3
Растворы в медицине
Тематическое планирование
| № | Тема | Количество ч. | Основное содержание (понятийный аппарат) |
| 1 | Введение. Знакомство с программой, целями и задачами курса. Диагностические тесты «Гожусь ли я в химики?» | 1 | Значение правильного выбора профессии для самореализации личности. Комплекс профессиональных качеств специалиста-химика. |
| 2
| Домашняя аптечка. | 1 | Медицинские препараты, их назначение, классификация. Аптека, аптечка. |
| 3
| Профессия фармацевт, провизор.
| 1
| Устройство и оборудование аптеки, специализация работников аптеки, их профессиональные характеристики и требования. Условия труда (отчет по итогам экскурсии в аптеку). Учреждение профессионального образования, их видовая классификация (начального, среднего, высшего профессионального образования) и профилизация. |
| 4 | Способы выражения концентрации вещества в растворе. | 1 | Раствор, массовая доля вещества в растворе, молярная концентрация (повторение). Расчёт массы вещества, массовой доли и молярной концентрации раствора. |
| 5 | Практическая работа: Приготовление раствора с заданной молярной концентрацией. | 1 | Техника работы с мерными пипетками, колбами, бюретками.
|
| 6-8 | Профессиональная проба по теме (на выбор): 1. Качество витамина «С». 2. Качество пероксида водорода. 3. Качество ацетилсалициловой кислоты.
| 3 | Проект «Моя домашняя аптека»: 1. Модель условий труда фармацевта, провизора. 2. Оптимальная укомплектованность домашней аптеки. 3. Оборудование и технология проверки качества лекарственных препаратов. 4. Количественное определение заданного вещества в лекарственных препаратах, произведённых разными фармацевтическими фабриками, соотнесение его содержания с нормами ГОСТа. 5. Расчёты количественного определения заданного вещества в лекарственных препаратах. |
| Итого: | 8 |
| |
План отслеживания результатов
Водный контроль. Диагностический тест «Гожусь ли я в химики?», Анкетирование «Что я знаю о профессии фармацевт, провизор?».
Промежуточный контроль. Практические упражнения по решению расчётных задач к практическим заданиям. Наблюдения за выполнением практической работы.
Итоговый контроль. Отчёт об экскурсии. Защита проекта. Анкетирование «Что дал мне этот элективный курс?».
Примерное содержание элективного курса.
Занятие 1. Применить диагностические тесты из первой части.
Занятие 2. Недомогание подкрадывается незаметно, а болезнь или травма подстерегают неожиданно. На тот случай, когда потребуется оказать первую медицинскую помощь, надо иметь в домашней аптечке самые необходимые перевязочные средства и лекарства. И здесь Вам поможет знание химии, которая в домашней аптечке не в гостях, а на правах хозяйки.
В домашней аптечке рекомендуется иметь следующие средства (на демонстрационном столе поочередно выставляется весь перечень медикаментов):
| Название лекарства. | Для чего оно необходимо. |
| Валидол, валокордин, корвалол, валериановые капли. | Успокоительное средство при сердцебиении и волнении. |
| 2% раствор борной кислоты, настойка йода, перекись водорода, марганцовка, зеленка, спирт этиловый. | Антисептические средства. |
| Стрептоцидовая мазь, синтомициновая мазь, спиртовой раствор прополиса. | При ожогах, для смазывания небольших ран и трещин кожи. |
| Бесалол (салол с беладонной), фталазол, фестал, активированный уголь. | Болеутоляющие и дезинфицирующие средства при легких пищевых отравлениях |
| Аспирин, анальгин. | Болеутоляющие и жаропонижающие средства |
| Иодинол, фурацилин, настойка календулы | для смазывания или полоскания при болезнях носоглотки. |
| Нафтизин или галазолин, ментоловое масло, каметон (аэрозоль). | При насморке. |
| 2% раствор гидрокарбоната натрия (питьевая сода). | От изжоги, для полоскания горла, для обработки кожи после ожогов кислотой. |
| Нашатырный спирт (раствор аммиака). | При обмороках, угаре, сильном опьянении |
| Свинцовая примочка (раствор ацетата свинца в воде - свинцовый сахар), троксевазин (мазь). | При ушибах. |
| Крахмал, тальк. | Присыпки от опрелостей. |
В аптечке должны быть еще перевязочные средства - бинты, марля, стерильные салфетки, лейкопластырь (в том числе бактерицидный), перцовый пластырь. А также пипетки, термометр, грелка, клизма. А тем, кто часто страдает простудами, можно посоветовать запастись горчичниками и медицинскими банками. Если в аптечке есть еще и пинцет, у вас не будет проблем с удалением заноз.
Среди лекарств, данных нам самой природой, помимо меда и прополиса, хорошо иметь дома минимальный набор сухих трав. Мяту, ромашку, шалфей используют в виде отвара для полоскания горла и при зубной боли, корень валерианы, плоды шиповника и боярышника, траву пустырника - чтобы приготовить успокоительные чаи.
Задание. Выставить растворы и указать содержание в них лекарственных веществ.
Ответ.
| Название | Состав в % | Объем (мл); плотность (г/мл) |
| Валокордин Настойка йода | Фенобарбитал – 2 Этилбромизовалериант – 2 Мятное масло – 0,14 Хмелевое масло – 0,02 Алкоголь – 55 5 | 100 10 |
| Пероксид водорода | 3 | 50 |
| Спирт этиловый | 96 | 100; 0,79 |
| Раствор аммиака | 10 | 50; 0,958 |
| Раствор борной кислоты | 2 | 50 |
| Нафтизин | 0,05 | 10 |
| Раствор гидрокарбоната натрия | 2 | 50 |
Задание. Вычислите массу растворенного лекарственного препарата, содержащегося в данном объеме, принимая во внимание плотность некоторых растворов равной 1г/мл.
Примечание. При решении используется формула для вычисления массовой доли растворенного вещества: ω = (m(в) /V•ρ)•100.
Занятие 3.
Примечание. Это занятие хорошо было бы сочетать с экскурсией в аптеку.
Лекарственные препараты мы покупаем в аптеке (от греческого «хранилище»).
Ее работники приготавливают, контролируют и отпускают населению лекарственные средства, предметы санитарии, гигиены, ухода за больными, перевязочные материалы и т.п.
В аптеках фармацевты (от египетского – «дарующий исцеление») и провизоры (от латинского «заготовляю»). Фармацевты приготовляют лекарства, пишут копии рецептов, отпускают лекарства без рецептов, лекарственные травы, средства ухода за больными, санитарии и гигиены.
Провизоры-технологи принимают рецепты, отпускают и контролируют качество лекарств, приготовляют концентраты и полуфабрикаты, контролируют работу фармацевтов.
В аптеках оборудованы специальные рабочие места, на которых работают провизоры. Эти комнаты похожи на школьную химическую лабораторию – здесь имеется специальные столы с кислотоупорным покрытием, бюретки, весы, пипетки, пипетки, колбы. Пузырьки и т.п.
Ежедневно до начала работы фармацевты, и провизоры-технологи проверяют точность всех весоизмерительных приборов, состояние бюреточной системы. Наличие медикаментов и вспомогательных материалов.
После изготовления лекарства фармацевт в целях самопроверки повторно читает рецепт, проверяет правильность взятых ингредиентов. А провизоры-технологи и провизоры-аналитики контролируют физическими и химическими методами. С одним из них познакомимся далее.
Квалифицированные фармацевты и провизоры владеют знаниями физических закономерностей механических процессов измельчения, осаждения, выветривания. Они хорошо знакомы с химическими реакциями омыления, гидролиза, нейтрализации, досконально разбираются в сути химических процессов, лежащих в основе технологии лекарств. Им необходимы знания ботаники – при изготовлении настоев и отваров из растительного сырья опытный специалист принимает во внимание гистологическое строение тканей растения и в зависимости от них определяет степень измельчения сырья, соотношение длительности и температуры нагревания, выпаривания, охлаждения. Работа фармацевтов и провизоров невозможна без обширных знаний о физико-химических свойствах растворов, суспензий, эмульсий, настоев, капель, мазей, пилюль.
Опытный фармацевт и провизор в работе использует образную память на цвет, запах, вкус. Например: кристаллический йод – серовато-черные с металлическим блеском пластинки или сростки кристаллов характерного запаха; сильный запах перечной мяты и холодящий вкус характерны для бесцветных кристаллов ментола. Неправильное хранение или приготовление лекарства вызывает изменение цвета. Например: под влиянием света и воздуха белый порошок резорцина окрашивается в розовый цвет, а препарат нитрат серебра под действием света темнеет.
В процессе приготовления лекарств постоянно приходится вести расчеты: отмеривать сиропы, масла, глицерин согласно их удельным весам, дозировать жидкости каплями в зависимости от удельного веса жидкости, диаметра отверстия каплемера и т.п.
Помогают в работе и двигательные ощущения. При взвешивании порошков используются весы, но опытные работники безошибочно распределяют приготовленное лекарство на дозы, воспринимая различия в массе при помощи кожных ощущений. Почти неглядя, они быстро и точно выкатывают пилюльные палочки необходимой длины и толщины, осторожно нажимая, получают одинаковые шарообразные кусочки, превращая их ловкими движениями в шарики. Легкими прикосновениями пальцев оценивает фармацевт степень подсыхания пилюль, определяет толщину и равномерность оболочки пилюль.
Фармацевт в работе иногда использует осязание, например: крахмал при растирании в отличие от аскорбиновой кислоты как бы «скрипит».
Фармацевты и провизоры находят себе работу, как в любом большом городе, так и в самом маленьком населенном пункте нашей Родины.
Кто из молодых людей захочет приобрести профессию фармацевта и провизора, в средней школе должен обращать внимание на биологию, химию, основы информатики и вычислительной техники.
Однако работу фармацевта отлично выполнять может не каждый. Она предъявляет особые требования к личности человека.
Фармацевты не имеют право на брак, так как проверить качество лекарства больной, за самым редким исключением, сам не в состоянии. Работник аптеки всегда должен помнить, что ошибки в его работе могут быть трагическими и непоправимыми. Известный древнегреческий врач Сутрута писал, что «лекарство в руках знающего человека уподобляется напитку бессмертия и жизни, в руках невежды – подобно огню и мечу».
Также, повышенные требования к соблюдению чистоты тела, рук, одежды, рабочего места, посуды и приспособлений делают работу фармацевта и провизора совершенно противопоказанной человеку неаккуратному, неряшливому.
Профессию фармацевта можно получить в фармацевтических училищах или фармацевтических отделениях медицинских училищ; провизора – в фармацевтических институтах или на фармацевтических факультетах медицинских институтов.
Занятие 4.
Попробуем выполнить работу провизора. Приготовим лекарственный раствор и проконтролируем его точность.
Для этого необходимо познакомиться с новым способом выражения концентрации, т.е. содержания растворенного вещества в растворе – молярная.
Обозначается СМ. Измеряется в моль/литр. Имеет следующий физический смысл: число молей растворенного вещества в одном литре раствора. Математическое выражение -
СМ = ν/V, где ν – количество растворенного вещества, V – объем (в л) раствора.
Задание. Приготовьте 50 мл 0,5 М раствор хлорида натиря.
Для выполнения этого задания необходимо взвесить на весах 1,45 г хлорида натрия. Перенести с помощью маленькой стеклянной воронки в мерную колбу на 50 мл и разбавить водой до метки, после чего хорошо перемешать.
Задание. Решите задачи:
- определение СМ по известным ν и V;
- определение ν по известным СМ и V;
- определение V по известным СМ и ν;
- приготовление раствора с заданной СМ и V из раствора с известной СМ и V, чтобы вывести формулу: СМ1• V1 = СМ2 •V2;
- * дополнительно, переход из массовой доли в молярную концентрацию и наоборот.
Занятие 5.
Овладев умениями выражать молярную концентрацию вещества растворе, приступим к освоению лабораторного приема установления истинности этой концентрации. Выполнив, таким образом, роль провизора.
Для этого приготовим 0,135 М раствор соляной кислоты, который назначают внутрь при заболеваниях, связанных с недостаточной кислотностью желудочного сока. Затем проконтролируем точность приготовления раствора.
Практическая работа.
Реактивы и оборудование: 13,12 М (или другой точно известной концентрации) раствор соляной кислоты, дистиллированная вода, 2,77 М (или другой точно известной концентрации), индикатор фенолфталеин; бюретка, стеклянная воронка, колба коническая(3 шт), листок белой бумаги, пипетки на 1,5 мл, мерные колбы на 50 мл (2шт).
Ход работы.
1. Сделать расчеты и приготовить 50 мл 0,135 М раствор соляной кислоты.
2. Сделать расчеты и приготовить 50 мл 0,125 М раствор гидроксида натрия.
3. Заполнить бюретку приготовленным раствором гидроксида натрия, установить уровень раствора на нуль по нижнему мениску жидкости.
4. В коническую колбу на 50 мл перенеси с помощью пипетки 10 мл 0,135 М раствор соляной кислоты. добавить 3-4 капли индикатора фенолфталеина и титровать 0,125 М раствором гидроксида натрия, до появления розового окрашивания (цвет определять на фоне белого листа бумаги).
5. После появления неисчезающего малинового окрашивания отметить уровень жидкости в бюретки, пошедшей на титрование. Повторить 3 раза. Для расчетов взять среднее арифметическое значение.
6. По формуле вычислить концентрацию исследуемого раствора – соляной кислоты.
СМ1• V1 = СМ2 •V2. СМ1 – концентрация щелочи; V1- экспериментальный, средгнарифметический объем щелочи; V2 – экспериментальный объем кислоты (10 мл); СМ2 – искомая концентрация соляной кислоты.
7. Сделать выводы о точности приготовления раствора. Оценить работу провизора.
Занятие 6-8.
Выполнение профессиональной пробы фармацевта и провизора в рамках учебного проекта. Количественному определение и приготовление некоторых лекарственных препаратов и витаминов.
Выберите тему проекта.
Количественное определение витамина «С», произведённого разными фармфабриками, соотнести содержание с нормой по ГОСТу.
Количественное определение пероксида водорода, произведённого разными фармфабриками, соотнести содержание с нормой по ГОСТу.
Количественное определение ацетилсалициловой кислоты, произведённого разными фармфабриками, соотнести содержание с нормой по ГОСТу.
Приложение.
Витамин «С» (аскорбиновая кислота), при недостатке которого возникает цинга, получил название от немецкого слова "скорбут" - язвенный рот. Аскорбиновая кислота необходима для образования в организме гормонов - адреналина и норадреналина, а также веществ, обеспечивающих устойчивость к холоду. Витамин «С» способствует работе сердца, увеличивает содержание глюкозы в крови и свертываемость крови, мобилизует защитные силы организма против инфекции, переохлаждения и других неблагоприятных факторов. Если вы ощутили первые признаки простуды, можете сразу начать прием аскорбиновой кислоты по 1-2 г с интервалом в 4 часа. После того, как простудные явления пошли на убыль, продолжайте прием витамина «С» по 1 г 4--5 раз в день, а затем постепенно снижайте дозу до 50-100 мг в сутки. Такой способ профилактики простудных заболеваний рекомендовал известнейший американский ученый и дважды Нобелевский лауреат химик Лайнус Полинг.
Противопоказание к применению витамина «С» только одно - язвенная болезнь желудка с повышенной кислотностью.
Практическая работа.
Реактивы и оборудование: аптечная аскорбиновая кислота (без глюкозы), 5% раствор йода, 1 г крахмала, вода, колбы на 50, 250, 500 мл, пипетки на 10 мл, бюретка, стакан термостойкий химический, электроплитка, стеклянная палочка.
Ход работы.
1. Приготовим раствор крахмала: разведем 1 г его в небольшом количестве холодной воды, выльем в стакан кипятка и прокипятим еще с минуту. Такой раствор пригоден для опытов в течение недели.
2. Возьмите 0,5 г аптечной аскорбиновой кислоты (без глюкозы), растворите ее в 500 мл воды и отберите 25 мл раствора, переместите в колбу на 250 мл.
3. Добавьте примерно 100 мл воды и еще 2-3 мл раствора крахмала.
4. Теперь осторожно, по каплям, прибавляйте из бюретки раствор йода, постоянно взбалтывая содержимое (удобнее делать это в конической колбе). Внимательно следите за цветом раствора. Как только йод окислит всю аскорбиновую кислоту, следующая же его капля, прореагировав с крахмалом, окрасит раствор в синий цвет. Это означает, что наша операция - титрование - закончена.
5. Теперь можно проверить, сколько в таблетке было аскорбиновой кислоты: 1 мл его 5%-ного раствора соответствует 35 мг аскорбиновой кислоты.
Примечание. Можно решить и обратную задачу: зная количество кислоты, определить концентрацию йодной настойки - действительно ли она пятипроцентная?
Этот несложный способ анализа химики часто используют для определения йода и других окислителей. Он называется аскорбинометрией.
Фармацевты и провизоры, как говорилось ранее, должны хорошо владеть навыками химического эксперимента. Закрепим полученные умения определять количественное содержание лекарственных препаратов методом титрования.
Практическая работа. Количественный анализ пероксида водорода.
Реактивы и оборудование: раствор для анализа – 3% пероксида водорода, раствор серной кислоты, разбавленный, раствор марганцовки 0,02М, бюретка, мерная колба на 100 мл, пипетка с делениями на 20 мл, коническая колба для титрования на 100 мл.
Ход работы.
1. 10 мл исследуемого раствора поместить в мерную колбу вместимостью 100мл, довести водой до метки, тщательно перемешать.
2. Порцию 20 мл перенести в колбу для титрования, добавить 5 мл раствора серной кислоты.
3. Титровать 0,02 М раствором перманганата калия до появления слабого розового окрашивания.
4. Содержание пероксида водорода в процентах в растворе вычислить по формуле:
ω (Н2О2)% = V1 •0,93•1,7/V2 , где V1 – объем 0,02М раствора марганцовки, мл; V2 – объем порции взятой для титрования,мл; 0,93•1,7 – поправочный коэффициент.
5. Сделать выводы о содержании пероксида водорода в исследуемом растворе. По требованиям Государственной фармокапеи (свод общегосударственных правил изготовления, проверки, хранения и назначения лекарственных препаратов) содержание препарата должно находится в пределах 2,7% - 3,3%.
Примечание. Учитывая возможности школьной лаборатории и экспериментаторов, погрешность опыта увеличить до 5%.
Практическая работа. Количественный анализ ацетилсалициловой кислоты – аспирина.
Реактивы и оборудование: раствор соляной кислоты, этиловый спирт, раствор 0,1М гидроксида натрия, раствор фенолфталеина, бюретка, химический стакан, пипетка с делениями на 20 мл, коническая колба для титрования, электроплитка.
Ход работы.
1. Аспирин массой 0,05 г поместить в коническую колбу для титрования и растворить в 3 мл этилового спирта, добавить 5 мл воды, 3 капли индикатора фенолфталеина и титровать 0,1М раствором гидроксида натрия до розового окрашивания.
2. Содержание аспирина в процентах в препарате вычисляется по формуле:
ω (аспирин)% = V1 •0,93•1,8/а, где V1 – объем 0,1М раствора гидроксида натрия, мл; а – масса аспирина, взятая для анализа, г; 0,93•1,8 – поправочный коэффициент.
3. Сделать выводы о количественном содержании аспирина.
По требованиям Государственной фармокапеи (свод общегосударственных правил изготовления, проверки, хранения и назначения лекарственных препаратов) аспирина должно быть не менее 99,5%.
Примечание. Учитывая возможности школьной лаборатории и экспериментаторов, погрешность опыта увеличить до 5%.
Ответить на вопросы анкеты.
Твое отношение к элективному курсу (выбери вариант ответа):
А) отличный, интересный, захватывающий;
Б) хороший, содержательный, заставляющий работать;
В) нормальный обычный;
Г) скучный, работа без интереса;
Д) Бесполезный, совсем не интересный.
Написать свой ответ.
Какая цель стояла перед тобой.
Какие события, факты, закономерности, формулы, явления, правила ты усвоил на курсе.
Чему новому ты научился на курсе.
Какие были главные мысли на курсе?
Какие ранее полученные знания ты использовал на курсе?
Литература.
1. О. Ольгин, «Опыты без взрывов», электронный вариант книги, Интернет- сайт: «Алхимик».
2. Н. А. Орлин, «Лабораторный практикум по химии специальных веществ», ВлГУ, Владимир, 2004 г, с 67, 74.
3. «Мир профессий: человек – знаковая система», Москва, «Молодая гвардия», 1988 г, с 203 – 207.
4. Большой Советский Энциклопедический словарь
5. Интернет – сайт «Алхимик», рассылки Subscribe.ru.
Профессиональная проба 4
Растворы в быту
Особенности элективного курса
Профессия красильщика ткани редко сегодня встречается в сельской местности, за исключением областей с традиционно развитым ткацким производством. Одна из задач курса – создание учебной ситуации, позволяющей учащимся увидеть возможности создания малого предприятия полного цикла по выращиванию и обработке растительного сырья (льна), изготовлению готовых изделий.
Тематическое планирование
| № | Тема | Количество ч. | Основное содержание (понятийный аппарат) |
| 1 | Введение. Знакомство с программой, целями и задачами курса. Диагностические тесты «Гожусь ли я в химики?» | 1 | Значение правильного выбора профессии для самореализации личности. Комплекс профессиональных качеств специалиста-химика. |
| 2
| Красители. Технология крашения. Профессия красильщик. | 1 | Классификация красителей. Виды природных красителей. Время сбора сырья, способ приготовления красителей, получаемый цвет. Ткань: очистка от грязи, отбеливание, протравление, крашение, закрепление. Условия крашения: мягкость воды, температура, приготовление растворов – красителя, протравы, закрепителя. Требования, предъявляемые к профессии краситель. Учреждение профессионального образования, их видовая классификация (начального, среднего, высшего профессионального образования) и профилизация |
| 3
| Технология крашения. Подготовка воды для растворов. Практическая работа. Сравнение водопроводной, кипячённой и дистиллированной воды. | 1 | Жёсткость воды, способы её устранения. Техника роботы с лабораторным оборудованием. |
| 4 | Практическая работа. Приготовление красителей. | 1 | Техника работы с лабораторным оборудованием. |
| 5 | Приготовление растворов для закрепления. Практическая работа. Приготовление растворов для квасцевания (закрепления) красителя на ткани. | 1 | Вычисления массовой доли красящего вещества в растворе, массы воды и раствора. Техника работы с лабораторным оборудованием. |
| 6-8 | Профессиональная проба по теме: Окрашивание ткани. | 1 | Проект: «Красильня полотна» 1. Значение природных красителей в жизни современного человека. 2. Способы получения, их приемлемость к местным условиям. 3. Оборудование и специалисты по производству и применению красителей. 4. Технология основных процессов окрашивания ткани. 5. Модель (схема) производства. 6. Практическое получение красителей и их применение. 7. Расчёты получения растворов для крашения ткани. |
| Итого: | 8 |
| |
План отслеживания результатов
Водный контроль. Диагностический тест «Гожусь ли я в химики?», Анкетирование «Что я знаю о профессии красильщика?».
Промежуточный контроль. Практические упражнения по решению расчётных задач к практическим заданиям. Наблюдения за выполнением практических работ.
Итоговый контроль. Защита проекта. Анкетирование «Что дал мне этот элективный курс?».
Примерное содержание элективного курса.
Занятие 1. Применить диагностические тесты из первой части.
Занятие 2.
Как перекрасить футболку или джинсы? Сумеете ли вы окрасить их в красивый и ровный цвет и при этом не повредив материал? Чем красить? В чем красить? Какими должны быть условия этого процесса?
На эти вопросы будем искать ответы.
Начнем с того, какими бывают красители: химические и натуральные. Вы даже себе не представляете, что они лежат у нас под ногами. В следующей таблице представлены виды растений, которыми можно окрашивать, время их сбора и получаемый, в результате крашения, цвет.
| Название растения | Время сбора | Получаемый цвет |
| Береза (листья) | Первая полови на лета | Ярко-желтый, зелено-коричневый |
| Липа (опавшие листья) | Осень | Желтый |
| Клен (опавшие листья) | Осень | Пурпурно-красный |
| Осина (опавшие листья) | Осень | Коричневый, зеленый |
| Ольха (шишки) | Ранняя весна (до появления листьев) | Серый, коричневый, черный |
| Пихта листья | Весна | Зеленый |
| молодые шишки | Весна | Бежевый, коричневый |
| старые шишки | Весна | Желтый |
| Дикая яблоня (опавшие листья) | Осень | Желтый с коричневым оттенком, темно-красный |
| Дикая черешня (спелые плоды) | Лето | Красный, желтый |
| Гранат (кожура) | Осень | Черный с коричневым оттенком |
| Щавель (корни и листья) | Весна | Вишневый |
| Полынь (целое растение) | Лето | Лимонно-желтый |
| Тысячелистник (целое растение) | Первая половина лета | Желтый, зеленый |
| Картофель (свежие стебли и листья) | После уборки урожая | Темно-зеленый |
| Полевой василек (сухие цветы) | Во время цветения | Серо-синий, синий |
Теперь нужно научиться извлекать краситель из этих растений. Для этого сырье: листья, стебли, плоды, корневища, сначала измельчают, а потом выщелачивают – кипятят в дождевой или дистиллированной воде. Примерно 10 г сырья на 100 г воды. Для более полного извлечения красителей к воде добавляют немного поташа – карбоната калия – или соды – карбоната натрия. Извлеченный краситель в виде водного раствора упаривают, чтобы окраска ткани шла более интенсивно, и процеживают.
Каждому, кто занимается крашением, хочется, чтобы цвет оставался ярким как можно дольше. Для достижения этого желания не хватает всего одного – закрепителя краски.
Закрепители, по другому - протрава, бывают нескольких видов: квасцы (двойные соли) – для светлых тонов; купоросы, кислоты, даже рассол от кислой капусты, пепел от березовых дров – для более темных тонов. Их можно купить в хозяйственном магазине, аптеке, или сделать самим.
Для полного завершения дел нам необходима посуда, в которой будет происходить процесс окраски. Как ее подбирать? Во - первых, она должна быть просторной. Во- вторых, эмалированной и не иметь трещин и осколков, чтобы не было примесейпосторонних веществ, которые искажают цвет изделий. К тому же, емкости из алюминия, оцинкованного железа могут вступать в химическое взаимодействие с протравой. Также очень важно знать, из какого волокна соткан материал, из которого сшиты наши футболка или джинсы? Шерсть окрашивают при температуре 50 градусов, а синтетику, при более высокой.
Кратко рассмотрим весь процесс крашения:
1. Материал (вещь) отстирывают от грязи; жиров.
2. Отбеливают, особенно, если будущий цвет светлого тона.
3. Замачивают в мыльно-содовом растворе на 3-4 часа, затем прополаскивают.
4. Помещают в емкость с раствором красителя и протравы, нагревают 4-5 часов. (Иногда протравить ткань можно до, во время или после окрашивания. Это будет влиять на тон цвета.)
5. Поласкают в теплой воде и сушат. Все! Готово!
*Может возникнуть вопрос: зачем это нужно знать?
Посмотрите на эти схемы:
Овцы → шерсть→ изделия из шерсти;
Лен → ткань → изделия из льна
Они отражают «бизнес – план». Окрашивание шерсти и ткани – это только маленький его кусочек. Зная, сегодня как можно устроить свою будущую жизнь - можно поставить цель и добиваться ее достижения. К примеру: кто-то пойдет учиться в сельскохозяйственную академию, будет выращивать овец или лен. Другой – получит диплом инженера и наладит переработку растительного или животного сырья. Следующий – станет химиком-технологом и будет качественно окрашивать ткани из льна и шерсти. А кто-то выучится на дизайнера или модельера, вязальщика или портного и займется изготовлением красивой и удобной одежды. Для управления этой единой цепочкой нужны экономисты, менеджеры, бухгалтеры. Самое главное создадутся новые рабочие места. Могут возродиться многие села и малые города. Дело за Вами. Дерзайте!
И наконец, можно заняться окрашиванием ткани или шерсти для себя, тем самым обновить старую футболку или джинсы.
Профессия красильщика ткани очень древняя. Искусством крашения тканей владели уже в глубокой древности, о чём свидетельствуют, например, образцы тканей, найденные в египетских пирамидах. В прошлом труд красильщика был очень тяжёлый и практически весь процесс крашения осуществлялся вручную. Орудуя мешалкой и полагаясь не на спектральный анализ, а на свой глаз и чутьё, красильщик и не подозревал, что к таинству его ремесла имеют отношение сразу две науки: химия и физика. Исходя из содержания труда, красильщику необходимы знания о правилах ухода за аппаратами. Он должен хорошо знать ассортимент обрабатываемых на производстве тканей и режим их крашения, рецептуры и процесс приготовления используемых им в работе красильных растворов и других химических материалов. Ему также необходимы знания пороков, возникающих на ткани в процессе крашения, а также причин их возникновения и предупреждения. Красильщик , при небольшой переподготовке, может выполнять родственные профессии: отбельщик, мерсеризовщик, аппретурщик, отделочник ткани.
Отбельщик ткани с помощью специальных химических средств отбеливает ткань, придаёт ей белизну. Мерсеризовщик ткани, обрабатывая ткань раствором щёлочи, придаёт ей блеск и увеличивает прочность, а аппретурщик и отделочники придают тканям различные свойства: несминаемости, огнестойкости, водооталкивания.и т.д.
Какими же профессиональными качествами должен обладать красильщик ткани? Исходя из того, что в процессе крашения красильщикам тканей приходится следить за показаниями приборов (на производстве процесс крашения происходит полностью в изолированной среде – в специальных аппаратах), определять пороки ткани и неисправность работающего оборудования, то им необходимы хорошие зрение и слух. Наиболее часто встречающийся брак в работе красильщика – это неравномерность окраски. Таким образом, человек, страдающий нарушением функцией цветоразличия, не может работать выполнять эту работу. Учитывая, что от работы красильщика зависит качество окраски, внешний вид ткани, а значит, успех у потребителя, то ему должны быть присущи такие качества, как добросовестность, чувство долга, аккуратность, внимательность, наблюдательность, дисциплинированность.
Подготовку красильщиков осуществляют профтехучилища. (Просмотр рекламных буклетов).
Занятие 3.
Ознакомившись с технологией окрашивания ткани трудно не заметить, что весь процесс происходит в водном растворе. При этом она должна быть дистиллированная или умягченная, иначе окрашивание неэффективно.
Поэтому необходимо рассмотреть, что такое жесткость воды и способы ее устранения.
Жесткость воды подразделяют на два вида: временную и постоянную.
Временная жесткость обусловлена наличием гидрокарбонатов кальция и магния (Ca(HCO3)2, Mg(HCO3)2 ). Ее можно устранить следующими способами:
1. Кипячением, при этом образуется нерастворимый карбонат кальция или магния:
t
Ca(HCO3)2→ CaCO3↓ + CO2↑+ H2O
2. Действием известкового молока (Ca(OH)2) или соды (Na2CO3), при этом также образуется нерастворимый карбонат кальция или магния:
Ca(HCO3)2 + Ca(OH)2 →2 CaCO3↓+ 2H2O
Ca(HCO3)2 + Na2CO3→ CaCO3↓ +2 NaНCO3
Постоянная жесткость воды, обусловлена присутствием сульфатов и хлоридов кальция и магния ( CaCl2, CaSO4, MgCl2, MgSO4 ). Ее устраняют действием соды (Na2CO3), при этом образуется нерастворимый карбонат кальция или магния:
CaCl2 + Na2CO3→ CaCO3↓ +2 NaCl
CaSO4+ Na2CO3→ CaCO3↓ + Na2SO4
Постоянная и временная жесткость в сумме составляют общую жесткость воды.
Как видно, для более полного умягчения воды следует применять соду.
Лабораторная работа. Сравнение водопроводной, кипяченой и дистиллированной воды.
Материалы и оборудование: образцы воды различной степени жесткости: колодезная, водопроводная, родниковая (в зависимости от условий местности), той же воды, но прокипяченной; дистиллированной или дождевой, снеговой; кусочки хозяйственного мыла размером около 1x1 см, пробирки.
Ход работы:
В три пробирки наливают три образца воды (по 10 мл):
— водопроводная или колодезная;
— та же вода, но прокипяченная;
— дистиллированная вода или дождевая, снеговая.
В каждую пробирку бросить кусочек мыла и сильно встряхивать пробирки, добиваясь как можно более полного растворения мыла (в течение 5 мин периодически встряхивать). Дать отстояться и описать внешний вид полученных растворов: есть, ли осадок в виде хлопьев, много осадка или мало, раствор почт и прозрачный и т.д.
Результаты опыта описать в виде таблицы:
| Образец воды | Характеристика полученного раствора |
| водопроводная кипяченая дистиллированная | Раствор мутный, много осадка в виде хлопьев Раствор мутный, осадка почти нет Раствор почти прозрачный, осадка нет |
Обсуждение результатов опыта. При обсуждении можно задать следующие вопросы:
В какой воде лучше всего растворяется мыло?
Какую воду лучше всего использовать для стирки, мытья волос, умывания?
Как улучшить растворимость мыла в водопроводной воде?
Как можно доказать, что в жесткой воде содержатся растворенные вещества?
Как можно уменьшить их количество воде?
Можно ли считать, что мыло является индикатором жесткости воды?
Работу можно усложнить, растворив в образце дистиллированной воды немного солей Са2+ или Mg2+, проверить после этого растворимость мыла. Индикатором жесткости воды могут служить также соки некоторых ягод: черной смородины, черноплодной рябины, черники.
Занятие 4.
Приступим к практическому осуществлению техники крашения ткани природными красителями.
Практическая работа. Приготовление красителей.
Реактивы и оборудование: весы, эмалированная емкость, ложка, доска для резки, сырье, вода мягкая (кипяченая, дистиллированная), электроплитка, нож.
Ход работы.
1. Измельчение сырья.
2. Измельченное сырье залить холодной водой на 30-40 мин.
3. Смесь прокипятить 30-40 мин.
4. Профильтровать. С осадком повторить действие 3.
5. Оба раствора соединить и упарить на половину.
6. Хранить полученный раствор в стеклянной таре.
Примечание. Время можно уменьшить, чтобы уложиться во временные рамки занятия. Следствием этого будет несколько светлый тон получаемого цвета.
В следующей таблице указана необходимая масса сырья для получения красителя на 100 г ткани.
| Название красителя | Масса сырья |
| Листья березы | 500 |
| Еловые шишки | 1500 |
| Луковая шелуха | 400 |
| Сухая крапива | 500 |
| Опавшие листья дикой яблони | 300 |
| Кора ольхи | 800 |
Занятие 5.
Теперь нужно приготовить растворы для квасцевания
Квасцы - это не те вещества, из которых делается вкусный напиток.
Мы с Иваном молодцы:
Мы нашли в шкафу квасцы.
Что нам киви с ананасом –
Мы теперь наварим квасу.
Квас – не то, что пепси-кола.
Зря мы, что ли, ходим в школу!
Хлеб, квасцы, еще - вода.
И в субботу за «квасец»
Ваню выпорол отец.
Квасцы это двойная соль. Конкретнее, сульфат одновременно двух металлов: одно- и трехвалентного. Например: KAl(SO4)4∙12H2O. Вдобавок, это кристаллогидраты - вещества, имеющие в своем составе кристаллизационную воду.
Квасцевание, травление – это синонимы одного и того же процесса – закрепления цвета на ткани. Как уже известно, существует 3 способа квасцевания, рассмотрим каждый из них.
1 способ: Предварительное квасцевание.
Готовят растворы: - для светлых тонов 0,13% квасцов;
- для средних тонов 0,25 % медного купороса;
- для темных тонов 0,27% железного купороса.
Нагревают их до температуры 250С – 300С. В него опускают предварительно смоченную в воде ткань. Температуру повышают до 850С – 900С и «варят» в течение некоторого времени (1 кг ткани - 1 час) при частом помешивании.
2 способ: Одновременное квасцевание.
Готовят растворы: - для светлых тонов 0,20% квасцов;
- для средних тонов 0,05 % медного купороса;
- для темных тонов 0,025% железного купороса.
Добавляют эти растворы к красителю, туда же кладут предварительно смоченную ткань. Нагревают, помешивая до кипения. Держат на слабом огне некоторое время: 1час -1кг ткани.
3способ: Квасцевание после окрашивания.
Готовят растворы: - для светлых тонов 0,20% квасцов;
- для средних тонов 0,05 % медного купороса;
- для темных тонов 0,025% железного купороса.
Эти растворы добавляют в красильный раствор после окрашивания и продолжают греть еще некоторое время: 1 час – 1 кг ткани. После, оставляют до полного остывания.
Для того чтобы, приготовить растворы для закрепления цвета на ткани, необходимо уметь производить расчеты.
Решение задач на приготовление растворов заданной массы и массовой долей из кристаллогидратов.
Практическая работа. Приготовление растворов для квасцевания.
Реактивы и оборудование: вода дистиллрованная или умягченная, кристаллы: медного и железного купоросов, а также алюмокалиевых квасцов, химический стакан. Весы и рвзновесы, ариометр, стеклянная палочка, мерный цилиндр.
Ход работы.
1. Рассчитать и приготовить растворы: 0,25% медного купороса; 0,27% железного купороса; 0,13% алюмокалиевых квасцов.
2. Измерить с помощью ареометра плотность этих растворов.
3. Рассчитать и приготовить растворы: 25% медного купороса; 27% железного купороса; 13% алюмокалиевых квасцов.
4. Приготовить, методом разбавления, из растворов из п.3 , 0,25% медного купороса; 0,27% железного купороса; 0,13% алюмокалиевых квасцов.
5. Точность приготовления раствора измерить по плотность.
Занятие 6 - 8. Выполнение профессиональной пробы в рамках ученического проекта.
Практическая работа. Крашение ткани.
Реактивы и оборудование: подготовленный раствор красителя и протравы, эмалированная емкость, элетроплитка, кусочек ткани, часы.
Ход работы.
1. Материал (вещь) отстирывают от грязи; жиров.
2. Отбеливают, особенно, если будущий цвет светлого тона.
3. Замачивают в мыльно-содовом растворе на 3-4 часа, затем прополаскивают.
Примечание. Для удобства лучше взять стерильный медицинский бинт или салфетку, тем самым отменяется выполнение пунктов 1-3.
4. Выбрать способ травления.
5. Выбрать и приготовить краситель (для сравнения можно взять ). Начать крашение. Течение процесса можно уменьшить, чтобы уложиться во временные рамки занятия. Это повлияет только на тон цвета.
Ответить на вопросы анкеты.
Твое отношение к элективному курсу (выбери вариант ответа):
А) отличный, интересный, захватывающий;
Б) хороший, содержательный, заставляющий работать;
В) нормальный обычный;
Г) скучный, работа без интереса;
Д) Бесполезный, совсем не интересный.
Написать свой ответ.
Какая цель стояла перед тобой.
Какие события, факты, закономерности, формулы, явления, правила ты усвоил на курсе.
Чему новому ты научился на курсе.
Какие были главные мысли на курсе?
Какие ранее полученные знания ты использовал на курсе?
Литература.
1. Миладинов П., «Полезные советы и рецепты для всех»,М, «Легпромбытиздат», 1990 г.
2. «Внеклассная работа по химии в сельской школе», под ред Андросова В. Г., М, «Просвещение», 1983 г.
3. Интернет – сайт «Алхимик», рассылки Subscribe.ru
4. Фельдман Ф.Г, Рудзитис Г.Е. «Химия», 9 кл. – М.: Просвещение,1990.
5. Пичугина Г.В. «Химия в технологиях сельского хозяйства», владос, Москва, 2003, с 108 - 109.
6. Кульневич С.В, Лакоценина Т.П. Анализ современного урока., Ростов на Дону, Учитель, 2004..
7. «Мир профессий» (Человек – художесивенный образ), А.И.Смирнов,Москва, «Молодая гвардия», 1987.
1 Каган М.С. Человеческая деятельность. - М.: 1974.














