ОГБПОУ «КОЖЕВНИКОВСКИЙ ТЕХНИКУМ АГРОБИЗНЕСА»
Утверждаю
Зам.директора по УМР
Трубарова И.А.
«______»_____2016 г.
ПРОГРАММА ПРОМЕЖУТОЧНОЙ АТТЕСТАЦИИ
по дисциплине «Химия»
Структура: Технический профиль.
Профессия: 35.02.07 Механизация сельского хозяйства
Форма проведения промежуточной аттестации ( дифференцированный зачет)
Цели проведения промежуточной аттестации:
оценка качества усвоения обучающимися всего объёма содержания учебного предмета за учебный год.
определения соответствия уровня и качества знаний, умений, навыков, сформированности компетенций требованиям государственного образовательного стандарта и оценки качества освоения программ по завершении отдельных этапов обучения.
Формы текущего контроля по дисциплине, являющиеся условием допуска обучающегося к промежуточной аттестации:
опрос в письменной и устной формах;
выполнение тестовых заданий;
проектно-исследовательская деятельность;
участие в олимпиадах;
выполнение практических заданий, самостоятельных и контрольных работ.
Ожидаемые результаты обучения.
По результатам обучения по дисциплине обучающийся должен
знать:
уметь:
называть вещества по « тривиальной» или международной номенклатуре;
определять: валентность, степень окисления химических элементов, тип химической связи в соединениях, характер среды в водных растворах неорганических соединений, окислитель и восстановитель;
характеризовать: элементы малых периодов по их положению в ПСХЭ
Д.И. Менделеева;
использовать приобретенные знания и умения в практической деятельности и повседневной жизни
объяснять химические явления, происходящие в природу и на производстве ;
экологически грамотного поведения в окружающей среде;
Контролирующий модуль:
Итоговое тестирование;
Критерии оценки:
Оценка «5»
точно и четко проводит химические рассуждения в устном, письменном изложении;
знает основные формулы по химии ;
безошибочно решает практические задачи и умеет обосновывать суждения и делать выводы.
Безошибочно определяет свойства веществ по их строению.
Оценка «4»
точно и четко проводит химические рассуждения в устном, письменном изложении;
знает основные формулы по химии;
умеет самостоятельно и четко проводить доказательство свойств веществ и вывод формул, допуская незначительные неточности;
правильно решает практические задачи и умеет обосновывать суждения, допуская незначительные неточности.
Оценка «3»
неполно и непоследовательно проводит химические рассуждения в устном, письменном изложении;
нечетко знает основные формулы по химии;
допускает ошибки практических задач и не умеет доказательно обосновывать суждения.
Оценка «2»
не знает основные формулы по химии ;
не умеет решать практические задачи, обосновывать свои суждения.
Перечень наглядных пособий, материалов справочного характера, нормативных документов и натуральных образцов (приборы, инструменты, детали и др.), которые разрешены к использованию на дифференцированном зачёте:
ПСХЭ Д.И. Менделеева,
таблица растворимости,
калькулятор.
Разработал преподаватель Монастырева Г.В..
Рассмотрено на заседании цикловой комиссии ___________
Протокол № от 2016 г.
Председатель цикловой комиссии_____________ Синявина О.И.
Согласовано:
Методист ______________
Тестовые задания по химии
Задания
1.К переходным элементам относится:
А) кремний;
В) азот;
С) марганец;
D) цезий.
2. Попарно взаимодействуют простые вещества, образованные элементами:
А) №16 и №8;
В) №13 и №21;
С) №15 и №7;
D) все ответы верны
3. Самое сильное основание:
А) Mg(OH)2
В) Al(OH)3
С) NaOH
D) Ba(OH)2
4. Отдача электронов происходит в случае:
А) C4+ → C2+
В) Cl20 →2Cl-
С) 2H+ →Н20
D) Al0 →Al+3
5. Для смещения химического равновесия обратимой реакции:2HgO↔ 2Hg+O2-Q
В сторону образования Hg и O2 необходимо:
А) Повысить температуру и давление;
В) Понизить температуру и давление;
С) Повысить температуру и понизить давление;
D) Реакция проходит при н.у.
6. Качественным реактивом на хлорид-ион является:
А) AgNO3
В) KOH
С) BaCl2
D) H2SO4
7.При взаимодействии бромида с нитратом серебра:
А) выделится газ;
В) не произойдёт изменений;
С) выпадет осадок;
D) образуется вода.
8. Отметьте утверждение, в котором речь идет об углероде как химическом элементе:
А) имеет несколько аллотропных модификаций
В) горит в кислороде
С) взаимодействует с металлами
D) твердое вещество
9. Сера - восстановитель в химической реакции:
А) К+S→
В) S+O2→
С) S+Mg→
D) S+H2→
10. Цепочке превращений S-2→ S0→S+4 →S+6 соответствует схема:
А) H2S→ S→ SO2→ SO3
В) Na2S→ S→H2SO4→ Na2SO4
С) NH3→ S→ H2SO3→ Na2SO3
D) N2O→ S→ SO3→ Na2SO4
11.Для изготовления типографских красок получают сажу реакцией:
А) 2CH4+O2→ CO2+2H2O
В) CH4+ CO2→2 CO+2H2
С) CH4+H2O900ᶿ→ CO+3H2
D) CH4 →C+2H2
12.Какая частица имеет электронную конфигурацию 2s22p5?
А) Na
В) Mg
С) Zn
D) F
13. Химическое количество углекислого газа , который выделился в результате реакции
C aCO3 t CaO + CO2, составляет 0,5 моль. Масса (г) взятого для разложения карбоната кальция равна:
aCO3 t CaO + CO2, составляет 0,5 моль. Масса (г) взятого для разложения карбоната кальция равна:
А) 25,5
В) 5
С) 50
D) 500
14. B схеме реакции вещество А: CH4+A → CO2+…
CO
O2
Na2O
все ответы верны
15.Массовые доли углерода и хлора в молекуле вещества соответственно равны- 10,1% и 89,9%. Относительная плотность по воздуху 8,173. Формула вещества:
А) СCl4
В) С2Cl6
С) С2Cl4
D) С3Cl4.
Тестовые задания по химии
1.Щелочноземельные металлы расположены:
А) в первой половине Периодической таблицы;
В) в первом периоде Периодической таблицы;
С) в главной подгруппе первой группе Периодической таблицы;
D) в главной подгруппе второй группе Периодической таблицы;
2. В едком натре ковалентными полярными являются связи:
А) между водородом и кислородом;
В) между натрием и кислородом;
С) между натрием и водородом;
D) все связи;
3. Гидриды щелочных металлов представляют собой при обычных условиях:
А) газообразные вещества;
В) жидкости;
С) твёрдые тела с ковалентным типом химической связи;
D) твёрдые тела с ионным типом химической связи;
4. Цинк реагирует с кислородом:
А) при обычной температуре с образованием оксида цинка(I);
В) при нагревании с образованием оксида цинка(I)
С) при обычной температуре с образованием оксида цинка(II)
D) при нагревании с образованием оксида цинка(II)
5. Выберите правильное утверждение относительно ионов.
А) Ионы -нейтральные частицы.
В) Ионы образуются из атомов вследствие присоединения или отдачи электронов.
С) Все ионы имеют положительные заряды.
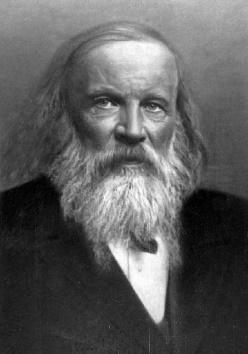 D) Все ионы имеют отрицательные заряды.
D) Все ионы имеют отрицательные заряды.
6. На портрете изображен великий русский учёный-химик:
А) А.М. Бутлеров
В) Н.Н. Зинин
С) Д.И. Менделеев
D) К.Ф. Венцель
7.Аммофос получают по схеме:
А) NH3+HNO3→NH4NO3
В) 3NH3+H3PO4 →(NH4)3PO4
С) 2NH3+H3PO4 →(NH4)2HPO4
D) 2NH3+H2SO4 →(NH4)2SO4
8. Определите, сколько орбиталей имеется на втором энергетическом уровне?
А) 1
В) 3
С) 5
D) 4
9. Оксид кальция массой 2,8г растворили в 200г соляной кислоты. Рассчитайте массовую долю хлорида кальция в полученном растворе:
А) 2,74%;
В) 1,80%;
С) 15,8 %;
D) 19,6%.
10. В состав железной руды входят магнетит Fe3O4 (массовая доля 65%) и другие вещества, которые не содержат железо. Вычислите массу железа, которую можно получить из руды 800 кг.
А) 229,2 кг
В) 921 кг
С) 376,6 кг
D) 412,9 кг
11.Образец сидерита, который содержит FeCO3 ,содержит 40% железа. Вычислите, сколько процентов FeCO3 содержится в этом образце:
А) 82,86%
В) 46,8%
С) 6,808%
D) 5%
12. Для борьбы с мучнистой росой крыжовника можно применять водные растворы (Na2CO3 Na2HPO4) , в которых действующим началом являются ионы натрия. Если используют кальцинированную соду, готовят раствор 0,5%-ной концентрации. Раствор какой концентрации надо приготовить из Na2HPO4 , чтобы его активность соответствовала 0,5%-му раствору Na2CO3
А) 11,6%,
В) 0, 16%
С) 0,67%
D) 21,6%
13.Для обеззараживания складов, погребов, теплиц и парников можно применять окуривание сернистым газом-SO2. В обрабатываемом помещении подожгли серу и закрыли его на 1-2 суток. Какое количество серы надо сжечь для обработки погреба 2*3*2м, если рекомендуемая концентрация этого фумиганта 1:30 (СМЕСИ ВОЗДУХА И SO2)?
А) 571г
В) 757г
С) 57,7г
D) 175г
14. В приведенной ниже схеме уравнений трёх последовательных превращений:
CaO x→ Ca(OH)2 y→CaCO3z→ Ca(NO3)2
X, Y, Z это-
А) X - NaOH, Y - CO2, Z - HNO3.
В) X - Н2,Y - CO2, Z - HNO3.
С) X - H2O,Y - CO2, Z - HNO3.
D) X - H2, Y - CO2, Z - HNO3.
15. В данном уравнении реакции NaOH + Zn(OH)2 →? + Na2ZnO2 вместо вопроса надо вписать соединение.
А) H2O
В) H2↑
С) H2O2
D) H2↓





 aCO3 t CaO + CO2, составляет 0,5 моль. Масса (г) взятого для разложения карбоната кальция равна:
aCO3 t CaO + CO2, составляет 0,5 моль. Масса (г) взятого для разложения карбоната кальция равна: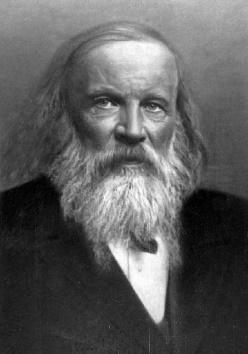 D) Все ионы имеют отрицательные заряды.
D) Все ионы имеют отрицательные заряды.









