Рабочий лист по теме «Растворы»
Цель урока: к концу урока учащиеся будут знать классификацию растворов, понятие «растворимость» веществ в воде, понятие «кристаллогидраты», зависимость растворимости от природы вещества, температуры и давления, понимать процесс растворение как физико-химический процесс с тепловым эффектом; научатся решать задачи на понятие «растворимость» и массовая доля вещества в растворе.
Самостоятельная работа материалом урока
1. Вставьте пропущенные или подчеркните нужные слова в приведенном тексте.
1.1. Растворы - это (гомогенные/неоднородные) системы…………………. состава. Растворы бывают………………и разбавленные, насыщенные и …………………
Насыщенный раствор можно сделать ненасыщенным (добавлением вещества/испарением воды/добавлением воды). Раствор = ……………….. + растворимое вещество.
1.2. Различают две стороны процесса растворения:………………………………..
и ……………………. Последняя состоит в явлении гидратации молекул или ионов растворенного вещества. Если тепловой эффект физического процесса растворения (по модулю) меньше теплового эффекта химического процесса растворения, то при растворении вещества тепло………………. т. е. процесс растворения является (эндотермическим/экзотермическим).
Q растворения = - Q……………….+ Q………………….
Кристаллогидраты - это продукты……………..воды к неорганическим или органическим веществам, например……………………………………………………………………………………
1.3. Распредели растворы: суспензия от кашля, крем для рук, сталь, туман, воздух, бензин, духи, желудочный сок, молоко, настойка пустырника на:
| Гомогенные растворы | Гетерогенные растворы |
|
|
|
2. Используя значок (+), установите достоверность утверждений
| Утверждение
| Верно
| Неверно
|
| 1. Насыщенный раствор СаСО3 является разбавленным, а насыщенный раствор КОН концентрированным |
|
|
| 2. Растворимость большинства твердых веществ при повышении температуры возрастает |
|
|
| 3. Перемешивая раствор, можно увеличить растворимость хлорида калия |
|
|
| 4. Если в насыщенный раствор КCl добавить небольшое количество KNO3, будет наблюдаться выпадение осадка |
|
|
| 5. При растворении в воде концентрированных кислот и твердых щелочей теплота обычно выделяется |
|
|
3. Даны вещества NH3 H2SO4 AgNO3 H2S CaSO4 С2Н5OH Mg(OH)2 КСІ СО2 CH3COOH NaOH . Выпишите отдельно формулы веществ, для которых справедливы утверждения, приведенные в таблице.
| Утверждение | Формулы веществ |
-
Насыщенные водные растворы будут концентрированными |
|
-
Насыщенные водные растворы будут разбавленными |
|
-
Нельзя получить насыщенный раствор |
|
-
Растворимость с повышением температуры уменьшается, а с повышением давления существенно увеличивается |
|
-
При увеличении температуры растворимость веществ увеличивается |
|
4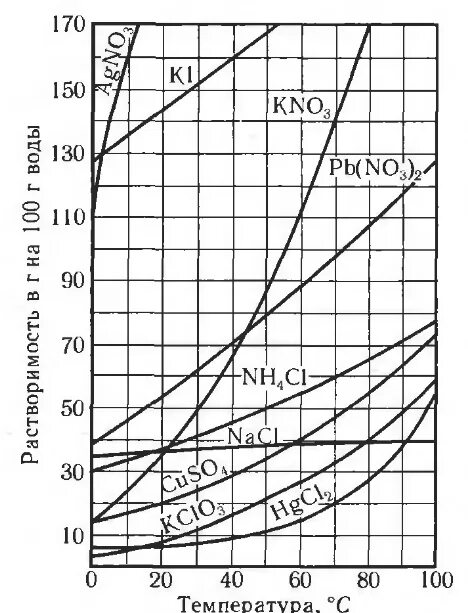 . На графике приведены две кривые, описывающие зависимость растворимости солей от температуры. Используя график, выполните следующие задания.
. На графике приведены две кривые, описывающие зависимость растворимости солей от температуры. Используя график, выполните следующие задания.
4.1. Рассчитайте массу осадка, который выделится из насыщенного при 80°С раствора KNO3 (раствор содержит 150 г воды) при его охлаждении до 60°C.
Ответ:
4.2 Массовая доля KNO3 в насыщенном растворе при 20° С равна 24%. Рассчитайте растворимость соли при данной температуре и сравните с графиком. 
Ответ:
4.3. Найдите массу осадка, который выделится из насыщенного 80°С раствора Pb(NO3)2 массой 300 г при его охлаждении до 40°C
Ответ:
4.4. Рассчитайте массовую долю (%) насыщенного при 40°C раствора Pb(NO3)2..
Ответ:
4.5. Используя графиком, ответьте на вопрос: можно ли приготовить при 20° С раствор Pb(NO3)2 массой 220 г ( плотностью 1.1г/см3) с молярной концентрацией соли 0,62 моль/дм3?
Ответ:
5. Объясните, почему рыбы более приспособлены к жизни в холодной воде?







 . На графике приведены две кривые, описывающие зависимость растворимости солей от температуры. Используя график, выполните следующие задания.
. На графике приведены две кривые, описывающие зависимость растворимости солей от температуры. Используя график, выполните следующие задания.


















