МУНИЦИПАЛЬНОЕ БЮДЖЕТНОЕ ОБЩЕОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
«ГИМНАЗИЯ №7»
«РАЗБОР ЗАДАНИЙ ВЫСОКОГО УРОВНЯ СЛОЖНОСТИ С ПОМОЩЬЮ ХИМИЧЕСКОГО ЭКСПЕРИМЕНТА»
(Подготовка к ЕГЭ, задания №29, №30 и №31)
Составитель: учитель химии,
Рабаданова Марьян Ражабалиевна
Махачкала 2023
Цель урока:
Обобщить и систематизировать знания за курс неорганической и общей химии, характеристике свойств неорганических веществ.
Выявить уровень подготовки учащихся к итоговой аттестации.
Выявить пробелы в знаниях учащихся.
Закрепить знания в ходе самостоятельной экспериментальной работы.
Оборудование и реактивы: компьютерная презентация, таблица Д.И.Менделеева, таблица растворимости, электрохимический ряд напряжений металлов, латки с необходимым для эксперимента перечнем реактивов.
Ход урока
Приветствие.
Эпиграфом к нашему уроку я взяла слова Дмитрия Ивановича Менделеева «Всё учение химии состоит в учении о свойствах элементов — цель и задача — превратить один в другой — это будет дальше».
Что лежит у вас на партах? Имея всё это, как вы думаете, чем мы будем сегодня заниматься? А какие именно задания ЕГЭ по химии предполагают эксперимент с имеющимися веществами? Как вы определите тему нашего занятия.
Верно, тема нашего урока «Решение заданий высокого уровня сложности с помощью химического эксперимента».
А какую цель вы ставите перед собой на этом занятии?
В блок «неорганическая химия», второй части ЕГЭ, входят задания 30 и 31. Еще наряду с вопросом 30 повторим вопрос 29 тоже, котрорый включает в себя такие понятия как: «окислитель, восстановитель, метод электронного баланса». Они высокого уровня сложности. Решив их правильно вы можете получить 8 первичных балла. Эти задания на понимание взаимосвязи неорганических веществ. От вас дорогие школьники требуется сделать мысленный эксперимент. Но, я не устаю вам повторять, что мысленный эксперимент возможен только тогда, когда вы научились делать этот эксперимент практически. Без наших химических опытов, где вы практически учите цвета, запахи веществ, мысленный эксперимент сделать только выучив цвета осадков очень сложно.
На предыдущих уроках мы говорили об основных классах неорганических веществ.
Актуализация знаний.
Фронтальная беседа по вопросам:
Какие реакции называют окислитель-восстановительными?
Что такое окислитель и восстановитель?
Перечислите основные окислители и восстановители?
Какие классы неорганических веществ вы знаете?
2. На что классифицируются основные классы неорганических соединений?
3. Какими химическими свойствами они обладают?
4. Какие классы неорганических веществ называют солями?
5. Перечислите основные свойства оксидов, кислот, оснований, солей.
6. Как называют реакцию взаимодействия кислоты с основанием? Почему?
7. Почему азотная и серная (конц.) кислоты ведут себя в реакциях с металлами иначе, чем, например, соляная?
Для начала вспомним теорию, которая необходима для разбора заданий №29-№31 ЕГЭ.
У вас на партах есть листочки с заданиями. Прочитайте внимательно условие заданий.
Итак, давайте приступим. Но в начале вспомним правила техники безопасности. Вспомните правила технике безопасности при работе со спиртовкой, с растворами кислот и щелочей.
Добротин Д.Ю. 30 вариантов. Вариант 7.
Задание 1 для разбора
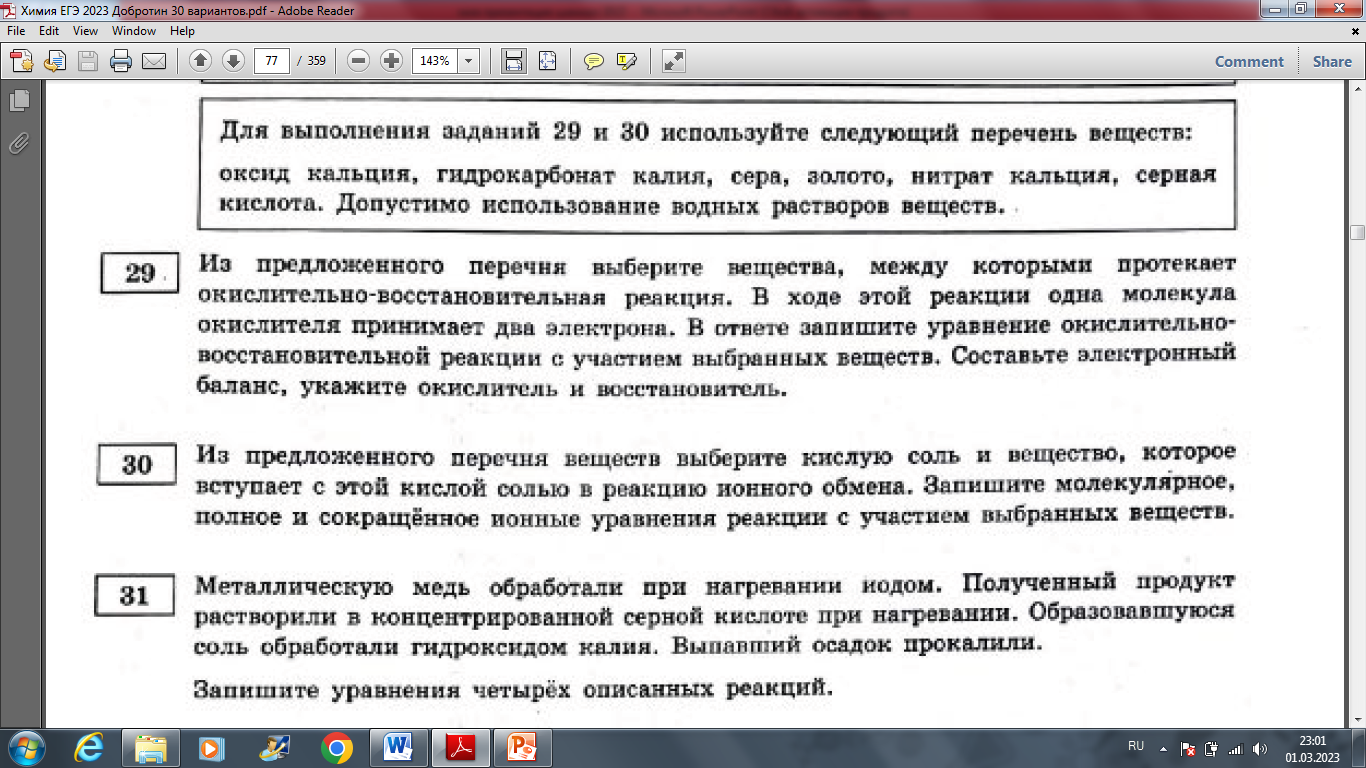
Анализ и решение.
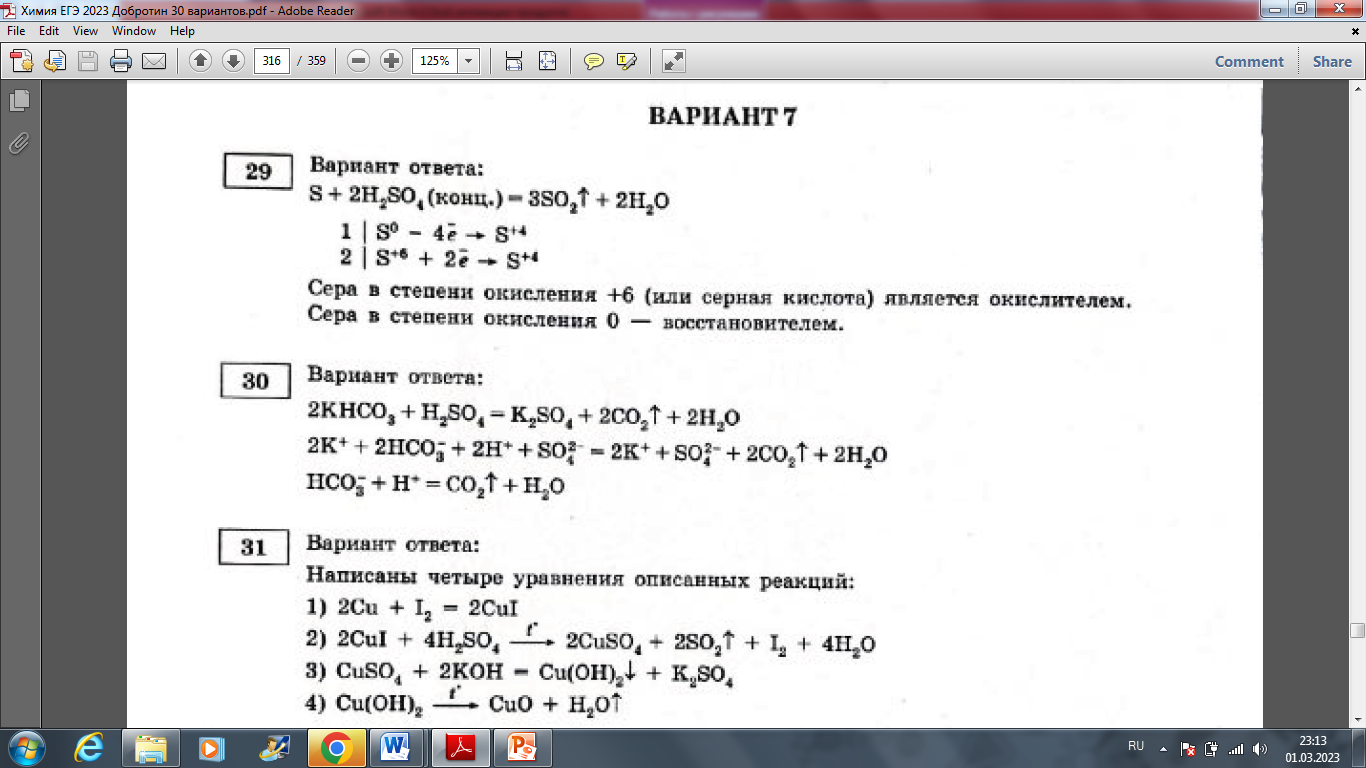
Закрепление
Задание 2 для разбора
Прочитайте внимательно задание. Приступайте к выполнению опытов.
| Творожистый осадок белого цвета, полученный при взаимодействии раствора неизвестного вещества с нитратом серебра, отфильтровали. К фильтрату добавили раствор едкого кали. Выпавший осадок бурого цвета отделили и прокалили остаток смешали с поташом и нагрели до плавления. Составьте уравнения четырёх описанных реакций. |
Решение:
1) FeCl3 + 3AgNO3 = 3AgCl + Fe(NO3)3
2) Fe(NO3)3 + 3KOH = Fe(OH)3 + 3KNO3
3) 2Fe(OH)3 = Fe2O3 + 3H2O
4) Fe2O3 + К2СО3= 2КFeO2 + СО2
Задание 3 (если позволяет время урока)
Дихромат аммония разложили при нагревании. Твёрдый продукт разложения растворили в серной кислоте. К полученному раствору прилилирастворгидрок-сиданатрия до выпадения осадка. При дальнейшем приливании гидроксида натрия к осадку, он растворился.
Анализ и решение
1) (NH4)2Cr2O7= Cr2O3 + N2 + 4H2O
2) Cr2O3 + 3H2SO4= Cr2(SO4)3+ 3H2O
3) Cr2(SO4)3+ 6NaOH= 3Na2SO4+ 2Cr(OH)3
4) Cr(OH)3 + NaOH = Na[Cr(OH)4
ЗАКЛЮЧЕНИЕ
«Жить надо, чтобы выполнить задачу природы.… Сумей быть полезен, нужен и дорог другим. Так жил или так хотел жить я сам.… Надо быть деятельным и бережливым, в то же время смелым и благородным… Удовольствие пролетит – оно себе, труд оставит след долгой радости – он другим. Ученье – себе, плод ученья – другим. Другого смысла в ученье нет, иначе его бы не было…»
Д.И. Менделеев.


















