Просмотр содержимого документа
«Разработка урока по теме "Металлы"(11 класс)»
Конспект урока по теме: «Металлы»
Человек не может обойтись без металлов…
Если бы не было металлов, люди влачили
бы самую омерзительную и жалкую жизнь
среди диких зверей…
Георг Агрикола, 1556 г
Вопросы к классу:
Давайте с вами вспомним особенности строения атомов металлов и какими свойствами (окислительными или восстановительными) они обладают (Особенностью строения атомов металлов является небольшое число электронов на внешнем энергетическом уровне (от одного до трех). Следовательно, атомы металлов в отличие от атомов неметаллов легко отдают наружные электроны, т.е. являются сильными восстановителями, они проявляют только положительные степени окисления).
Как меняются восстановительные свойства металлов в А группе и периоде? (в группе сверху вниз R атома увеличивается, следовательно, способность притягивать электроны меньше, а металлические свойства усиливаются. В периоде R атома уменьшается, следовательно, способность притягивать к себе электроны выше и металлические свойства ослабевают. Таким образом, наибольшие металлические свойства выражены у щелочных металлов, у которых радиус наибольший)
Каков тип кристаллической решетки и тип связи в металлах? Перечислите общие физические свойства металлов (металлический блеск, пластичность, ковкость, электро- и теплопроводность, цвет – серебристо-белый или серый).
Мы с вами вспомнили физические свойства металлов, а также их строение. Теперь нужно узнать с какими веществами могут вступать в реакцию металлы? Каким должно быть их практическое значение?
Перед вами находится схема химических свойств металлов, давайте рассмотрим её.
Металлы




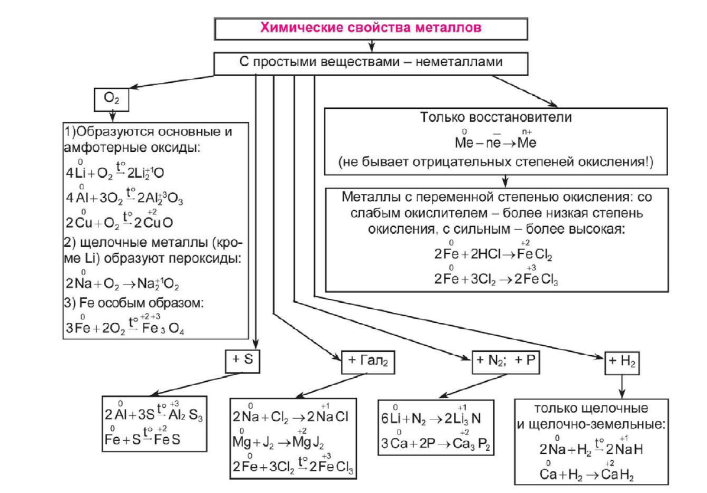
Обратите внимание! Кислород – активнейший неметалл – играет такую важную роль в химии, что Д.И. Менделеев предусмотрел для высших оксидов специальную графу в своей таблице.
Давайте посмотрим на нашу шкалу и проанализируем какие же высшие оксиды и при какой степени окисления образуются.
| +7 | Mn2O7 | HMnO4 |
| +6 | MnO3 | H2MnO4 |
|
|
|
|
|
|
|
|
| +3 | Mn2O3 | H2MnO3 |
| +2 | MnO | Mn(OH)2 |
| +1 |
|
|
| 0 | Mn |
|
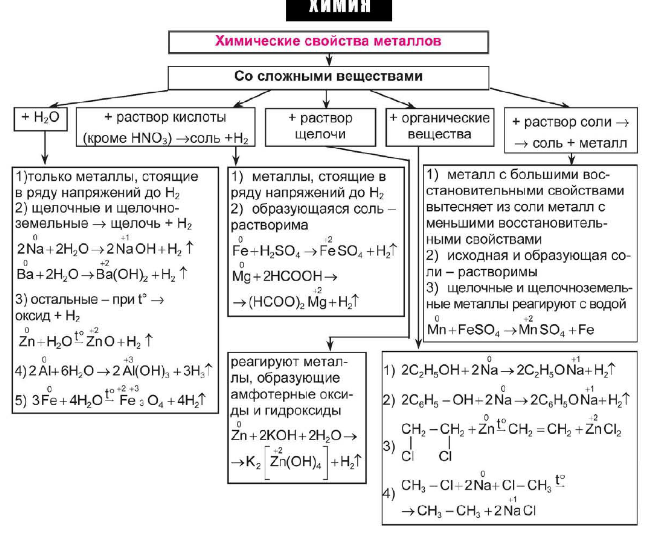
ДО. Давайте с вами посмотрим, насколько бурно реагируют щелочные металлы с водой (реакция натрия с водой).
Мы с вами рассмотрели химические свойства металлов, можете ли вы исходя из этого сказать, какое практическое применение они находят?
(Металлы широко используются человеком в технике, медицине, различных отраслях промышленности, но при использовании надо учитывать их свойства: взаимодействие с кислородом, водой, различными солями).
Д/з:  §20 упр.5 + сообщение для мальчиков: «Металлы и война», сообщение для девочек «Интересные факты о золоте и серебре».
§20 упр.5 + сообщение для мальчиков: «Металлы и война», сообщение для девочек «Интересные факты о золоте и серебре».
В заключении урока, хотелось бы немного заглянуть в историю.
В древности и в Средние века считали, что существует только семь металлов: золото, серебро, медь, олово, свинец, железо, ртуть. В 1789 г. в список простых веществ были включены все известные тогда семнадцать металлов (Sb, Ag, As, Bi, Co, Cu, Sn, Fe, Mn, Hg, Mo, Ni, Au, Pt, Pb, W, Zn). В первой половине 19 века были открыты платиновые металлы, путем электролиза получены некоторые щелочные, щелочноземельные и редкоземельные металлы. В конце 19 столетия начались поиски радиоактивных элементов. С помощью ядерных реакций начиная с середины 20 века были получены не существующие в природе радиоактивные элементы.
А как проходит процесс получения химических элементов, в частности металлов, мы с вами изучим на следующем занятии.






















