Урок Решение графических задач «Газовые законы» 10 класс
Тип урока: Урок-практикум.
Цель урока: Привить умение применять законы изопроцессов, закон Менделлева-Клапейрона, уравнение состояния идеального газа, первый закон термодинамики при решении комбинированных графических задач
Задачи урока:
Образовательные: повторить виды изопроцессов, законы изопроцессов, закон Менделлева-Клапейрона, уравнение состояния идеального газа, первый закон термодинамики, привить умение применять законы к чтению графиков изопроцессов
Развивающие: развивать внимание и речь, совершенствовать навыки самостоятельной работы.
Воспитательные формировать целостное представление обучающихся о мире (природе, обществе и самом себе), о роли и месте физики в системе наук.
Оборудование: компьютер учителя, мультимедийный проектор,
Ход урока 1. Орг.момент 2. Организация внимания учащихся. Формулировка темы и целей урока
….. мы вспомним виды изопроцессов, законы изопроцессов, закон Менделлева-Клапейрона, уравнение состояния идеального газа и научимся применять эти законы при решении задач
3. Актуализация опорных знаний
Фронтальный опрос:
-Что называют изопроцессом?
-Какие изопроцессы различают?
-Опишите кратко каждый изопроцесс
-Покажите, какой вид имеет изотерма в координатах PV
- Покажите, какой вид имеет изотерма в координатах VT
- Покажите, какой вид имеет изобара в координатах VT
- Покажите, какой вид имеет изобара в координатах PT
- Покажите, какой вид имеет изохора в координатах PT
- Покажите, какой вид имеет изохора в координатах PV
- Запишите уравнение состояния идеального газа
-Запишите закон Менделлева-Клапейрона
-Запишите первый закон термодинамики
4. Решение задач
Задача 1. Постоянное количество одноатомного идеального газа участвует в процессе, график которого изображён на рисунке в координатах р-n, где р — давление газа, n — его концентрация. Определите, получает газ теплоту или отдаёт в процессах 1-2 и 2-3. Ответ поясните, опираясь на законы молекулярной физики и термодинамики.
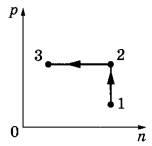
Решение.
1. По первому закону термодинамики количество теплоты, которое газ получает, равно сумме изменения его внутренней энергии ∆U и работы газа A: Q = ∆U + A. Концентрация газа n = N/V, где N — число молекул газа, V — его объём. Для идеального одноатомного газа внутренняя энергия  (где v — количество моль газа). По условию задачи N = const.
(где v — количество моль газа). По условию задачи N = const.
2. Так как на участке 1-2 концентрация газа не изменяется, его объём постоянен (изохорный процесс), значит, работа газа А=0. В этом процессе давление газа растёт, согласно закону Шарля температура газа также растёт, т.е. его внутренняя энергия увеличивается: ∆U 0. Значит, Q 0, и газ получает тепло.
3. На участке 2-3 концентрация газа уменьшается, значит, его объём увеличивается и работа газа положительна: А 0. Давление газа постоянно (изобарный процесс), по закону Гей-Люссака температура газа также увеличивается. Поэтому ∆U 0. По первому закону термодинамики Q 0. В этом процессе газ получает тепло.
Задача 2.На графике представлена зависимость давления неизменной массы идеального газа от его плотности. Опишите, как изменяются в зависимости от плотности температура и объём газа в процессах 1-2 и 2-3.
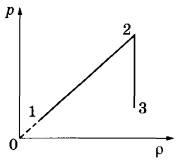
1. Плотность газа  , где m — масса газа, V — его объём. В соответствии
, где m — масса газа, V — его объём. В соответствии
с уравнением Менделеева-Клапейрона  . На участке 1-2 давление изменяется пропорционально плотности газа:
. На участке 1-2 давление изменяется пропорционально плотности газа:  . Следовательно, в этом процессе температура газа не изменяется. Поскольку плотность газа на этом участке возрастает, объём газа уменьшается.
. Следовательно, в этом процессе температура газа не изменяется. Поскольку плотность газа на этом участке возрастает, объём газа уменьшается.
2. В процессе 23 плотность газа постоянна, следовательно, объём газа не меняется. Давление газа при этом уменьшается, следовательно, согласно уравнению Менделеева-Клапейрона температура газа также уменьшается.
Задача 3. С идеальным газом происходит циклический процесс, pT-диаграмма которого представлена на рисунке. Наименьший объём, который занимает газ в этом процессе, составляет 60 л. Определите количество вещества этого газа. Ответ округлите до целых.
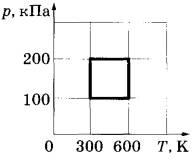
Решение.
Наименьший объем будет соответствовать наибольшему давлению при наименьшей температуре, то есть при p=200 кПа и T=300 К. Найдем количество вещества газа из уравнения Менделеева-Клапейрона:
 ,
,
откуда
 .
.
Подставляя  м3, R=8,31 и
м3, R=8,31 и  Па, получаем:
Па, получаем:
 моль.
моль.
Задача 4. На VT-диаграмме показано, как изменялись объём и температура некоторого постоянного количества разреженного газа при его переходе из начального состояния 1 в состояние 4. Как изменялось давление газа р на каждом из трёх участков 1-2, 2-3, 3-4: увеличивалось, уменьшалось или же оставалось неизменным? Ответ поясните, указав, какие физические явления и закономерности Вы использовали для объяснения.
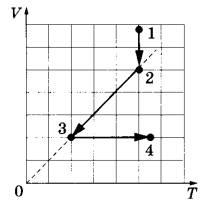
Решение.
1. Давление газа на участке 1-2 увеличивалось, на участке 2-3 не изменялось, на участке 3-4 увеличивалось.
2. На участке 1-2 процесс изотермический. По закону Бойля-Мариотта (pV = const) при уменьшении объёма давление увеличивается. На участке 2-3 процесс изобарный; значит, давление остаётся неизменным. На участке 3-4 процесс изохорный. По закону Шарля p/T = const при увеличении температуры давление увеличивается.
5. Д.З + рефлексия
задача (на следующем уроке решение разбирается)
Задача. В сосуде объёмом 10 л находится гелий. На рисунке показан график изменения давления гелия при изохорном нагревании. Сколько молей газа находится в сосуде? Ответ округлите до десятых.
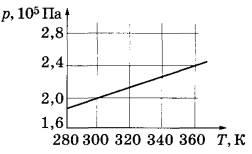
Решение.
Изохорный процесс – это термодинамический процесс при постоянном объеме. Так как объем не меняется, то число молей v в газе можно найти из уравнения Менеделеева-Клапейрона
 ,
,
откуда
 .
.
Из графика видно, что при T=300 К давление равно  Па. Подставляя эти значения в формулу (при
Па. Подставляя эти значения в формулу (при  м3), получаем:
м3), получаем:
 моль.
моль.





















