Химические свойства карбоновых кислот
| Карбоновые кислоты – это вещества, в молекулах которых содержится одна или несколько карбоксильных групп СООН. |
Общая формула предельных одноосновных карбоновых кислот: СnH2nO2
Химические свойства карбоновых кислот
.
| Для карбоновых кислот характерны следующие свойства: кислотные свойства, замещение водорода на металл; замещение группы ОН замещение атома водорода в алкильном радикале образование сложных эфиров — этерификация |
1. Кислотные свойства
| Кислотные свойства карбоновых кислот возникают из-за смещения электронной плотности к карбонильному атому кислорода и вызванной этим дополнительной (по сравнению со спиртами и фенолами) поляризацией связи О–Н. |

| Карбоновые кислоты – кислоты средней силы. В водном растворе карбоновые кислоты частично диссоциируют на ионы: R–COOH ⇆ R-COO– + H+ |
1.1. Взаимодействие с основаниями
Карбоновые кислоты реагируют с большинством оснований. При взаимодействии карбоновых кислот с основаниями образуются соли карбоновых кислот и вода.
CH3COOH + NaOH = CH3COONa + H2O
Карбоновые кислоты реагируют с щелочами, амфотерными гидроксидами, водным раствором аммиака и нерастворимыми основаниями.
| Например, уксусная кислота растворяет осадок гидроксида меди (II) |

| Например, уксусная кислота реагирует с водным раствором аммиака с образованием ацетата аммония |
CH3COOH + NH3 = CH3COONH4
1.2. Взаимодействие с металлами
Карбоновые кислоты реагируют с активными металлами. При взаимодействии карбоновых кислот с металлами образуются соли карбоновых кислот и водород.
| Например, уксусная кислота взаимодействует с кальцием с образованием ацетата кальция и водорода. |

1.3. Взаимодействие с основными оксидами
Карбоновые кислоты реагируют с основными оксидами с образованием солей карбоновых кислот и воды.
| Например, уксусная кислота взаимодействует с оксидом бария с образованием ацетата бария и воды. |

| Например, уксусная кислота реагирует с оксидом меди (II) |
2СН3СООН + CuO = H2О + ( CH3COO)2 Cu
1.4. Взаимодействие с с солями более слабых и летучих (или нерастворимых) кислот
Карбоновые кислоты реагируют с солями более слабых, нерастворимых и летучих кислот.
| Например, уксусная кислота растворяет карбонат кальция |

| Качественная реакция на карбоновые кислоты: взаимодействие с содой (гидрокарбонатом натрия) или другими гидрокарбонатами. В результате наблюдается выделение углекислого газа |

2. Реакции замещения группы ОН
| Для карбоновых кислот характерны реакции нуклеофильного замещения группы ОН с образованием функциональных производных карбоновых кислот: сложных эфиров, амидов, ангидридов и галогенангидридов. |
2.1. Образование галогенангидридов
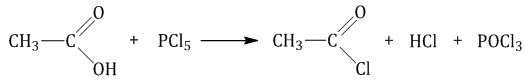
Под действием галогенагидридов минеральных кислот-гидроксидов (пента- или трихлорид фосфора) происходит замещение группы ОН на галоген.
| Например, уксусная кислота реагирует с пентахлоридом фосфора с образованием хлорангидрида уксусной кислоты |
2.2. Взаимодействие с аммиаком
При взаимодействии аммиака с карбоновыми кислотами образуются соли аммония:

При нагревании карбоновые соли аммония разлагаются на амид и воду:

2.3. Этерификация (образование сложных эфиров)
Карбоновые кислоты вступают в реакции с одноатомными и многоатомными спиртами с образованием сложных эфиров.

| Например, этанол реагирует с уксусной кислотой с образованием этилацетата (этилового эфира уксусной кислоты): |

2.4. Получение ангидридов
С помощью оксида фосфора (V) можно дегидратировать (то есть отщепить воду) карбоновую кислоту – в результате образуется ангидрид карбоновой кислоты.
| Например, при дегидратации уксусной кислоты под действием оксида фосфора образуется ангидрид уксусной кислоты |

3. Замещение атома водорода при атоме углерода, ближайшем к карбоксильной группе
| Карбоксильная группа вызывает дополнительную поляризацию связи С–Н у соседнего с карбоксильной группой атома углерода (α-положение). Поэтому атом водорода в α-положении легче вступает в реакции замещения по углеводородному радикалу. |
В присутствии красного фосфора карбоновые кислоты реагируют с галогенами.
| Например, уксусная кислота реагирует с бромом в присутствии красного фосфора |

4. Свойства муравьиной кислоты
| Особенности свойств муравьиной кислоты обусловлены ее строением, она содержит не только карбоксильную, но и альдегидную группу и проявляет все свойства альдегидов. |

4.1. Окисление аммиачным раствором оксида серебра (I) и гидроксидом меди (II)
Как и альдегиды, муравьиная кислота окисляется аммиачным раствором оксида серебра. При этом образуется осадок из металлического серебра.

При окислении муравьиной кислоты гидроксидом меди (II) образуется осадок оксида меди (I):

4.2. Окисление хлором, бромом и азотной кислотой
Муравьиная кислота окисляется хлором до углекислого газа.

4.3. Окисление перманганатом калия
Муравьиная кислота окисляется перманганатом калия до углекислого газа:
5HCOOH + 2KMnO4 + 3H2SO4 → 5CO2 + 2MnSO4 + K2SO4 + 8H2O
4.4. Разложение при нагревании
При нагревании под действием серной кислоты муравьиная кислота разлагается с образованием угарного газа:

5. Особенности бензойной кислоты
5.1. Разложение при нагревании
При нагревании бензойная кислота разлагается на бензол и углекислый газ:

4.2. Реакции замещения в бензольном кольце
| Карбоксильная группа является электроноакцепторной группой, она уменьшает электронную плотность бензольного кольца и является мета-ориентантом. |

6. Особенности щавелевой кислоты
6.1. Разложение при нагревании
При нагревании щавелевая кислота разлагается на угарный газ и углекислый газ:

6.2. Окисление перманганатом калия
Щавелевая кислота окисляется перманганатом калия до углекислого газа:

7. Особенности непредельных кислот (акриловой и олеиновой)
7.1. Реакции присоединения
Присоединение воды и бромоводорода к акриловой кислоте происходит против правила Марковникова, т.к. карбоксильная группа является электроноакцепторной:

К непредельным кислотам можно присоединять галогены и водород. Например, олеиновая кислота присоединяет водород:

6.2. Окисление непредельных карбоновых кислот
Непредельные кислоты обесцвечивают водный раствор перманганатов. При этом окисляется π-связь и у атомов углерода при двойной связи образуются две гидроксогруппы:
3CH2=CH-COOH + 2KMnO4 + 3H2O = 3CH2(OH)-CH(OH)-COOK + KOH + 2MnO2




































