Учитель: Бандурова Татьяна Сергеевна
Место работы: Государственное бюджетное образовательное учреждение Луганской Народной Республики «Кировская средняя общеобразовательная школа № 2»
Предмет: химия
Класс: 8
Тема. Соляная кислота и ее соли. Лабораторный опыт №2. Знакомство с образцами природных соединений неметаллов (хлоридами).
Цель урока: познакомить с химическими, физическими свойствами соляной кислоты, качественной реакцией на соляную кислоту и её соли; рассмотреть применение кислоты и ее солей.
Задачи:
Образовательные:
укрепить навыки проведения химического эксперимента, составления химических уравнений.
Развивающие:
развивать умение делать выводы по результатам химических опытов, сравнивать химические свойства кислот.
Воспитательные:
формировать бережное отношение к здоровью, знаний правил техники безопасности при работе с кислотами, щелочами; воспитывать познавательный интерес к предмету.
Планируемые результаты.
Предметные. Знать общие и специфические свойства соляной кислоты, уметь отличать от других неорганических веществ.
Метапредметные.
Регулятивные:
определять цели обучения, выбирать наиболее эффективные способы решения поставленных задач.
Познавательные:
уметь самостоятельно делать выводы по результатам химических исследований, устанавливать взаимосвязь между строением и свойствами, составлять химические уравнения, решать задачи.
Коммуникативные:
высказывать и обосновывать свое мнение, уважать мнение других, осознанно использовать речевые средства.
Личностные. Формировать научное мировоззрение, взаимосвязь химии и биологии.
Оборудование и материалы: таблица растворимости, периодическая система химических элементов, нитрат серебра, соляная кислота.
Методы обучения: наглядные – демонстрации, лабораторный опыт; интерактивные; практические: выполнение заданий.
Базовые понятия и термины: кислота, индикатор, качественная реакция на хлорид - ионы.
Тип урока: комбинированный
Урок разработан к учебнику Рудзитис Г.Е. Химия. 9 класс: учеб. для общеобразоват. организаций / Г.Е. Рудзитис, Ф.Е. Фельдман. – 2-е изд. – М.: Просвещение, 2016. – 208 с.: ил.
Структура урока
I. Организационный этап 2 мин
Актуализация знаний 7 мин
Постановка цели и задач урока. Мотивация учебной деятельности учащихся…..2 мин
Первичное усвоение новых знаний 19 мин
Первичная проверка понимания и закрепление 4 мин
Контроль усвоения, обсуждение допущенных ошибок и их коррекция.7 мин
Информация о домашнем задании, инструктаж по его выполнению 2 мин
Рефлексия (подведение итогов урока) 2 мин
ХОД УРОКА
Организационный этап
Приветствие, проверка готовности учащихся к уроку.
Актуализация знаний
Работа по карточке у доски (решение задачи)
Какое химическое вещество мы изучали на прошлом уроке? (хлороводород)
Что такое хлороводород? (вспоминают физические и химические свойства)
Как его можно получить в промышленности и лаборатории? (в промышленности сжиганием водорода в атмосфере хлора; в лаборатории действием концентрированной серной кислоты на сухой хлорид натрия)
Какие вещества называются кислотами?
Рассмотрение решения задачи (проверка)
Какой объем хлороводорода можно получить в лаборатории действием концентрированной серной кислоты на хлорид натрия массой 25г?
Постановка цели и задач урока. Мотивация учебной деятельности учащихся.
Почему хлороводород «дымит» на воздухе? («дымит» во влажном воздухе, так как образует с водяным паром воздуха туман, который состоит из мелких капель соляной кислоты)
Сообщение темы урока, учащиеся формируют цели урока.
Эпиграф к нашему уроку.
Единственный путь, ведущий к знанию,
- это деятельность
Б.Шоу
Записывают тему урока.
Первичное усвоение новых знаний
Для решения этих целей нам поможет план урока:
1.История открытия соляной кислоты
2. Получение соляной кислоты в лаборатории и в промышленности
3. Изучение физических свойств соляной кислоты
4. Химические свойства соляной кислоты
5.Значение и применение соляной кислоты и ее солей
6. Выполнение Л.о №2. Знакомство с образцами природных соединений неметаллов (хлоридами).
С соляной кислотой мы сталкиваемся ежедневно. Соляная кислота, выделяющаяся в желудке, используется для процесса пищеварения. Под ее воздействием большинство бактерий быстро погибает.
1.Изучение физических свойств соляной кислоты
Впервые кислота упоминается в сочинениях алхимика Василия Валентина во второй половине XV в..
В XVI в. Андреас Либавий в усердных поисках чудодейственного жизненного эликсира сухой перегонкой смеси, состоящей из купороса, квасцов и поваренной соли получили продукт, который описали под названием «кислого спирта». Это и была знакомая соляная кислота, конечно, очень нечистая.
Для первых исследователей это было совершенно новое вещество, обладавшее свойствами, которые сильно поражали их воображение. Нюхая его, они задыхались и кашляли, «кислый спирт» дымил в воздухе. Пробуя на вкус, он обжигал язык и нёбо, металлы он разъедал, ткани разрушал.
В 1658 г. немецкий химик И.Р.Глаубер (1604–1670) нашел новый способ получения соляной кислоты, которую он назвал «соляным спиртом». Этот способ применяют и сейчас в лабораториях. Он нагревал поваренную соль с концентрированной серной кислотой и выделявшийся «дым» поглощал водой.
В 1772 г. английский химик Дж.Пристли (1733–1804) установил, что при действии
серной кислоты на поваренную соль выделяется бесцветный газ, который может быть собран над ртутью, газ обладает способностью растворяться в воде. Водный раствор этого газа получил название «соляной кислоты» (acidum muriaticum), а сам газ Пристли назвал «чистой газообразной соляной кислотой».
2. Получение соляной кислоты
в лаборатории в промышленности


3. Изучение физических свойств соляной кислоты
Откроем параграф §15 с. 56 учебника и ознакомимся с физическими свойствами соляной кислоты, запишем в тетрадь (с плотность 1,19 г/см3, раствор концентрированной соляной кислоты дымит на воздухе, сильная одноосновная кислота).
4. Химические свойства соляной кислоты
Как можно подтвердить, что данное вещество кислота?
Какие химические свойства имеют кислоты?
Демонстрация опыта, написание химических уравнений, использование интерактивного метода «Диаграмма Венна».
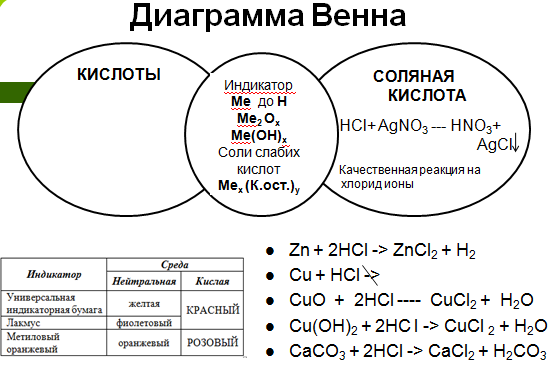
Реактивом на соляную кислоту и ее соли является раствор нитрата серебра, в результате реакции образуется белый творожистый осадок хлорида серебра.
HCl + AgNO3 = AgCl↓ + HNO3
H+ + Cl - + Ag+ + NO3- = AgCl↓ + H+ + NO3-
Ag+ + Cl - = AgCl↓
5.Значение и применение соляной кислоты и ее солей
Рассмотрим слайд
Чтоб охотней покупали,
Чтобы был опрятный вид,
Все изделия из стали
Лучше никелем покрыть.
Удалим оксидов слой мы соляной кислотой,
А потом в особой ванне
Гальванируем металлы
Или если раковина
Ржавчиной покрыта,
Не поможет даже
Мистер мускул знаменитый
Лишь эта кислота
Помогает нам всегда
6. Выполнение Л.о №2.
Тема. Знакомство с образцами природных соединений неметаллов (хлоридами).
Цель.
Оборудование.
Заполнить таблицу
| Название соли | Формула | Применение |
| Хлорид натрия, Натриевая соль соляной кислоты |
NaCl | Известен в быту под названием поваренной соли, основным компонентом которой и является. Хлорид натрия в значительном количестве содержится в морской воде, придавая ей солёный вкус. |
| Хлорид кальция | CaCl2 | Добавки Е509 в пищевой, фармацевтической промышленностях. |
| Хлорид калия, калиевая соль | KCl | Эффективное калийное удобрение, используется стекольной и химической промышленности. |
| Хлорид алюминия | AlCl3 | Применяться в качестве деструктивного катализатора процесса разложения нефти на фракции, |
| Хлорид серебра | AgCl | Малорастворимая соль, используется в фотоработах |
Вывод
.
Первичная проверка понимания и закрепление
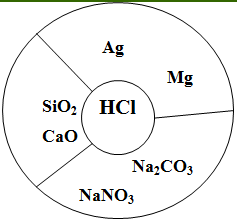
Выполните задание «Убери лишнее». Какие из указанных веществ будут реагировать с соляной кислотой? Составьте уравнения химических реакций
Контроль усвоения, обсуждение допущенных ошибок и их коррекция
Информация о домашнем задании, инструктаж по его выполнению
Повторить п.14
Прочитать п.15
Выполнить задания №1,3, 4 параграф 15
Рефлексия (подведение итогов занятия)
Давайте поделимся своими впечатлениями по уроку.
Ответьте на следующие вопросы:
- я узнал…
- я хотел узнать…
- я узнал…




















