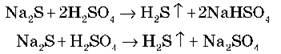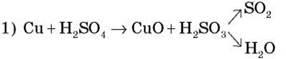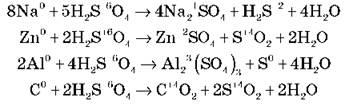Тема урока. Сульфатная кислота. Физические и химические свойства
Цели урока: изучить физические и химические свойства серной кислоты, общие для всех кислот, на примере взаимодействия с металлами, оксидами, основаниями, солями; показать различия в физических и химических свойствах концентрированной и разбавленной сульфатных кислот; ознакомить учащихся со специфическими свойствами концентрированной серной кислоты; показать значение сульфатной кислоты.
Тип урока: комбинированный урок усвоения знаний, умений и навыков и творческому применению их на практике.
Формы работы: учебная лекция, фронтальная работа с опорной схемой, демонстрационный эксперимент.
Оборудование: периодическая таблица химических элементов, таблица растворимости, ряд активности металлов.
ХОД УРОКА
I. Организация класса
II. Актуализация опорных знаний
1. Анализ практической работы 1, обсуждение типичных ошибок, коррекция знаний
2. Работа у доски по вопросам
1) Установите соответствие.
N2O5 H2CO3
SO2 HNO3
CO2 H2SO4
SO3 H2SO3
2) Запишите уравнение гидратации оксидов из задания 1.
3) Осуществите превращения.
FeS2  SO2
SO2  SO3
SO3  H2SO4
H2SO4
4) Укажите среди этих реакций ОВP, в каждой реакции укажите окислитель и восстановитель.
5) Вычислите массу сульфатной кислоты, которую можно получить из 1 т пирита, содержащего 10 % примесей, если выход продукта реакции составляет 87 %.
III. Изучение нового материала
1. Физические свойства серной кислоты
Бесцветная жидкость, тяжелая, очень гигроскопична. Поглощает влагу с выделением большого количества тепла (79 кДж/моль), образуя прочные гидраты. Нельзя приливать воду к концентрированной H2SO4: произойдет разбрызгивание вследствие ее нагрева до температуры кипения. Для разведения H2SO4 ее небольшими порциями добавляют к воде (тепло выделяется в толще воды).
Так же «жадно» H2SO4 поглощает влагу воздуха (используется для осушения).
В продажу поступает 95%-ная сульфатная кислота H2SO4 (ρ = 1,84 г/мл). Нелетка. Не имеет запаха. Обугливает органические вещества, отнимая от них воду (сахар, бумага, дерево), поэтому часто имеет бурый цвет из-органические вещества, случайно попавшие в нее. Вызывает сильные ожоги!
2. Химические свойства раствора серной кислоты
1) Сильный электролит, в растворе практически полностью диссоциирует на ионы:
H2SO4  2H+ + SO42-
2H+ + SO42-
2) Образует два ряда солей: кислые и средние. Какие именно из них образуются, зависит от количественного соотношения реагентов:
H2SO4 + NaOH  NaHSO4 + H2O
NaHSO4 + H2O
H2SO4 + 2NaOH  Na2SO4 + 2H2O
Na2SO4 + 2H2O
(демонстрация 2, учащиеся у доски составляют ионные уравнения реакций)
3) С основными оксидами:
CuO + H2SO4  CuSO4 + H2O (демонстрация с составлением ионных уравнений реакций)
CuSO4 + H2O (демонстрация с составлением ионных уравнений реакций)
4) Может вытеснять более слабые кислоты в процессе взаимодействия с их солями:
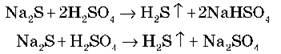
5) С металлами разбавленная и концентрированная кислоты взаимодействуют по-разному: разбавленная реагирует со всеми металлами до Н2 (кроме Гb, потому чтоPbSO4 не растворяется):
Fe + H2SO4  FeSO4 + Н2
FeSO4 + Н2
(демонстрация с составлением ионных уравнений реакций)
3. Специфические свойства концентрированной серной кислоты
1) Концентрированная сульфатная кислота не диссоциирует на ионы.
2) Обугливание органических веществ, состоящих из Углерода и Водорода. Если сахар смешать с концентрированной H2SO4, масса чернеет и разогревается и вскоре из стаканчика начинает выползать пористая черная масса (при технической возможности демонстрируем действие концентрированной серной кислоты на сахар):
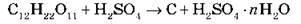
3) Концентрированная H2SO4 при комнатной температуре не взаимодействует с некоторыми металлами. Это позволяет перевозить кислоту (≥ 75 %) в стальных цистернах.
4) Во время нагрева действует почти на все металлы до Ag включительно (кромеPt, Au и некоторых других). В этом случае водород не выделяется, а образуются продукты восстановления S+6: SO2, H2S, S, а также соль и вода. Продукты зависят от активности металла и условий реакции (температура, концентрация H2SO4).Условно можно принять, что сульфатная кислота восстанавливается:
• с малоактивними металлами — до SO2:
2Ag + 2H2SO4  Ag2SO4 + SO2 + H2O
Ag2SO4 + SO2 + H2O
• в результате взаимодействия с более активными металлами может выделятьсяSO2, H2S и S. Например, узаємодія с Zn (в зависимости от условий — температуры и концентрации):

4. Демонстрация 7. Взаимодействие концентрированной серной кислоты с медью
Реакция в процессе нагревания протекает поэтапно:
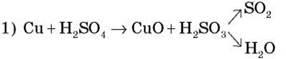
2) Купрум(II) оксид реагирует с избытком серной кислоты, что можно описать уравнением:
CuO + H2SO4  CuSO4 + H2O
CuSO4 + H2O
Суммарное уравнение можно записать так:
Cu + 2H2SO4  CuSO4 + SO2 + 2H2O
CuSO4 + SO2 + 2H2O
5. Значение серной кислоты и сульфатов в народном хозяйстве
Сообщения учащихся
Применение H2SO4
Фундамент химической промышленности.
Производство минеральных удобрений.
Очистка поверхности металлов перед нанесением металлических покрытий.
Очистка нефтепродуктов (в том числе бензина и керосина). Образует продукты, нерастворимые в нефтепродуктах.
Производство взрывчатых веществ, моющих средств, красителей, химических волокон.
В аккумуляторах.
IV. Первичное применение полученных знаний
Задача 1. Как концентрированная H2SO4 будет действовать на индикаторы? Ответ обоснуйте.
Задание 2. Напишите уравнения реакций взаимодействия концентрированной серной кислоты с натрием, цинком, алюминием, углеродом в молекулярной форме и расставьте коэффициенты методом электронного баланса (самостоятельная работа со взаимопроверкой):
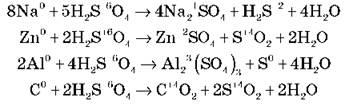
Задача 3. Из перечисленных веществ выберите те, с которыми будет реагировать разбавленная сульфатная кислота. Запишите уравнения возможных реакций в молекулярной, полной и сокращенной ионной формах.
Ca, Al (OH)3, СиО, ZnO, Cu, CO2, S, K2CO3.
Задача 4. Вычислите массу сульфатной кислоты, которую можно получить из 100кг руды, содержащей 70 % Серы, если массовая доля выхода продукта реакции составляет 85 %.
V. Подведение итогов урока
Чем различаются химические свойства разбавленной и концентрированной серной кислоты?
В цистернах из каких металлов можно транспортировать концентрированную сульфатную кислоту? (Назовите условия.)
Почему эти самые цистерны для перевозки растворов кислоты?
VI. Домашнее задание
Проработать материал параграфа, ответить на вопросы к нему, выполнить упражнения.
Творческое задание: подготовить сообщение о сульфаты и их применение.