1. ИНФОРМАЦИЯ О РАЗРАБОТЧИКЕ ПЛАНА
2. ОБЩАЯ ИНФОРМАЦИЯ ПО УРОКУ
| Класс (укажите класс, к которому относится урок): | 9 класс |
| Место урока (по тематическому планированию ПРП) | Это второй урок по изучению элементов VА группы, после темы «Общая характеристика элементов VА-группы. Азот, распространение в природе, физические и химические свойства». Основная задача урока – подготовить учащихся к практической работе № 3 по теме «Получение аммиака, изучение его свойств», которая следует за данным уроком. |
| Тема урока | «Аммиак, его физические и химические свойства, получение и применение» |
| Уровень изучения (укажите один или оба уровня изучения (базовый, углубленный), на которые рассчитан урок): | Базовый/углубленный |
| Тип урока (укажите тип урока): | ☐ урок освоения новых знаний и умений
|
| Планируемые результаты (по ПРП): |
| Личностные способность владеть достоверной информацией, заинтересованность в научных знаниях; готовность к совместной деятельности при выполнении общих задач; интерес к обучению и познанию, исследовательской деятельности; осознание необходимости соблюдения правил безопасности при обращении с химическими веществами в быту и реальной жизни; способности применять знания для решения задач, связанных с окружающей природной средой. |
| Метапредметные умение раскрывать смысл химических понятий; умение применять в процессе познания понятия, символические (знаковые) модели; приобретение опыта по планированию, организации и проведению ученических экспериментов; умение выбирать, анализировать и интерпретировать информацию различных видов и форм представления, получаемую из разных источников, в том числе ресурсы Интернета; умения учебного сотрудничества со сверстниками в совместной познавательной и исследовательской деятельности; умение самостоятельно определять цели деятельности, планировать, осуществлять, контролировать и при необходимости корректировать свою деятельность. |
| Предметные умения определять характер среды в водных растворах неорганических соединений прогнозировать свойства веществ в зависимости от их строения; умение характеризовать химические свойства простых и сложных веществ, подтверждая описание примерами молекулярных и ионных уравнений соответствующих химических реакций; умение прогнозировать свойства веществ в зависимости от их строения; умение проводить реакции, подтверждающие качественный состав различных веществ: в частности распознавать опытным путём ион аммония; умение соблюдать правила пользования химической посудой и лабораторным оборудованием, а также правила обращения с веществами в соответствии с инструкциями по выполнению лабораторных химических опытов по получению и собиранию газообразных веществ, в частности аммиака; умение применять основные операции мыслительной деятельности – анализ и синтез, сравнение, обобщение, систематизацию, выявление причинно-следственных связей – для изучения свойств веществ и химических реакций, естественно-научные методы познания. |
| Ключевые слова (введите через запятую список ключевых слов, характеризующих урок): аммиак, нашатырный спирт, нашатырь, строение, свойства, получение, ион аммония, качественная реакция на ион аммония |
| Краткое описание (введите аннотацию к уроку, укажите используемые материалы/оборудование/электронные образовательные ресурсы)
Урок химии в 9 классе по теме «Аммиак». Урок проводится перед практической работой «Получение аммиака в лаборатории и изучение его свойств» и направлен на подготовку к этой работе. Содержание урока включает медиаресурсы: фрагмент телепередачи «Галилео» (анализ фактологических ошибок), интернет-магазин «Wildberries» (анализ содержания рекламы продукции на понятийном уровне). ЭОР Библиотека ЦОК контент «Моя школа» (задание для самодиагностики) Оборудование и материалы: ПК, проектор/интерактивная панель, мультимедийная презентация, раздаточный материал (цветные карточки для выполнения мини-проекта, самостоятельной работы, эталоны), клей, лабораторное оборудование и реактивы |
3. БЛОЧНО-МОДУЛЬНОЕ ОПИСАНИЕ УРОКА
| БЛОК 1. Вхождение в тему урока и создание условий для осознанного восприятия нового материала |
| Этап 1.1. Мотивирование на учебную деятельность |
| Укажите формы организации учебной деятельности на данном этапе урока. Опишите конкретную учебную установку, вопрос, задание, интересный факт, которые мотивируют мыслительную деятельность школьника (это интересно/знаешь ли ты, что) |
| На экране высказывание и ряд изображений товаров интернет-магазина 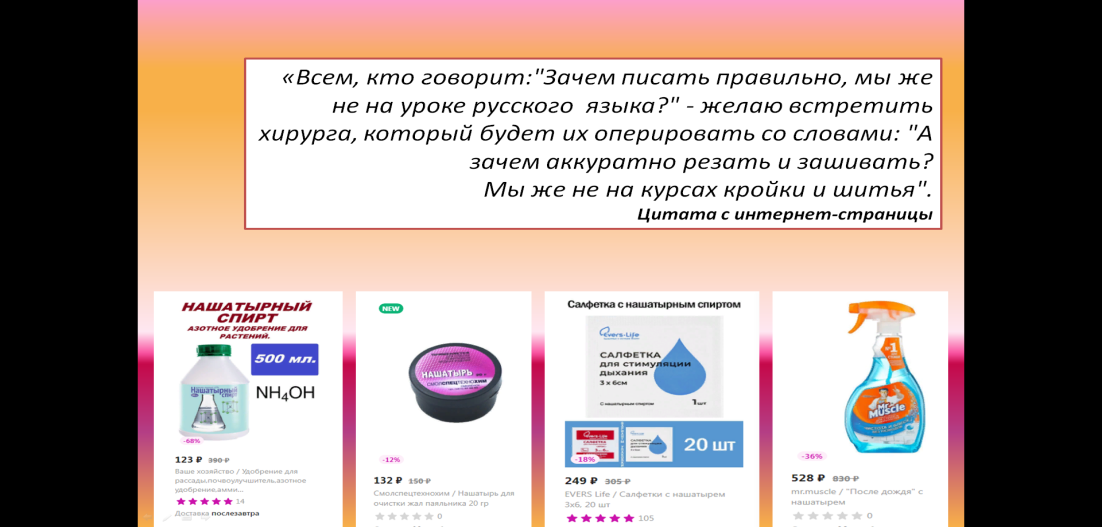 Учитель предлагает обсудить высказывание (на экране): «Всем, кто говорит:"Зачем писать правильно, мы же не на уроке русского языка?" - желаю встретить хирурга, который будет их оперировать со словами: "А зачем аккуратно резать и зашивать? Мы же не на курсах кройки и шитья"(цитата с интернет-страницы). Учащиеся высказывают свое мнение, зачем нужно быть грамотным, например, при приобретении разных товаров |
| Этап 1.2. Актуализация опорных знаний |
| Укажите формы организации учебной деятельности и учебные задания для актуализации опорных знаний, необходимых для изучения нового
Учитель предлагает проверить свою грамотность в вопросах по теме «Азот и его соединения», используя мини-тест: задания (1-5). (слайды презентации) – фронтальная работа с классом Задание 1. Азот и аммиак являются соответственно 1) простым и сложным веществами 2) сложным и простым веществами 3) сложными веществами 4) простыми веществами Задание 2. Соединениями с ковалентной неполярной и ковалентной полярной связью являются соответственно 1) аммиак и азотная кислота 2) нитрат натрия и азот 3) азот и аммиак 4) диоксид азота и азотистая кислота Задание 3. Установите соответствие между формулой соединения и степенью окисления азота в этом соединении: | ФОРМУЛА СОЕДИНЕНИЯ | СТЕПЕНЬ ОКИСЛЕНИЯ АЗОТА | | А) HNO3 Б) N2O В) NH3 | 1) +1 2) –3 3) +3 4) +5 |
Задание 4. Найдите «пятый лишний» N2O NO NH3 NO2 N2O5 Задание 5. (Пробное задание) Выберите правильные утверждения: 1) Раствор аммиака в воде называется нашатырём 2) в лаборатории аммиак получают из солей аммония 3) аммиак – это летучее водородное соединение азота 4) аммиак взаимодействует с кислотами и основаниями 5) соли аммония образуются при взаимодействии аммиака с кислотами 6) раствор аммиака в воде имеет щелочной характер |
| Этап 1.3. Целеполагание |
| Назовите цель (стратегия успеха): ты узнаешь, ты научишься |
| Выявление места и причины затруднения Учащиеся сталкиваются с затруднением («мы не знаем, с какими веществами реагирует аммиак, как его получают…», или «мы предполагаем…, но не знаем, как объяснить или обосновать, что для аммиака характерно…») и фиксируют причину («мы не знаем способы получения и свойства аммиака»). Учитель подводит учащихся к постановке цели урока и формулировке темы. ты узнаешь способы получения и свойства аммиака ты научишься применять полученные знания на практике Цель урока: изучить способы получения и свойства аммиака и научиться применять полученные знания на практике. Тема: «Аммиак, его физические и химические свойства, получение и применение» |
| БЛОК 2. Освоение нового материала |
| Этап 2.1. Осуществление учебных действий по освоению нового материала |
| Укажите формы организации учебной деятельности, включая самостоятельную учебную деятельность учащихся (изучаем новое/открываем новое). Приведите учебные задания для самостоятельной работы с учебником, электронными образовательными материалам (рекомендуется обратить внимание учеников на необходимость двукратного прочтения, просмотра, прослушивания материала. 1) на общее понимание и мотивацию 2) на детали). Приведите задания по составлению плана, тезисов, резюме, аннотации, презентаций; по наблюдению за процессами, их объяснением, проведению эксперимента и интерпретации результатов, по построению гипотезы на основе анализа имеющихся данных и т.д. |
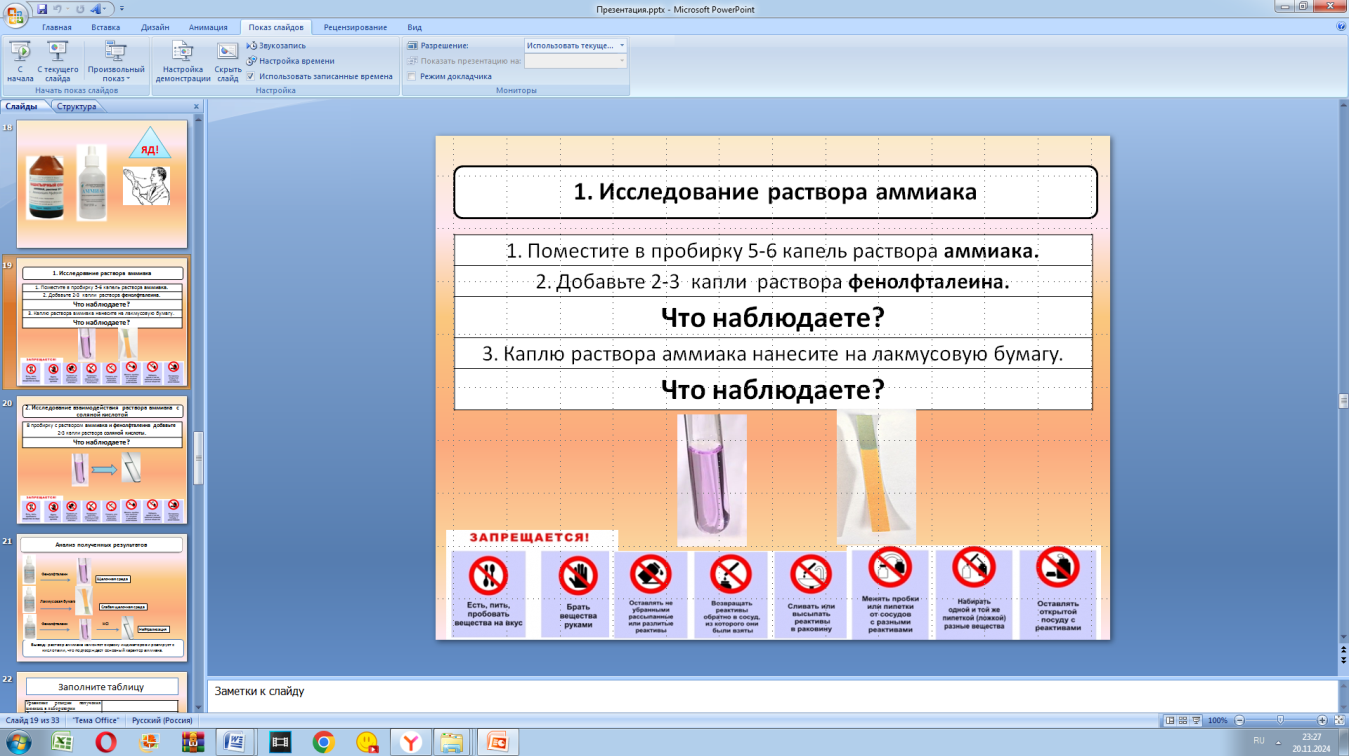
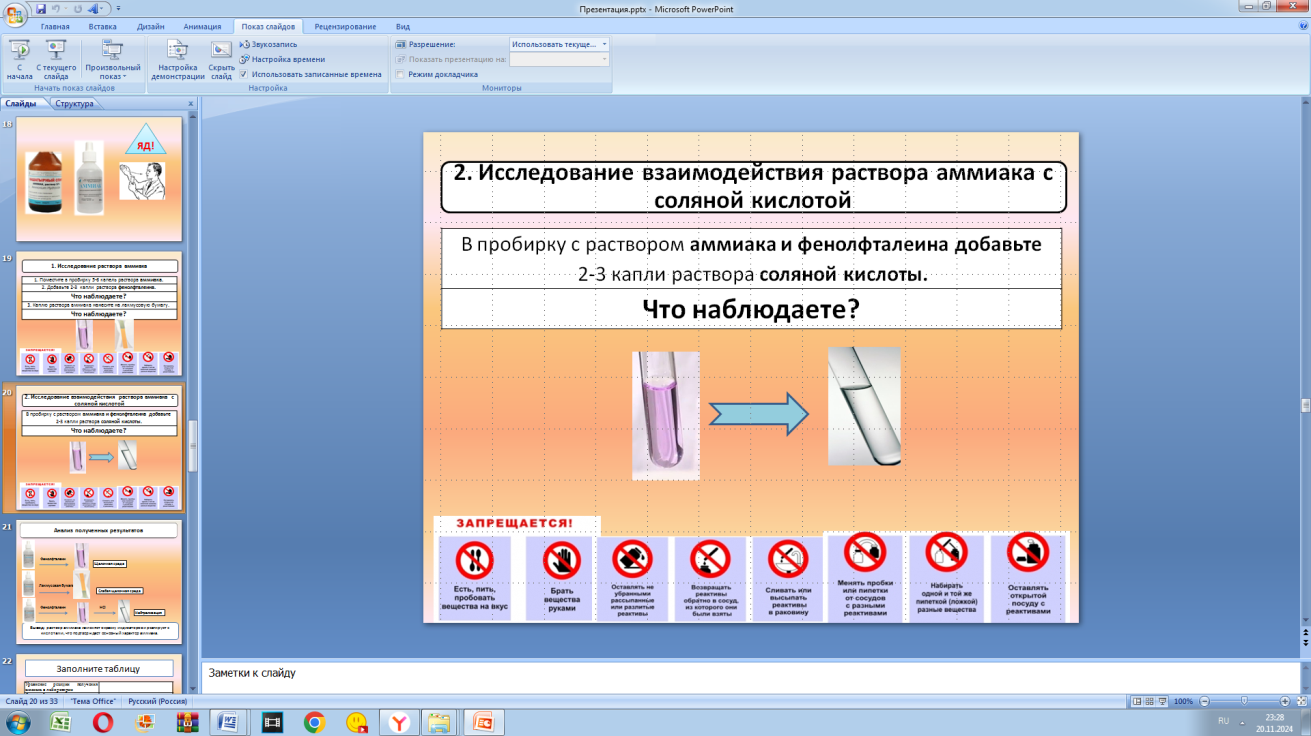
| Учитель предлагает план изучения темы: 1) рассмотреть электронное строение молекулы аммиака; 2) выдвинуть гипотезу о свойствах аммиака; 3) провести экспериментальное исследование свойств аммиака, проанализировать результаты и сделать выводы; 4) выполнить групповой мини-проект. Реализация построенного проекта 1) Рассмотреть электронное строение молекулы аммиака (слайды презентации) Учащиеся: повторяют способ образования связи в молекуле аммиака на основе электронной формулы, делают вывод о наличие избытка электронов на атоме азота. 2) Выдвинуть гипотезу о свойствах аммиака (слайды презентации) Учитель знакомит учащихся с понятием донора и акцептора и подводит учащихся к понятию «донорно-акцепторная связь». Далее предлагается проанализировать, какие вещества могут быть источником катионов водорода Н+: вода и кислоты. Формулируется понятие иона аммония и солей аммония. Ставится вопрос о том, при реакции с какими веществами может образоваться ион аммония. Учащиеся выдвигают гипотезу, что аммиак должен взаимодействовать с водой и кислотами, проявляя основный характер. 3) Провести экспериментальное исследование свойств аммиака, проанализировать результаты и сделать выводы Проведение лабораторной работы в парах. Учитель уточняет, что объектом исследования является раствор аммиака, приобретенный в аптеке. Задает вопрос: что знают ребята о данном препарате? Учащиеся отвечают, что препарат имеет название «нашатырный спирт», имеет резкий запах, используется для оказания первой медицинской помощи при потере сознания. Учитель проводит инструктаж, обращая внимание детей, на особые свойства аммиака: пары аммиака сильно раздражают слизистые оболочки глаз и органов дыхания, а также кожные покровы. Организуется проведение эксперимента, согласно инструкции. Опыт 1. Исследование раствора аммиака Опыт 2. Исследование взаимодействия раствора аммиака с соляной кислотой Учащиеся анализируют результаты эксперимента: - раствор аммиака имеет слабую щелочную среду; - аммиак реагирует с кислотами. На основе результатов формулируют вывод: раствор аммиака изменяет окраску индикаторов и реагирует с кислотами, что подтверждает основный характер аммиака; аммиак обнаруживают по посинению лакмусовой бумажки, что лежит в основе качественного определения солей аммония. 4) выполнить групповой мини-проект Учитель предлагает перевести выводы в знаково-символическую систему и выполнить мини-проект в группах. Задание для групп: заполнить таблицу «Свойства аммиака» Свойства аммиака | Уравнение реакции получения аммиака в лаборатории |
| | Схема образования иона аммония |
| | Уравнение реакции взаимодействия аммиака с водой |
| | Уравнение реакции взаимодействия аммиака с соляной кислотой |
| | Уравнение реакции взаимодействия раствора аммиака с соляной кислотой |
|
Для заполнения таблицы используется разрезной материал: цветные карточки со схемами превращений. | NH3 + H+ → NH4+ NH3 + HCl → NH4Cl NH3 + H2O ↔ NH4OH ↔ NH3 . H2O ↔ NH4+ + OH- NH3 . H2O + HCl → NH4Cl + H2O 2NH4Cl + Ca(OH)2 → CaCl2 + 2H2O + 2NH3↑ | Во время групповой работы учащиеся определяют соответствие карточек с данными таблицы и вклеивают их.
|
| Этап 2.2. Проверка первичного усвоения |
| Укажите виды учебной деятельности, используйте соответствующие методические приемы. (Сформулируйте/Изложите факты/Проверьте себя/Дайте определение понятию/Установите, что (где, когда)/Сформулируйте главное (тезис, мысль, правило, закон) |
| В создании мини-проектов используется приём «Эффективная палитра», который введен мною для организации наглядного представления информации, что позволяет экономить время для проверки правильности полученных «эталонов». Работы детей закрепляются на магнитной доске и сравниваются с основным эталоном. Представители каждой группы представляют свой проект, объясняя свойства аммиака. Организуется проговаривание новых понятий (ион аммония, гидроксид аммония или гидрат аммония или нашатырный спирт, соли аммония, хлорид аммония или нашатырь). Каждый ученик получает эталон: 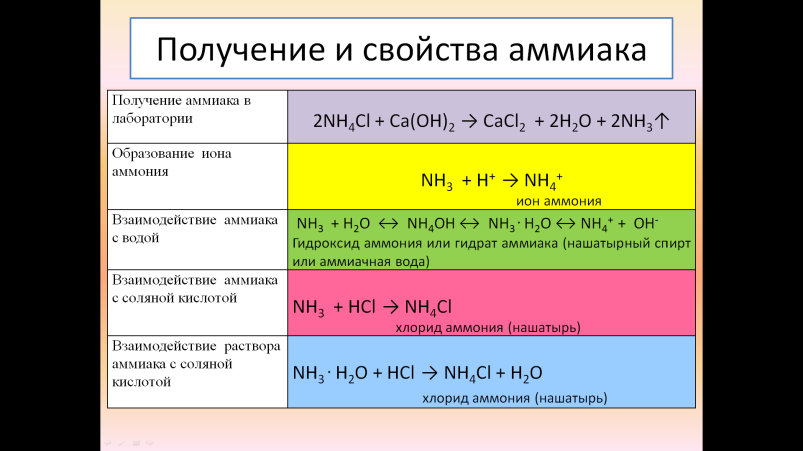 Учитель возвращается к пробному действию, проводится устный анализ и проверка: Выберите правильные утверждения: 1) Раствор аммиака в воде называется нашатырём 2) в лаборатории аммиак получают из солей аммония 3) аммиак – это летучее водородное соединение азота 4) аммиак взаимодействует с кислотами и основаниями 5) соли аммония образуются при взаимодействии аммиака с кислотами 6) раствор аммиака в воде имеет щелочной характер |
| БЛОК 3. Применение изученного материала |
| Этап 3.1. Применение знаний, в том числе в новых ситуациях |
| Укажите формы организации соответствующего этапа урока. Предложите виды деятельности (решение задач, выполнение заданий, выполнение лабораторных работ, выполнение работ практикума, проведение исследовательского эксперимента, моделирование и конструирование и пр.), используйте соответствующие методические приемы (используй правило/закон/формулу/теорию/идею/принцип и т.д.; докажите истинность/ложность утверждения и т.д.; аргументируйте собственное мнение; выполните задание; решите задачу; выполните/сделайте практическую/лабораторную работу и т.д.). |
| Внимание учащихся обращается на данные о лабораторном способе получения аммиака. Организуется просмотр видеофрагмента телепередачи «Галилео», где демонстрируется получение аммиака в лаборатории (длительность фрагмента – 5 мин., анализ –2 мин.). После просмотра организуется беседа, в ходе которой учащиеся анализируют видеофрагмент и отвечают на вопросы: почему аммиак собирается в перевернутый вверх дном сосуд? (аммиак легче воздуха); где в речи ведущего прозвучала неправильная терминология? (неправильно использованы названия веществ: путаница понятия нашатырный спирт с нашатырем в начале фрагмента, в конце - ведущий сам же называет раствор аммиака нашатырным спиртом, что является правильным суждением); какие нарушения правил техники безопасности продемонстрированы в видеоролике? получение аммиака проводят в вытяжном шкафу, исходная смесь заполняет пробирку на ½ - это очень много! пробирка закреплена в лапке штатива посередине, а должна быть закреплена у отверстия, пробирка не прогрета, прибор не испытан на герметичность, конец газоотводной трубки после завершения эксперимента зажимается ватой, смоченной в воде для улавливания аммиака; для чего при растворении аммиака в воду добавляют фенолфталеин? (для того, чтобы процесс растворения сделать видимым); где используется нашатырный спирт? (медицина, в сельском хозяйстве, в быту как моющее средство). По результатам анализа просмотренного видео учащиеся делают вывод о значении химических знаний в формировании медиаграмотности. |
| Этап 3.2. Выполнение межпредметных заданий и заданий из реальной жизни |
| Подберите соответствующие учебные задания |
| Далее ребятам предлагается побывать в интернет-магазине «Wildberries» (используются скриншоты отдельных страниц): демонстрируются изображения, показанные в начале урока. 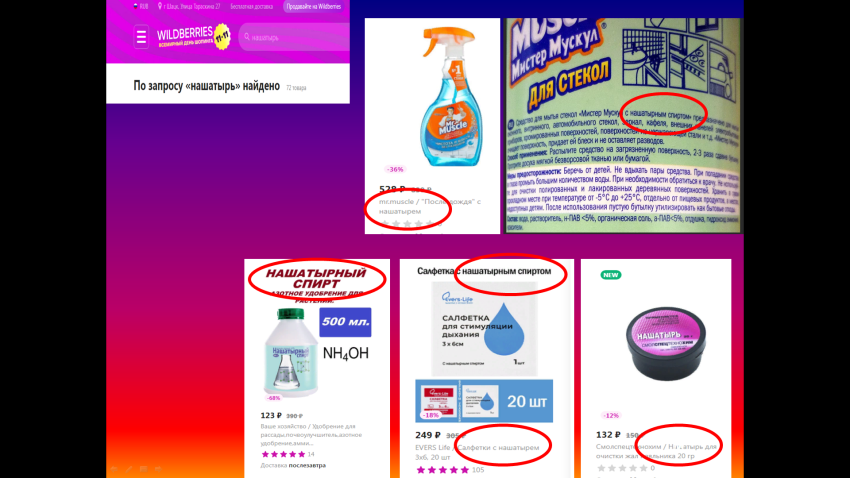 Перед учащимися ставится цель: оценить правильность представления информации о товарах на уровне использования терминов: «нашатырь» и «нашатырный спирт». Учащиеся приходят к выводу, что информация, представленная на страницах интернет-магазина, представлена некорректно и может ввести в заблуждение потребителя. |
| Этап 3.3. Выполнение заданий в формате ГИА (ОГЭ, ЕГЭ) |
| Подберите соответствующие учебные задания |
| Учащимся предлагается выполнить задание у доски с последующей проверкой по эталону (слайд презентации)
| Задание: осуществите превращение по схеме: | | + H2, t, р +HCl + KOH, t N2 → Х1 → NH4Cl → NH3 |
| Эталон | | + H2, t, р +HCl + KOH, t N2 → Х1 → NH4Cl → NH3
N2 + 3H2 → 2NH3 NH3 + HCl → NH4Cl NH4Cl + KOH → KCl + H2O + NH3 ↑ | Учитель поясняет, что подобные задания, встречаются в КИМах и являются основой для подготовки к государственной итоговой аттестации. Так последнее задание для самостоятельной работы взято из открытого банка заданий ОГЭ ФИПИ. Далее ставится задача, записать последнее уравнение реакции в ионном виде ( в этом прослеживается связь с теорией электролитической диссоциации – ранее изученный материал) |
| Этап 3.4. Развитие функциональной грамотности |
| Подберите соответствующие учебные задания |
| Задание. Прочитайте текст и выберите утверждения, которые соответствуют его содержанию Значительные количества аммиака используются для получения удобрений, например, хлорида аммония. Хлорид аммония известен человечеству с древних времен. Применяется он как азотное удобрение под культуры, слабо реагирующие на избыток хлора. Его не рекомендуют для использования на приусадебных участках, но поскольку хлорид аммония является побочным продуктом при производстве пищевой соды, то его экономически выгодно использовать в больших хозяйствах при выращивании зерновых культур. На практике хлорид аммония наиболее подходит для подкормки риса. К каким экологическим последствиям может привести чрезмерное употребление хлорида аммония в качестве удобрения? Хлорид аммония хорошо растворим в воде. Попадая в почву, он гидролизуется по катиону: NH4+ + H2O→NH4OH + H+, Из-за образующихся катионов водорода хлорид аммония называют физиологически кислотным удобрением. Поэтому хлорид аммония используют на щелочных почвах. Внесение чрезмерного количества этого удобрения без учета типа почвы будет повышать ее кислотность, что негативно скажется на живых организмах. Утверждения. Избыток хлора у растений вызывает задержку роста и отмирание тканей. Раствор хлорида аммония имеет кислую реакцию среды. Хлорид аммония используют для подкормки некоторых культур. Чрезмерное количество хлорида аммония обогащает почву азотом. Хлорид аммония применяется для получения соды. |
| Этап 3.5. Систематизация знаний и умений |
| Подберите учебные задания на выявление связи изученной на уроке темы с освоенным ранее материалом/другими предметами |
| Задание №1: дается на этапе 3.2 при выполнении задания ГИА.: записать последнее уравнение реакции в ионном виде (в этом прослеживается связь с теорией электролитической диссоциации, тема «Реакции в растворах электролитов» – ранее изученный материал). Задание №2: записать уравнение реакции гидролиза хлорид аммония в молекулярном и ионном виде (см. текст задания по функциональной грамотности) (в этом прослеживается связь с теорией электролитической диссоциации, тема «Гидролиз солей» – ранее изученный материал). Межпредметные связи прослеживаются на протяжении всего урока: медицина, сельское хозяйство. |
| БЛОК 4. Проверка приобретенных знаний, умений и навыков |
| Этап 4.1. Диагностика/самодиагностика |
| Укажите формы организации и поддержки самостоятельной учебной деятельности ученика, критерии оценивания |
| Самостоятельная работа с самопроверкой по эталону Используется диагностическое задание ЭОР Библиотека ЦОК
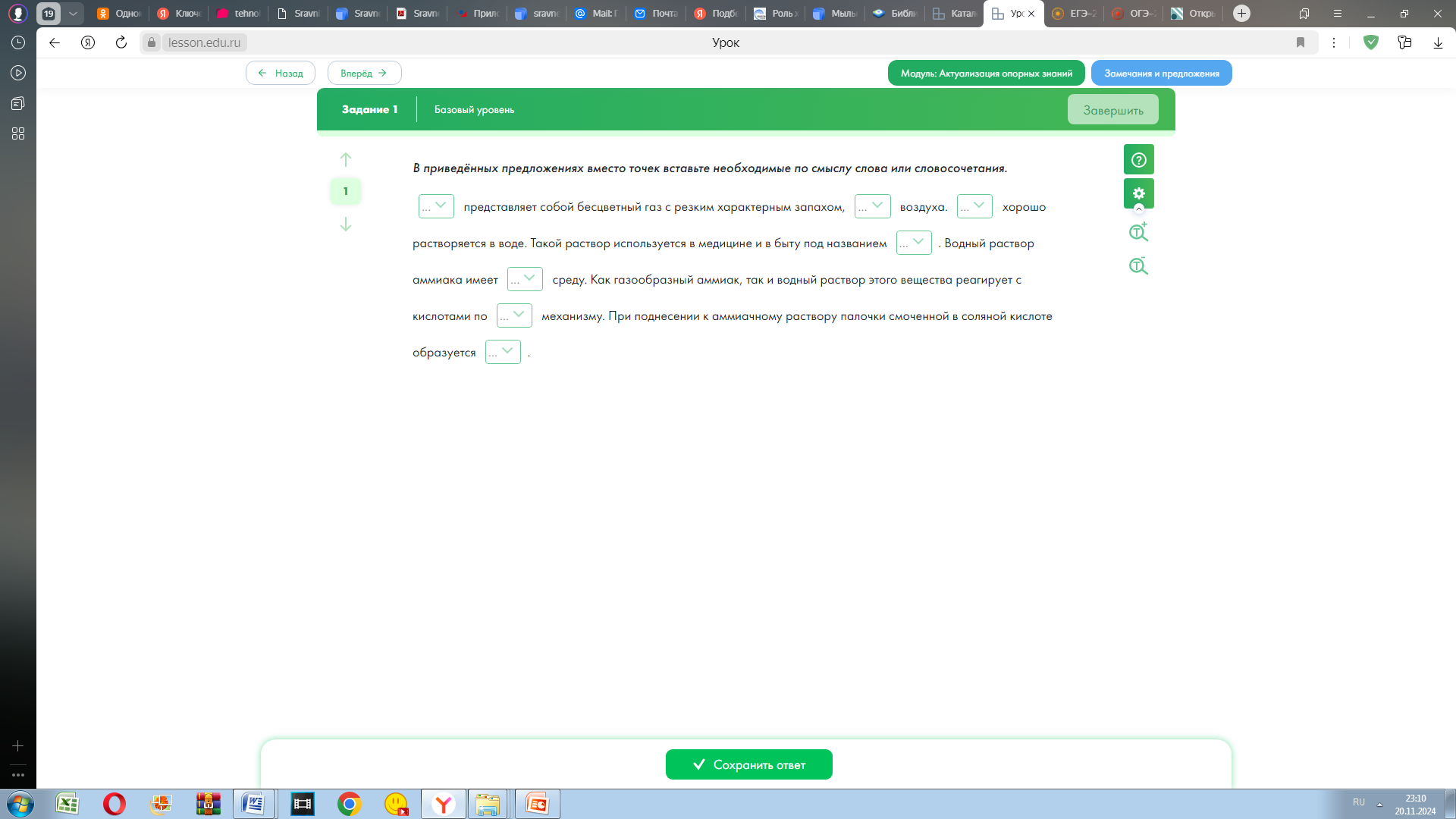 Организуется самостоятельная работа по карточкам, работа оформляется непосредственно в карточках В приведенных предложениях вместо точек вставьте необходимые слова или словосочетания. Слова для справок: аммиак, легче, тяжелее, хлорид аммония, дым, аммиачная вода, щелочная, кислая, донорно-акцепторный. Эталон для самопроверки
|
| БЛОК 5. Подведение итогов, домашнее задание |
| Этап 5.1. Рефлексия |
| Введите рекомендации для учителя по организации в классе рефлексии по достигнутым либо недостигнутым образовательным результатам |
| Перед учащимися ставятся вопросы: какая цель была поставлена на уроке? (изучить получение и свойства аммиака и научиться применять полученные знания на практике); как вы считаете, достигли поставленных целей? чем заинтересовал вас урок? как вы считаете, всегда ли информация СМИ представлена грамотно? как вы думаете, хорошо быть грамотным и образованным человеком? как вы думаете, пригодятся вам знания, полученные на уроке в жизни? |
| Этап 5.2. Домашнее задание |
| Введите рекомендации по домашнему заданию. |
| Учитель поясняет, что после этого урока учащимся предстоит выполнить практикум, связанный с получением аммиака, изучением его свойств и изучением свойств солей аммония и формулирует домашнее задание: разобрать практическую работу №3 «Получение аммиака и изучение его свойств». Примечание. По итогам урока в рабочую тетрадь учащиеся вклеят эталон «Получение и свойства аммиака» и выполненную самостоятельную работу
|