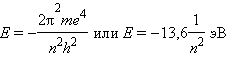Что такое квантовые числа, какие значения они принимают и какие свойства определяют?
Движение электрона в атоме носит вероятностный характер. Околоядерное пространство, в котором с наибольшей вероятностью (0,9—0,95) может находиться электрон, называется атомной орбиталью (АО). Атомная орбиталь, как любая геометрическая фигура, характеризуется тремя параметрами (координатами), получившими название квантовых чисел (n,ℓ,mℓ). Квантовые числа принимают не любые, а определенные, дискретные (прерывные) значения. Соседние значения квантовых чисел различаются на единицу. Квантовые числа определяют размер (n), форму (ℓ) и ориентацию (m1) атомной орбитали в пространстве. Занимая ту или иную атомную орбиталь, электрон образует электронное облако, которое у электронов одного и того же атома может иметь различную форму. Формы электронных облаков аналогичны АО. Их также называют электронными или атомными орбиталями. Электронное облако характеризуется четырьмя квантовыми числами (n, ℓ, mℓ и ms). Эти квантовые числа связаны с физическими свойствами электрона, и число n (главное квантовое число) характеризует энергетический (квантовый) уровень электрона; число ℓ (орбитальное) — момент количества движения (энергетический подуровень), число mℓ (магнитное) — магнитный момент, ms— спин. Спин электрона возникает за счет вращения его вокруг собственной оси. Электроны в атоме должны отличаться хотя бы одним квантовым числом (принцип Паули), поэтому в АО могут находиться не более двух электронов, отличающихся своими спинами (ms = ± 1/2).
Что такое химическая связь? Какие силы объединяют атомы в молекулы? Каковы основные параметры химической связи? Назовите основные типы химической связи.
Химическая связь - это взаимодействие двух атомов, осуществляемое путем обмена электронами. При образовании химической связи атомы стремятся приобрести устойчивую восьмиэлектронную (или двухэлектронную) внешнюю оболочку, соответствующую строению атома ближайшего инертного газа. Различают следующие виды химической связи: ковалентная (полярная и неполярная; обменная и донорно-акцепторная), ионная, водородная и металлическая.
Атомы в молекуле удерживаются химическими связями, возникающими в результате обобществления или перераспределения внешних (валентных) электронов. Каждая обобществленная пара электронов изображается чертой, соединяющей связываемые атомы.
Параметры химической связи
Энергия связи. Химическая связь возникает лишь в том случае, если полная энергия взаимодействующих атомов уменьшается, т.е. при образовании связи должна всегда выделяться энергия.
Количество энергии, выделяющейся при образовании химической связи, называется энергией связи EСВ (кДж/моль).
Энергия связи является мерой прочности связи. Чем больше выделяется энергии при образовании молекулы, тем больше энергии надо затратить на разрыв, т.е. тем молекула прочнее.
Длина связи:
Расстояние между химически связанными атомами называют длиной связи.
Она зависит от размеров электронных оболочек и степени их перекрывания. С уменьшением длины связи обычно растет энергия связи и устойчивость молекул. Например, в ряду от HF до HIдлина связи растет, а ее энергия уменьшается.
Валентный угол – угол, образуемый линиями, проходящими через ядра атомов.
Дайте определение понятию «орбиталь». Какими квантовыми числами полностью определяется орбиталь и электроны на ней? Как изменяется относительная энергия орбиталей, в чем смысл правила Клечковского?
Орбиталь - область пространства внутри атома, в которой сосредоточена большая часть заряда электрона.Орбиталь рассматривается как совокупность вероятных (примерно 90% возможных) положений электрона. Название «орбиталь» (а не орбита) отражает геометрическое представление о стационарных состояниях электрона в атоме, подчеркивая тот факт, что состояния электрона в атоме описывается законами квантовой механики и отличается от классического движения по траектории.
Квантовое число n – главное. Оно определяет энергию электрона в атоме водорода и одноэлектронных системах (He+, Li2+ и т. д.). В этом случае энергия электрона
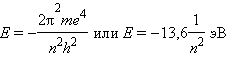
n принимает значения от 1 до ∞. Чем меньше n, тем больше энергия взаимодействия электрона с ядром. При n = 1 атом водорода находится в основном состоянии, при n 1 – в возбужденном.
В многоэлектронных атомах электроны с одинаковыми значениями n образуют слой или уровень, обозначаемый буквами K, L, M, N, O, P и Q. Буква K соответствует первому уровню, L – второму и т. д.
Орбитальное квантовое число l характеризует форму орбиталей и принимает значения от 0 до n – 1. Кроме числовых l имеет буквенные обозначения
| l | = | 0 | 1 | 2 | 3 | 4 | … |
| l | = | s | p | d | f | g | … |
Электроны с одинаковым значением l образуют подуровень.
Правило Клечковского (также Правило n + l; также используется название правило Маделунга) — эмпирическое правило, описывающее энергетическое распределение орбиталей в многоэлектронных атомах.
Правило Клечковского гласит:
| Заполнение электронами орбиталей в атоме происходит в порядке возрастания суммы главного и орбитальногоквантовых чисел  . При одинаковой сумме раньше заполняется орбиталь с меньшим значением . При одинаковой сумме раньше заполняется орбиталь с меньшим значением  . . |
По мере увеличения суммарного числа электронов в атомах (при возрастании зарядов их ядер, или порядковых номеров химических элементов) атомные орбитали заселяются таким образом, что появление электронов на орбитали с более высокой энергией зависит только от главного квантового числа n и не зависит от всех остальных квантовых чисел, в том числе и от l. Физически это означает, что в водородоподобном атоме (в отсутствие межэлектронного отталкивания) орбитальная энергия электрона определяется только пространственной удаленностью зарядовой плотности электрона от ядра и не зависит от особенностей его движения в поле ядра. Поэтому энергетическая последовательность орбиталей в водородоподобном атоме выглядит просто:
1s
Здесь орбитальная энергия электрона повышается только по мере увеличения главного квантового числа и не меняется при увеличении орбитального квантового числа l; состояния с различными значениями l, но с одним и тем же значением n (например, 3s, Зр, 3d) энергетически эквивалентны, то есть соответствующие атомные орбитали (3s, Зр, 3d) обладают одинаковой энергией и оказываются энергетически вырожденными (не следует путать обсуждаемое вырождение по энергии атомных орбиталей различного типа в гипотетических водородоподобных атомах с энергетическим вырождением атомных орбиталей одного и того же типа, например Зрx, Зру и Зрz в реальных изолированных атомах).
В многоэлектронных атомах в результате эффекта межэлектронных взаимодействий происходит энергетическое расщепление (расхождение) орбиталей различного типа, но с одним и тем же значением главного квантового числа (3s

В действительности же расщепление по l, начиная с n≥З, оказывается большим, чем расщепление по n. Сложный характер явления межэлектронных взаимодействий предопределяет сильную зависимость орбитальной энергии каждого электрона уже не только от пространственной удаленности его зарядовой плотности от ядра (от главного квантового числа n), но и от формы его движения в поле ядра (от орбитального квантового числа l). Именно межэлектронное взаимодействие приводит к резко усложнённой (по сравнению с вышеописанной) энергетической последовательности заселяющихся электронами атомных орбиталей. Итак, в реальных многоэлектронных атомах картина энергетического распределения орбиталей оказывается очень сложной. Строгая квантовомеханическая теория электронного строения атомов и экспериментальная спектроскопия обнаруживают энергетическую последовательность атомных орбиталей в следующем виде:

та энергетическая последовательность легко может быть описана при помощи эмпирического правила суммы двух первых квантовых чисел, разработанного в 1951-м году В. М. Клечковским и иногда называемого правилом (n+l). Это правило основано на зависимости орбитальной энергии от квантовых чисел n и l и описывает энергетическую последовательность атомных орбиталей как функцию суммы  . Суть его очень проста:
. Суть его очень проста:
орбитальная энергия последовательно повышается по мере увеличения суммы  , причём при одном и том же значении этой суммы относительно меньшей энергией обладает атомная орбиталь с меньшим значением главного квантового числа
, причём при одном и том же значении этой суммы относительно меньшей энергией обладает атомная орбиталь с меньшим значением главного квантового числа  . Например, при
. Например, при  орбитальные энергии подчиняются последовательности
орбитальные энергии подчиняются последовательности  , так как здесь для
, так как здесь для 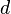 -орбитали главное квантовое число наименьшее
-орбитали главное квантовое число наименьшее  , для
, для  -орбитали
-орбитали  ; наибольшее
; наибольшее  ,
,  -орбиталь занимает промежуточное положение
-орбиталь занимает промежуточное положение  .
.
Или же:
При заполнении орбитальных оболочек атома более предпочтительны (более энергетически выгодны), и, значит, заполняются раньше те состояния, для которых сумма главного квантового числа  и побочного (орбитального) квантового числа
и побочного (орбитального) квантового числа  , т.е.
, т.е.  , имеет меньшее значение.
, имеет меньшее значение.
Правило (n+l) в целом хорошо иллюстрирует таблица 1, где по мере постепенного возрастания суммы (n+l) приведена энергетическая последовательность атомных орбиталей. В этой таблице не указаны нереальные (запрещенные квантовой механикой атома) варианты, для которых не выполняется обязательное требование nl, в частности не указаны комбинации для (n+l)=6:
Что такое атом? Из чего он состоит? Что такое массовое число? Что такое радиоактивность и период полураспада? Приведите пример реакции радиоактивного распада.
А́том (от др.-греч. ἄτομος — неделимый, неразрезаемый) — частица вещества микроскопических размеров и массы, наименьшая часть химического элемента, являющаяся носителем его свойств.
Атом состоит из атомного ядра и электронов. Если число протонов в ядре совпадает с числом электронов, то атом в целом оказывается электрически нейтральным. В противном случае он обладает некоторым положительным или отрицательным зарядом и называется ионом. В некоторых случаях под атомами понимают только электронейтральные системы, в которых заряд ядра равен суммарному заряду электронов, тем самым противопоставляя их электрически заряженным ионам. Ядро, несущее почти всю (более чем 99,9 %) массу атома, состоит из положительно заряженных протонов и незаряженных нейтронов, связанных между собой при помощи сильного взаимодействия. Атомы классифицируются по количеству протонов и нейтронов в ядре: число протонов Z соответствует порядковому номеру атома в периодической системе Менделеева и определяет его принадлежность к некоторому химическому элементу, а число нейтронов N — определённому изотопу этого элемента. Единственный стабильный атом, не содержащий нейтронов в ядре — лёгкий водород (протий). Число Z также определяет суммарный положительный электрический заряд (Ze) атомного ядра и число электронов в нейтральном атоме, задающее его размер.
Поскольку наибольший вклад в массу атома вносят протоны и нейтроны, суммарное число этих частиц называют массовым числом. Массу покоя атома часто выражают в атомных единицах массы (а. е. м.), которая также называется дальтоном (Да). Эта единица определяется как 1⁄12 часть массы покоя нейтрального атома углерода-12, которая приблизительно равна 1,66·10−24 г. Водород-1 — наилегчайший изотоп водорода и атом с наименьшей массой, имеет атомный вес около 1,007825 а. е. м.[18]Масса атома приблизительно равна произведению массового числа на атомную единицу массы. Самый тяжёлый стабильный изотоп — свинец-208 с массой 207,9766521 а. е. м.
Так как массы даже самых тяжёлых атомов в обычных единицах (например, в граммах) очень малы, то в химии для измерения этих масс используют моли. В одном моле любого вещества по определению содержится одно и то же число атомов (примерно 6,022·1023). Это число (число Авогадро) выбрано таким образом, что если масса элемента равна 1 а. е. м., то моль атомов этого элемента будет иметь массу 1 г. Например, углерод имеет массу 12 а. е. м., поэтому 1 моль углерода весит 12 г.
Радиоактивность — это способность атомов некоторых изотопов самопроизвольно распадаться, испуская излучение. Впервые такое излучение, испускаемое ураном, обнаружил Беккерель, поэтому вначале радиоактивные излучения называли лучами Беккереля. Основной вид радиоактивного распада — выбрасывание из ядра атома альфа-частицы — альфа-распад или бета-частицы — бета-распад.
При радиоактивном распаде исходный атом превращается в атом другого элемента. В результате выбрасывания из ядра атома альфа-частицы, представляющей собой совокупность двух протонов и двух нейтронов, массовое число образующегося атома уменьшается на четыре единицы, и он оказывается сдвинутым в таблице Д. И. Менделеева на две клетки влево, так как порядковый номер элемента в таблице равен числу протонов в ядре атома. При выбрасывании бета-частицы (электрон) происходит превращение в ядре одного нейтрона в протон, вследствие чего образующийся атом оказывается сдвинутым в таблице Д. И. Менделеева на одну клетку вправо. Масса его при этом почти не изменяется. Выбрасывание бета-частицы сопряжено обычно с гамма-излучением.
Распад любого радиоактивного изотопа происходит по следующему закону: число распадающихся в единицу времени атомов (n) пропорционально числу атомов (N), имеющихся в наличии в данный момент времени, т. е. n=λN; коэффициент λ, называется постоянной радиоактивного распада и связан с периодом полураспада изотопа (Т) соотношением λ= 0,693/T. Указанный закон распада приводит к тому, что за каждый отрезок времени, равный периоду полураспада Т, количество изотопа уменьшается вдвое. Если образующиеся в результате радиоактивного распада атомы оказываются тоже радиоактивными, то происходит их постепенное накопление, пока не установится радиоактивное равновесие между материнским и дочерним изотопами; при этом число атомов дочернего изотопа, образующихся в единицу времени, равно числу атомов, распадающихся за то же время.
Известно свыше 40 естественных радиоактивных изотопов. Большая часть их расположена в трех радиоактивных рядах (семействах): урана-радия, тория и актиния. Все указанные радиоактивные изотопы широко распространены в природе. Присутствие их в горных породах, водах, атмосфере, растительных и живых организмах обусловливает естественную или природную радиоактивность.
Кроме естественных радиоактивных изотопов, сейчас известно около тысячи искусственно радиоактивных. Получают их путем ядерных реакций, в основном в ядерных реакторах. Многие естественные и искусственно радиоактивные изотопы широко используются в медицине для лечения и особенно для диагностики заболеваний.
88226Ra → 86222Rn + 24He.
Что такое ковалентная связь? Каковы основы метода валентных связей (МВС)? Как определяется взаимодействие атомов в схеме Льюиса? Что такое донорно-акцепторное взаимодействие? Приведите структуры Льюиса для молекул HF, PF3, CCl4, COCl2. 12
Ковалентная связь (атомная связь, гомеополярная связь) — химическая связь, образованная перекрытием(обобществлением) пары валентных электронных облаков. Обеспечивающие связь электронные облака(электроны) называются общей электронной парой.
Термин ковалентная связь был впервые введён лауреатом Нобелевской премии Ирвингом Ленгмюром в1919 году. Этот термин относился к химической связи, обусловленной совместным обладаниемэлектронами, в отличие от металлической связи, в которой электроны были свободными, или от ионнойсвязи, в которой один из атомов отдавал электрон и становился катионом, а другой атом принимал электрони становился анионом.
Позднее (1927 год) Ф.Лондон и В.Гайтлер на примере молекулы водорода дали первое описаниековалентной связи с точки зрения квантовой механики.
С учётом статистической интерпретации волновой функции М.Борна плотность вероятности нахождениясвязывающих электронов концентрируется в пространстве между ядрами молекулы (рис.1). В теорииотталкивания электронных пар рассматриваются геометрические размеры этих пар. Так, для элементовкаждого периода существует некоторый средний радиус электронной пары (Å):
0,6 для элементов вплоть до неона; 0,75 для элементов вплоть до аргона; 0,75 для элементов вплоть докриптона и 0,8 для элементов вплоть до ксенона.
Характерные свойства ковалентной связи — направленность, насыщаемость, полярность, поляризуемость —определяют химические и физические свойства соединений.
Направленность связи обусловлена молекулярным строением вещества и геометрической формы ихмолекулы. Углы между двумя связями называют валентными.
Насыщаемость — способность атомов образовывать ограниченное число ковалентных связей. Количествосвязей, образуемых атомом, ограничено числом его внешних атомных орбиталей.
Полярность связи обусловлена неравномерным распределением электронной плотности вследствиеразличий в электроотрицательностях атомов. По этому признаку ковалентные связи подразделяются нанеполярные и полярные.
Поляризуемость связи выражается в смещении электронов связи под влиянием внешнего электрическогополя, в том числе и другой реагирующей частицы. Поляризуемость определяется подвижностью электронов.Полярность и поляризуемость ковалентных связей определяет реакционную способность молекул поотношению к полярным реагентам.
Электроны тем подвижнее, чем дальше они находятся от ядер. Образование связи
Ковалентная связь образуется парой электронов, поделённой между двумя атомами, причём эти электроныдолжны занимать две устойчивые орбитали, по одной от каждого атома.
A· + ·В → А : В
В результате обобществления электроны образуют заполненный энергетический уровень. Связь образуется,если их суммарная энергия на этом уровне будет меньше, чем в первоначальном состоянии (а разница вэнергии будет ни чем иным, как энергией связи).


Заполнение электронамиатомных (по краям) имолекулярных (в центре)орбиталей в молекуле H2.Вертикальная ось соответствуетэнергетическому уровню,электроны обозначеныстрелками, отражающими ихспины.
Согласно теории молекулярных орбиталей, перекрывание двух атомных орбиталей приводит в простейшемслучае к образованию двух молекулярных орбиталей (МО): связывающей МО и антисвязывающей(разрыхляющей) МО. Обобществленные электроны располагаются на более низкой по энергиисвязывающей МО.
Образование связи при рекомбинации атомов
Основная статья: Межатомное взаимодействие
Атомы и свободные радикалы склонны к рекомбинации — образованию ковалентной связи путёмобобществления двух неспаренных электронов, принадлежащих разным частицами
H + H → H2;
·CH3 + ·CH3 → CH3 — CH3.
Образование связи при рекомбинации сопровождается выделением энергии. Так, при взаимодействииатомов водорода выделяется энергия в количестве 436 кДж/моль. Этот эффект используют в технике приатомно-водородной сварке. Поток водорода пропускают через электрическую дугу, где генерируется потокатомов водорода. Атомы затем вновь соединяются на металлической поверхности, помещаемой нанебольшое расстояние от дуги. Металл может быть таким путём нагрет выше 3500° C. Большимдостоинством «пламени атомного водорода» является равномерность нагрева, позволяющая свариватьочень тонкие металлические детали.[5]
Однако, механизм межатомного взаимодействия долгое время оставался неизвестным. Лишь в 1930 г.Ф.Лондон ввёл понятие дисперсионное притяжение — взаимодействие между мгновенным и наведённым(индуцированными) диполями. В настоящее время силы притяжения, обусловленные взаимодействиеммежду флуктуирующими электрическими диполями атомов и молекул носят название «Лондоновские силы».
Энергия такого взаимодействия прямо пропорциональна квадрату электронной поляризуемости α и обратнопропорциональна расстоянию между двумя атомами или молекулами в шестой степени.[6]
Образование связи по донорно-акцепторному механизму
Кроме изложенного в предыдущем разделе гомогенного механизма образования ковалентной связи,существует гетерогенный механизм — взаимодействие разноименно заряженных ионов — протона H+ иотрицательного иона водорода H-, называемого гидрид-ионом:
H+ + H- → H2
При сближении ионов двухэлектронное облако (электронная пара) гидрид-иона притягивается к протону и вконечном счёте становится общим для обоих ядер водорода, то есть превращается в связывающуюэлектронную пару. Частица, поставляющая электронную пару, называется донором, а частица,принимающая эту электронную пару, называется акцептором. Такой механизм образования ковалентнойсвязи называется донорно-акцепторным.[7]
Распределение электронной плотности между ядрами в молекуле водорода одно и то же, независимо отмеханизма образования, поэтому называть химическую связь, полученную по донорно-акцепторномумеханизму, донорно-акцепторной связью не корректно.
В качестве донора электронной пары, кроме гидрид-иона, выступают соединения элементов главныхподгрупп V—VII групп периодической системы элементов в низшей степени окисления элемента. Так, ещёЙоханнес Брёнстед установил, что протон не существует в растворе в свободном виде, в воде он образуеткатион оксония:
H+ + H2O → H3O+
Протон атакует неподелённую электронную пару молекулы воды и образует устойчивый катион,существующий в водных растворах кислот.[8]
Аналогично происходит присоединение протона к молекуле аммиака с образованием комплексного катионааммония:
NH3 + H+ → NH4+
Таким путём (по донорно-акцепторному механизму образования ковалентной связи) получают большойкласс ониевых соединений, в состав которого входят аммониевые, оксониевые, фосфониевые,сульфониевые и другие соединения.[9]
В качестве донора электронной пары может выступать молекула водорода, которая при контакте с протономприводит к образованию молекулярного иона водорода H3+:
H2 + H+ → H3+
Связывающая электронная пара молекулярного иона водорода H3+ принадлежит одновременно трёмпротонам.
Виды ковалентной связи
Существуют три вида ковалентной химической связи, отличающихся механизмом образования:
1. Простая ковалентная связь. Для ее образования каждый из атомов предоставляет по одномунеспаренному электрону. При образовании простой ковалентной связи формальные заряды атомовостаются неизменными.
Если атомы, образующие простую ковалентную связь, одинаковы, то истинные заряды атомов в молекулетакже одинаковы, поскольку атомы, образующие связь, в равной степени владеют обобществлённойэлектронной парой. Такая связь называется неполярной ковалентной связью. Такую связь имеют простыевещества, например: О2, N2, Cl2. Но не только неметаллы одного типа могут образовывать ковалентнуюнеполярную связь. Ковалентную неполярную связь могут образовывать также элементы-неметаллы,электроотрицательность которых имеет равное значение, например в молекуле PH3 связь являетсяковалентной неполярной, так как ЭО водорода равна ЭО фосфора.
Если атомы различны, то степень владения обобществленной парой электронов определяется различием вэлектроотрицательностях атомов. Атом с большей электроотрицательностью сильнее притягивает к себепару электронов связи, и его истинный заряд становится отрицательным. Атом с меньшейэлектроотрицательностью приобретает, соответственно, такой же по величине положительный заряд. Еслисоединение образуется между двумя различными неметаллами, то такое соединение называетсяковалентной полярной связью.
2. Донорно -акцепторная связь. Для образования этого вида ковалентной связи оба электронапредоставляет один из атомов — донор. Второй из атомов, участвующий в образовании связи, называетсяакцептором. В образовавшейся молекуле формальный заряд донора увеличивается на единицу, аформальный заряд акцептора уменьшается на единицу.
3. Семиполярная связь.Её можно рассматривать как полярную донорно-акцепторную связь. Этот видковалентной связи образуется между атомом, обладающим неподелённой парой электронов (азот, фосфор,сера, галогены и т. п.) и атомом с двумя неспаренными электронами (кислород, сера). Образованиесемиполярной связи протекает в два этапа:
1. Перенос одного электрона от атома с неподелённой парой электронов к атому с двумя неспареннымиэлектронами. В результате атом с неподелённой парой электронов превращается в катион-радикал(положительно заряженная частица с неспаренным электроном), а атом с двумя неспареннымиэлектронами — в анион-радикал (отрицательно заряженная частица с неспаренным электроном).
2. Обобществление неспаренных электронов (как в случае простой ковалентной связи).
При образовании семиполярной связи атом с неподелённой парой электронов увеличивает свойформальный заряд на единицу, а атом с двумя неспаренными электронами понижает свой формальный заряд на единицу.
Н – F