Просмотр содержимого документа
«Типы химических реакций (обобщающий урок) 8 класс»

Муниципальное образовательное учреждение Верхнеднепровская средняя общеобразовательная школа № 2 Дорогобужского района Смоленской области
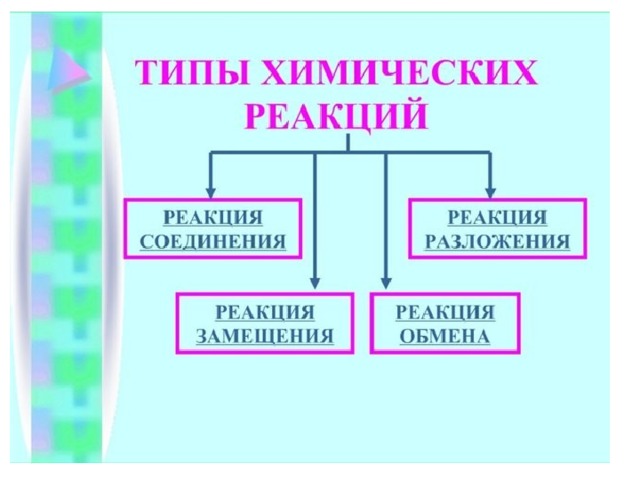
Типы химических
реакций
обобщающий урок
8 класс
презентация подготовлена учителем химии- биологии
Персианиновой Еленой Александровной

Цели и задачи урока
- Цель урока: систематизация, закрепление и обобщение знаний учащихся по заданной теме урока.
- Задачи:
- Образовательные
- проверить глубину и прочность усвоения учащимися основных типов химических реакций;
- выявить типичные ошибки и пробелы в знаниях с целью их последующего устранения;
- закрепить и развить умения в написании химических уравнений, расстановке коэффициентов, определения типа реакции;
- закрепить умение обращаться с химической посудой и веществами.
- Развивающие
- формировать умения выделять главное, существенное, логически излагать материал;
- развить речевые навыки, способности к анализу
- развить навыки самостоятельной работы;
- развитие познавательных способностей, мышления, внимания, умения использовать изученный материал для познания нового.
- Воспитательные
- воспитывать аккуратность и наблюдательность при выполнении практических заданий;
- воспитывать самостоятельность.

Остановка «Угадайка» 1
Уравнение реакции
Реакция соединения
N 2 +H 2 =NH 3
н
Zn + HCl = ZnCl 2 + H 2
Реакция разложения
б
Реакция обмена
п
KOH+H 2 SO 2 =K 2 SO 4 +H 2 O
Реакция замещения
р
Fe(OH) 3 =Fe 2 O 3 +H 2 O
ы
ц
г
б
Al 2 O 3 +HCl=AlCl 3 +H 2 O
и
т
а
р
ж
Mg + CuCl 2 = MgCl 2 + Cu
т
а
ю
н
я
л
и
у
о
м
й

Остановка «Угадайка» 2
Уравнение реакции
Реакция соединения
Mg + HCl = MgCl 2 + H 2
б
Fe + S= FeS
Реакция разложения
я
Реакция обмена
л
NaOH+H 2 SO 2 =Na 2 SO 4 +H 2 O
Реакция замещения
п
CaCO 3 =CaO+CO 2
р
у
с
щ
Na +Cl 2 =NaCl
ш
м
т
к
и
Mg + CuCl 2 = MgCl 2 + Cu
г
м
е
и
ф
ч
р
т
у
д
й

Остановка «Угадайка»3
Уравнение реакции
Реакция соединения
Mg + H 2 SO 4 = MgSO 4 + H 2
и
H 2 +O 2 =H 2 O
Реакция разложения
е
Реакция обмена
п
NaOH+HNO 3 =NaNO 3 +H 2 O
Реакция замещения
о
CaCO 3 =CaO+CO 2
б
м
т
ф
Al +Cl 2 =AlCl 3
ф
л
ч
к
и
CuCl 2 + NaOH=NaCl+ Cu(OH) 2
г
и
м
к
р
ц
в
б
й
я
о

Остановка «Угадайка» 4
Уравнение реакции
Реакция соединения
Al+I 2 =Al I 3
м
K + S= K 2 S
Реакция разложения
е
Реакция обмена
п
Ba(OH) 2 +H 2 SO 2 =BaSO 4 +H 2 O
Реакция замещения
р
Cu(OH) 2 =CuO+H 2 O
б
к
ж
ц
Na 2 CO 3 +CaCl 2 =CaCO 3 +NaCl
н
щ
г
а
я
Fe + CuCl 2 = FeCl 2 + Cu
т
с
а
ю
о
и
л
в
у
р
л

Остановка « Химическая лаборатория»
Лаборатория № 1
Zn+ 2 HCL=ZnCL 2 +H 2
Лаборатория № 2
NH 4 Cl+NaOH=NaCl+NH 3 +H 2 O
Лаборатория № 3
2Cu + O 2 = 2CuO
Лаборатория № 4
NaOH + HCl = NaCl + H 2 O

Остановка: музей- «Химической реакции»
ЗЕЛЕНЫЙ ЗАЛ
- А) 4 Al +3 O 2 =2 Al 2 O 3 - РЕАКЦИЯ СОЕДИНЕНИЯ
- Б ) 6HCl+Cr 2 O 3 =2CrCL 3 +3H 2 O - РЕАКЦИЯ ОБМЕНА
- В) CuO+H 2 =Cu+H 2 O -РЕАКЦИЯ ЗАМЕЩЕНИЯ

Остановка- музей «Химической реакции»
СИНИЙ ЗАЛ
А ) Al(NO 3 ) 3 +3KOH=3KNO 3 +Al(OH) 3 - Реакция обмена
Б) Fe(OH) 2 =FeO+H 2 O- Реакция разложения
В) 2Cu + O 2 = 2CuO- Реакция соединения

Остановка- музей «Химической реакции»
КРАСНЫЙ ЗАЛ
A) 2Na+2 H 2 O= 2NaOH+H 2 - реакция замещения
Б) 6Li+ N 2 = 2Li 3 N - реакция соединения
В) Na 2 SO 4 +BaCl 2 =BaSO 4 +2NaCl - реакция обмена

3. 2 Mg + Cr 2 O 3 =2 MgO +3 Cr - обмена
4. BaO+2H 2 O=Ba(OH) 2 - обмена
2.6 Al ( OH ) 3 = 6 AL 2 O 3 +9 H 2 O -соединение
1.3KOH+2 Fe(NO 3 ) 3 =3KNO 3 + 2Fe(OH) 3 - разложение
Остановка « Исправляйка»

Остановка « Исправляйка»
Правильные ответы:
6 KOH +2 Fe ( NO 3 ) 3 =6 KNO 3 + 2 Fe ( OH ) 3 -обмен
2 Al ( OH ) 3 = AL 2 O 3 +3 H 2 O -разложение
3 Mg + Cr 2 O 3 =3 MgO +2 Cr - замещения
BaO + H 2 O = Ba ( OH ) 2 -соединения

Остановка «Прощальная»
Что лишнее:
- 2Mg+O 2 =2MgO
- SO 3 +H 2 O=H 2 SO 4
- Ca(OH) 2 +2HCL=CaCl 2 +2H 2 O

Остановка «Прощальная»
Крестики – нолики
BaCO 3 =BaO+CO 2
2H 2 O=2H 2 +O 2
2KNO 3 =2KNO 2 +O 2
P 2 O 5 +3H 2 O=2H 3 PO 4
2Fe(OH) 3 =Fe 2 O 3 +3H 2 O
HI+ NaOH=NaI+H 2 O
HNO 3 +KOH=KNO 3 +H 2 O
Fe+2HCl=FeCl 2 +H 2
NH 4 NO 3 =NH 3 +HNO 3

Домашнее задание
Повторить параграфы 27-32
Спасибо вам за хорошую, плодотворную и интересную работу.

































