Тренировочный вариант экзаменационной работы для
подготовки к ОГЭ для учащихся 9 классов.
Цель:
познакомить учащихся со структурой экзаменационной работы;
проверить знания учащихся по химии в ходе подготовки к ОГЭ;
выявитьпробелы, ошибки, которые допускают обучающиеся при выполнении тестовых заданий.
Вопросы составлены в соответствии со спецификацией КИМов-2016 по химии учащихся, освоивших основные общеобразовательные программы основного общего образования.
Методические рекомендации: Предлагаемый тест может использоваться для подготовки к ОГЭ учащихся 9 классов и для пробного тестирования участников ОГЭ по химии.
Использованные учебники и интернет - ресурсы:
Н.Е. Кузнецова «Химия 9 класс» Вентана Граф 2010г
Н.Е. Кузнецова «Химия 8 класс» Вентана Граф 2010г
Открытый БАНК заданий по химии ОГЭ
«Сдам ОГЭ»
http://reshuoge.ru/
http://opengia.ru/subjects/chemistry-9/topics/1
Инструкция по выполнению работы
На выполнение работы отводится 2 часа (120 минут). Работа состоит из 3 частей, содержащих 22 задания.
Часть 1 содержит 15 заданий (1-15). К каждому заданию даётся 4 варианта ответа, один из которых, верный.
Часть 2 состоит из 4 заданий (16-19), на которые нужно дать краткий ответ в виде набора цифр. Для заданий части 2 ответ записывается в виде набора цифр.
Часть 3 включает 3 задания (20, 21, 22), выполнение которых предполагает написание полного, развёрнутого ответа, включающего необходимые уравнения реакций и расчёты.
При выполнении работы Вы можете пользоваться Периодической системой химических элементов Д.И. Менделеева, таблицей растворимости солей, кислот и оснований в воде, электрохимическим рядом напряжений металлов и непрограммируемым калькулятором.
Часть 1
К каждому из заданий 1-15 даны четыре варианта ответа, из которых только один верный. Номер этого ответа внесите в квадрат.
1. Химическому элементу 3-го периода VA-группы соответствует схема распределения электронов по слоям:
1) 2, 8, 5
2) 2, 8, 3
3) 2, 5
4) 2, 3
Ответ:
2. Основные свойства оксида магния выражены сильнее, чем основные свойства
1) оксида бериллия
2) оксида натрия
3) оксида кальция
4) оксида калия
Ответ:
3. Соединениями с ковалентной неполярной и ионной связью являются соответственно
1) оксид фосфора и оксид натрия
2) хлорид натрия и хлор
3) азот и сульфид натрия
4) хлорид кальция и хлороводород
 Ответ:
Ответ:
4. Вещество, в котором степень окисления атомов серы равна +4, имеет формулу
1) H2SО4 3) SO2
2) Al2(SO4)3 4) H2S
 Ответ:
Ответ:
5. Даны вещества: сера, белый фосфор и азотная кислота. Среди них к простым веществам относится(-ятся)
1) только сера
2) только белый фосфор
3) белый фосфор и азотная кислота
4) сера и белый фосфор
 Ответ:
Ответ:
6. Выберите верную запись правой части уравнения диссоциации нитрата железа(III)
1) = Fe3+ + 3NO3-
2) = Fe3+ + NO3-
3) = 3Fe3+ + NO3-
4) = 3Fe3+ + 3NO3-
 Ответ:
Ответ:
7. Одинаковое число молей катионов и анионов образуются при полной диссоциации в водном растворе 1 моль
1) Na3PO4 3) Ba(NO3)2
2) MgSO4 4) (NН4)2SO4
 Ответ:
Ответ:
8. Практически полностью в водном растворе взаимодействуют вещества:
нитрат серебра и хлороводород
нитрат кальция и хлорид калия
хлороводород и нитрат натрия
хлороводород и нитрат калия
 Ответ:
Ответ:
9. Кислород непосредственно не взаимодействует
хлором
фосфором
серой
железом
 Ответ:
Ответ:
10. И оксид алюминия, и оксид натрия реагируют с
водой
соляной кислотой
водородом
гидроксидом калия
 Ответ:
Ответ:
11. При нагревании гидроксид меди(II) вступает в реакцию
1) соединения
2) замещения
3) разложения
4) горения
 Ответ:
Ответ:
12. При взаимодействии растворов силиката натрия и соляной кислоты образуется(-ются) хлорид натрия и




 Ответ:
Ответ:
13. Верны ли суждения о безопасном обращении с химическими веществами?
А. Разбитый ртутный термометр и вытекшую из него ртуть следует выбросить в мусорное ведро.
Б. Красками, содержащими ионы свинца, не рекомендуется покрывать детские игрушки и посуду.
1) верно только А
2) верно только Б
3) верны оба утверждения
4) оба утверждения неверны
 Ответ:
Ответ:
14.
На рисунке изображён способ получения

1) сернистого газа
2) водорода
3) аммиака
4) хлороводорода
 Ответ:
Ответ:
15. На какой диаграмме распределение массовых долей элементов соответствует количественному составу нитрату серебра?
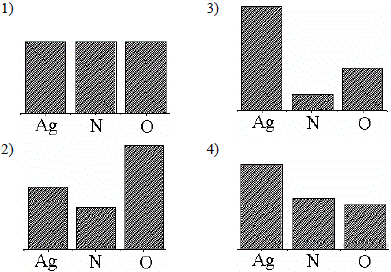
 Ответ:
Ответ:
Часть 2
При выполнении заданий 16 и 17 из предложенного
перечня ответов выберите два правильных.
16. В ряду химических элементов 
1) увеличивается заряд ядер атомов
2) возрастают кислотные свойства образуемых гидроксидов
3) увеличивается число электронных уровней
4) уменьшается электроотрицательность
5) возрастает атомный радиус

 Ответ:
Ответ:
17. Для этилена верны следующие утверждения:
1) относительная молекулярная масса равна 26
2) является непредельным углеводородом
3) атомы углерода в молекуле соединены одинарной связью
4) вступает в реакции замещения
5) вступает в реакцию полимеризации
![]()
 Ответ:
Ответ:
При выполнении заданий 18 – 19 к каждому элементу первого
столбца подберите соответствующий элемент из второго
столбца. Цифры в ответе могут повторяться.
18. Установите соответствие между веществами и реактивом, с помощью которого можно различить эти вещества. К каждому элементу первого столбца подберите соответствующий элемент из второго столбца.
ВЕЩЕСТВА РЕАКТИВ
A) K2SО4 и FeSO4 1) Сa(OH)2
Б) KI и NaBr 2) NaCl
B) NH4Cl и NaCl 3) Cu
4) AgNO3
Ответ:
19. Установите соответствие между схемой химической реакции и веществом-восстановителем в этой реакции.
| СХЕМА РЕАКЦИИ | ВОССТАНОВИТЕЛЬ |
| A)  | 1)  |
| Б) | 2) |
| B) | 3)  |
|
| 4)  |
|
| 5)  |
Ответ:
Часть 3
Для ответов на задания 20 -22 используйте отдельный лист. Запишите сначала номер задания (20, 21, 22), а затем развёрнутый ответ к нему. Ответы записывайте чётко и разборчиво.
20. Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции, схема которой
Определите окислитель и восстановитель.
21. После пропускания 11,2 л (н. у.) аммиака через 10-процентный раствор серной кислоты получили раствор средней соли. Определите массу исходного раствора серной кислоты.
22. Для определения качественного состава учащимся было выдано бесцветное кристаллическое вещество — соль. К одной части раствора исследуемой соли прилили раствор нитрата серебра, в результате чего выпал осадок жёлтого цвета. А при добавлении к другой части раствора карбоната натрия выпал белый осадок.
Известно, что катион этой соли образован щёлочно-земельным металлом, входящим в состав костной ткани человека. Анион этой соли состоит из атомов химического элемента, образующего простое вещество, спиртовой раствор которого используется в качестве дезинфицирующего средства.
Определите состав и запишите название соли. Запишите два уравнения реакций, которые были проведены учащимися в процессе определения качественного состава неизвестного вещества.
Система оценивания тестовой работы по химии
Верное выполнение каждого из заданий части 1 базового уровня сложности (1–15) оценивается 1 баллом.
Верное выполненное каждого из заданий части 1 повышенного уровня сложности (16–19) максимально оценивается 2 баллами. Задания 16 и 17 считаются верно выполненными, если в каждом из них правильно выбраны два варианта ответа. За неполный ответ – правильно назван один из двух ответов или названы три ответа, из которых два верные, – выставляется 1 балл. Остальные варианты ответов считаются неверными и оцениваются в 0 баллов.
Задания 18 и 19 считаются выполненными верно, если правильно установлены три соответствия. Частично верным считается ответ, в котором установлены два соответствия из трех; он оценивается 1 баллом. Остальные варианты считаются неверным ответом и оцениваются в 0 баллов.
Ответы:
| № задания | Ответ | № задания | Ответ |
| 1 | 1 | 11 | 3 |
| 2 | 1 | 12 | 3 |
| 3 | 3 | 13 | 2 |
| 4 | 3 | 14 | 2 |
| 5 | 4 | 15 | 3 |
| 6 | 1 | 16 | 12 |
| 7 | 2 | 17 | 25 |
| 8 | 1 | 18 | 141 |
| 9 | 1 | 19 | 531 |
| 10 | 2 |
|
|
Критерии оценивания заданий с развёрнутым ответом
20. Используя метод электронного баланса, составьте уравнение реакции
Определите окислитель и восстановитель.
| Элементы ответа (допускаются иные формулировки ответа, не искажающие его смысл) |
|  H2S-2+KCl+5 O3 S0 +KCl- +H2O H2S-2+KCl+5 O3 S0 +KCl- +H2O ![]() Составлен электронный баланс: Составлен электронный баланс: 3 S-2-2e = S0 восстановитель 1 Cl+5 -+6e = Cl- окислитель  Расставлены коэффициенты: 3H2S-2+KCl+5 O3 3S0 +KCl- +3H2O Расставлены коэффициенты: 3H2S-2+KCl+5 O3 3S0 +KCl- +3H2O
|
| Указано, что S0 является восстановителем, Cl+5 является окислителем. |
| Критерии оценивания | Баллы |
| Ответ правильный и полный, включает все названные элементы | 3 |
| Составлен электронный баланс, не определен окислитель и восстановитель | 2 |
| Электронный баланс составлен, неверно расставлены коэффициенты | 1 |
| Все элементы ответа записаны неверно | 0 |
| Максимальный балл | 3 |
21. После пропускания 11,2 л (н. у.) аммиака через 10-процентный раствор серной кислоты получили раствор средней соли. Определите массу исходного раствора серной кислоты.
| Элементы ответа (допускаются иные формулировки ответа, не искажающие его смысл) |
| 1) Составлено уравнение взаимодействия аммиака и серной кислотой:
2NH3 + H2SO4 =(NH4)2SO4 2) Рассчитано количество газа: n(NH3)= 11,2 л : 22,4 л/моль = 0,5 моль 3) Определены количество кислоты:0,5моль: 2 =0,25 моль m(H2SO4) = 98 г/моль • 0,25 моль = 24,5г Находим массу раствора кислоты: 24,5:0,1 =245г
Ответ: масса исходного раствора кислоты равна 245г |
| Критерии оценивания | Баллы |
| Ответ правильный и полный, включает все названные элементы | 3 |
| Правильно записаны 2 элемента из названных выше | 2 |
| Правильно записан 1 элемент из названных выше (1-ый или 2-ой) | 1 |
| Все элементы ответа записаны неверно | 0 |
| Максимальный балл | 3 |
22. . Для определения качественного состава учащимся было выдано бесцветное кристаллическое вещество — соль. К одной части раствора исследуемой соли прилили раствор нитрата серебра, в результате чего выпал осадок жёлтого цвета. А при добавлении к другой части раствора карбоната натрия выпал белый осадок.
Известно, что катион этой соли образован щёлочно-земельным металлом, входящим в состав костной ткани человека. Анион этой соли состоит из атомов химического элемента, образующего простое вещество, спиртовой раствор которого используется в качестве дезинфицирующего средства.
Определите состав и запишите название соли. Запишите два уравнения реакций, которые были проведены учащимися в процессе определения качественного состава неизвестного вещества
| Элементы ответа (допускаются иные формулировки ответа, не искажающие его смысл) |
| Рассуждения: щелочно-земельный металл, входящий в состав костной ткани –это кальций. Анион, выподающий в виде жёлтого осадка AgI это I- .При добавлении карбоната натрия выпадает белый осадок карбоната кальция. Исходная соль йодид кальция  Составлены 2 уравнения реакций, Указаны признаки химических реакций: Составлены 2 уравнения реакций, Указаны признаки химических реакций:
CaI2 + 2AgNO3 = Ca(NO3)2 +2AgI  CaI2 + Na2CO3 = CaCO3 +2NaI CaI2 + Na2CO3 = CaCO3 +2NaI
|
| Критерии оценивания | Баллы |
| Ответ правильный и полный, включает все названные элементы | 5 |
| Ответ правильный, но допущены неточности в признаках химических реакций | 4 |
| Правильно записаны 3 элемента из названных выше | 3 |
| Правильно записаны 2 элемента из названных выше | 2 |
| Правильно записан 1 элемент из названных выше | 1 |
| Все элементы ответа записаны неверно
| 0 |
| Максимальный балл | 5 |







 Ответ:
Ответ:  Ответ:
Ответ:  Ответ:
Ответ:  Ответ:
Ответ:  Ответ:
Ответ:  Ответ:
Ответ:  Ответ:
Ответ: 
 Ответ:
Ответ: 
 Ответ:
Ответ: 
 Ответ:
Ответ:  Ответ:
Ответ:









