Севастопольское государственное бюджетное образовательное учреждение
профессионального образования
«Севастопольский медицинский колледж имени Жени Дерюгиной»
| «СОГЛАСОВАНО» на заседании ЦМК общеобразовательных дисциплин
Протокол № от «___»___________ 20__.
Председатель ЦМК
Смирнова З. М._______________ | «УТВЕРЖДАЮ» Зам. директора по учебной работе ________________Полстянко Н.Н. «____» _________2020 г.
|
МЕТОДИЧЕСКАЯ РАЗРАБОТКА
ЛАБОРАТОРНОГО ЗАНЯТИЯ
Дисциплина «Химия»
Тема: «Получение метана и изучение его свойств. Получение этилена и изучение его свойств»
Курс – I
Специальность: 34.02.01 Сестринское дело
Количество часов – 2
Автор:
преподаватель химии
Звягинцева О.В.
Севастополь 2020 г.
Севастопольское государственное бюджетное образовательное учреждение
профессионального образования
«Севастопольский медицинский колледж имени Жени Дерюгиной»
Учебно-методическая разработка лабораторного занятия
Учебная дисциплина «Химия»
Тема «Получение метана и изучение его свойств. Получение этилена и изучение его свойств»
Курс: 1
Специальность: 34.02.01 Сестринское дело
Количество учебных часов: 2
Вид занятия (тип) – лабораторное занятие
1. Актуальность темы: углеводороды широко распространены в природе: входят в состав природного газа, нефти, твердых горючих ископаемых. Они лежат в основе всех классов биологически активных веществ, находят широкое применение в органическом синтезе и медицине.
2. Цели занятия
а) Образовательные (обучающие) цели
Знать:
-правила по ТБ при работе в лаборатории с химическими веществами;
-химические свойства метана и этилена;
- получение метана из ацетата натрия и получение этилена из этанола;
-методику проведения опытов получения метана из ацетата натрия и получения этилена из этанола;
- методику проведения опытов галогенирования (обесцвечивания бромной воды) и окисления (обесцвечивания раствора перманганата калия).
Уметь:
-работать в лаборатории, выполняя правила по ТБ;
-собирать простейшие лабораторные установки;
-проводить простейшие лабораторные опыты по получению метана и этилена и опыты, изучающие свойства метана этилена;
-составлять химические уравнения химических свойств и уравнения получения метана и этилена.
б) Развивающие цели:
- развитие умения применять теоретические знания для объяснения способов получения, химизма протекающих реакций;
- развитие познавательных способностей и активности студентов, химического мышления,
творческой инициативы, самостоятельности, ответственности и организованности;
- формирование умения систематизировать, анализировать, выделять главное, обобщать.
в) Воспитательная:
– воспитывать умения работать в лаборатории, соблюдая правила по ТБ;
- воспитывать аккуратность в процессе выполняемой работы;
- воспитывать интерес к органической химии и потребность в приобретении знаний.
Межпредметные связи : общая и неорганическая химия
Формы и методы: репродуктивный, частично-поисковый
2.1 Формирование общих компетенций:
ОК 1. Понимать сущность и социальную значимость своей будущей профессии, проявлять к ней устойчивый интерес.
ОК 2. Организовывать собственную деятельность, выбирать типовые методы и способы выполнения профессиональных задач, оценивать их выполнение и качество.
ОК 3. Принимать решения в стандартных и нестандартных ситуациях и нести за них ответственность;
ОК 4. Осуществлять поиск и использование информации, необходимой для эффективного выполнения профессиональных задач, профессионального и личностного развития.
ОК 5. Использовать информационно-коммуникационные технологии в профессиональной деятельности.
ОК 6. Работать в коллективе и команде, эффективно общаться с коллегами, руководством, потребителями.
ОК 7. Брать на себя ответственность за работу членов команды (подчиненных), результат выполнения
ОК 8. Самостоятельно определять задачи профессионального и личностного развития, заниматься самообразованием, осознанно планировать и осуществлять повышение квалификации.
3. Содержание лабораторной работы
План
I. Получение и изучение свойств метана
I I. Получение и изучение свойств этилена
4. Организационно-деятельностная структура занятия
| №
п/п | Основные этапы занятия, их функции и содержание | Деятельность обучающихся | Деятельность преподавателя | Время в мин. |
| 1 | 2 | 3 | 4 | 5 |
| I | Подготовительный этап 1. Организация занятия:
- проверка внешнего вида, заполнение журнала.
2. Постановка учебных целей и мотивация занятия.
3. Контроль исходного уровня знаний, навыков, умений:
|
Проверяют готовность рабочего места к практическому занятию.
Принятие и осмысление целей занятия, сосредоточение внимания. Отвечают устно (фронтальный опрос)
|
Проверка готовности к занятию, фиксация отсутствующих; Проводит инструктаж по выполнению работы (последовательность и аккуратность); Объявляет тему, план и мотивацию занятия. Обращает внимание на актуальность темы.
Опрашивает, оценивая исходные знания студентов: 1. Что такое углеводороды? Какие известны классы углеводородов? 2. Что такое алканы? Назовите гомологический ряд алканов, приведите примеры в структурном виде. 3. Какие типы реакций характерны для предельных углеводородов? По какому механизму они протекают? 4. Что такое алкены? Назовите гомологический ряд алкенов, приведите примеры в структурном виде. 5. Какие типы реакций характерны для алкенов? |
3'
10'
|
| II | Основной этап. Самостоятельная аудиторная работа студентов
| Проводят опыты, соблюдая правила по ТБ, записывают в рабочие тетради наблюдения и выводы, приводят в порядок посуду, реактивы и лабораторный стол. (Приложение 1) |
Контролирует и направляет самостоятельную аудиторную работу студентов на занятии.
| 50'
|
| III | Заключительный этап
1. Контроль и коррекция уровня умений и навыков.
Тесты итогового контроля.
2. Рефлексия результатов обучения.
Подведение итогов занятия.
3.Домашнее задание. |
Отвечают на тесты конечного уровня знаний. (Приложение 2) Подведение общих итогов, в том числе дают ответ на вопрос: достигнуты ли намеченные цели? Осмысление и уточнение полученного домашнего задания. Задают вопросы. |
Оценка результатов занятия:
- тестовый контроль;
- проверка результатов самостоятельной работы студентов по тетрадям.
Оценка учебного занятия преподавателем. Выставляет оценки. Проводит инструктаж по домашнему заданию. Объявляет задания. |
15'
5'
5' |
5. Материалы домашнего задания студентов по теме занятия: Ерохин Ю.М.Химия для профессий и специальностей технического и естественно-научного профилей: учебник для студ.учреждений сред.проф.образования/Ю.М.Ерохин, И.Б.Ковалева. – 2-е изд., стер. – М.: Издательский центр «Академия»; 2014, стр.334-348.
ЛИТЕРАТУРА
Основная:
1. Ерохин Ю.М. Химия для профессий и специальностей технического и естественно-научного профилей: учебник для студ.учреждений сред.проф.образования/Ю.М.Ерохин, И.Б.Ковалева. – 2-е изд., стер. – М.: Издательский центр «Академия»; 2014
2. Химия: практикум: учебное пособие для студ.учреждений сред.проф.образования /[О.С.Габриелян, И.Г. Остроумов, С.А. Сладков, Н.М. Дорофеева]; под ред. О.С. Габриеляна. – 3-е изд., стер. – М.: Издательский центр «Академия», 2014. – 304 с.
Приложение 1.
Инструкционно-технологическая карта на выполнение лабораторной работы № 8.
Лабораторная работа № 8
Тема: Получение метана и изучение его свойств. Получение этилена и изучение его свойств
Цели работы : познакомиться с лабораторными способами получения метана и этилена и изучить их свойства.
Реактивы и оборудование: ацетат натрия, натронная известь, раствор перманганата калия, раствор бромной воды, этиловый спирт, серная кислота, песок, горелка, ступка, пестик, стеклянная лопатка, прибор для получения газа, металлический штатив, штатив с пробирками.
Ход работы :
Опыт 1. Получение и изучение свойств метана
В две пробирки налейте по 2мл подкисленного раствора перманганата калия (1–2 капли концентрированной серной кислоты) и раствора бромной воды.
В ступке тщательно перемешайте натронную известь с ацетатом натрия и поместите смесь в сухую пробирку (высота слоя 6 -10 мм). Натронная известь представляет собой смесь гидроксида натрия с гидроксидом кальция в отношении 1:2 для предотвращения разрушения стекла щелочью
Закройте пробирку пробкой с газоотводной трубкой. Опустите конец газоотводной трубки в раствор перманганата калия. Укрепите пробирку в зажиме штатива горизонтально и нагрейте смесь в пламени горелки. Пропустите метан поочередно через подкисленный раствор перманганата калия и бромную воду. Пропускание газа проводят в течение 20–30 с
Вопросы и задания
1 Как изменяется окраска растворов перманганата калия и бромной воды при пропускании через них метана? Что наблюдаете? Дайте объяснение.
2. Составьте уравнение реакции получения метана
3. Сделайте вывод о химической активности алканов на примере метана по его отношению к цветным реактивам.
Опыт 2. Получение и изучение свойств этилена
В сухую пробирку поместите две стеклянные лопатки сухого песка, налейте 1 мл этанола и осторожно 3 мл концентрированной серной кислоты, закройте пробирку пробкой с газоотводной трубкой, закрепите ее в штативе и осторожно нагрейте содержимое пробирки, не допуская сильных толчков реакционной смеси.
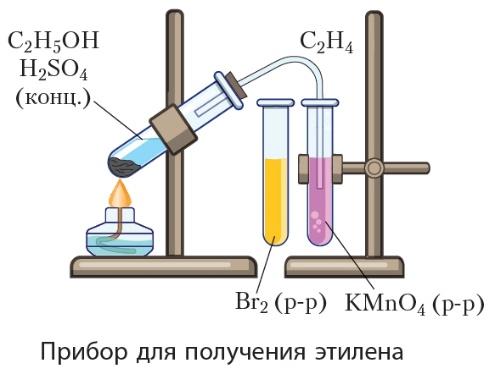 Пропустите выделяющийся газ поочередно через подкисленный раствор перманганата калия и бромную воду.
Пропустите выделяющийся газ поочередно через подкисленный раствор перманганата калия и бромную воду.
Опыт 3. Окисление этилена кислородом воздуха (горение).
Вынув газоотводную трубку из раствора и повернув ее отверстием кверху, подожгите выделяющийся газ.
Вопросы и задания
1. Как изменяется окраска растворов перманганата калия и бромной воды при пропускании через них этилена? Что наблюдаете? Дайте объяснение. Напишите уравнения проведенных реакций.
2. Каким пламенем горит этилен? Почему?
Сделайте общий вывод о проделанной работе.
Приложение 2.
Тесты итогового контроля
1 вариант
Формулы только алканов записаны в ряду:
а) C4H10 , C2H6 , C3H8
б) C2H2 , C3H8 , C6H6
в) C3H6 , C2H4 , C6H14
г) C6H6 , C4H8 , C2H6 ?
При гидрировании алкенов образуются:
а) алканы б) алкины в) алкадиены г) спирты
Укажите валентный угол в молекуле этена:
а) 120° б) 109° 28' в) 90° г) 180°
Общая формула алкенов:
а) CnH2n+2 б) CnH2n в) CnH2n-2 г) CnHn
Этиленовые углеводороды можно отличить от алканов с помощью
а) бромной воды б) медной спирали в) этанола г) лакмуса
Сколько атомов водорода имеет этот углеводород С–С–С–С–С?
а) 9 б) 10 в) 11 г) 12
Формула гомолога бутана:
а) С5Н8 б) С5Н10 в) С5Н12
Соединения, сходные по химическим свойствам, составу, отличающиеся группой (-СН2-), называют:
а) аналогами б) гомологами в) изомерами г) углеводородами
Углеводород СН3-СН(С2Н5)-СН2-С(СН3)2-СН3 имеет такое систематическое название:
а) 2-этил-4,4-диметилпентан; б) 2,2-диметил-4-этилпентан;
в) 1,1,1,3-тетраметилпентан; г) 2,2,4-триметилгексан
Выберите три верных ответа.
Алкены могут реагировать с:
а) водородом б) натрием в) гидроксидом натрия
г) бромом д) бромоводородом е) метаном
2 вариант
Формулы только алкенов записаны в ряду:
а) C3H6 , C2H4 , C6H12
б) C4H10 , C2H6 , C3H6
в) C2H2 , C3H8 , C6H6
г) C6H6 , C4H8 , C2H6 ?
Превращение бутана в бутен относится к реакции:
а) полимеризации б) дегидрирования в) дегидратации г) изомеризации
Укажите валентный угол в молекуле этана:
а) 120° б) 109° 28' в) 90° г) 180°
Общая формула алканов:
а) CnH2n+2 б) CnH2n в) CnH2n-2 г) CnHn
Отличить этен от этана можно с помощью любого из реактивов:
а) бромная вода и водород б) р-р KMnO 4 и Cu(ОН) 2
в) р-р KMnO4 и бромная вода г) хлор и водород
Сколько атомов водорода имеет этот углеводород С–С=С–С–С?
а) 9 б) 10 в) 11 г) 8
Формула гомолога пентана:
а) С3Н8 б) С3Н4 в) С3Н6
Вещества одинакового состава, но различного строения и с различными свойствами называют:
а) изотопами б) гомологами в) изомерами г) аналогами
Углеводород СН3СН=С(СН3)С(СН3)2СН2СН3 имеет такое систематическое название:
а) 3,4,4- триметилгексен -1 б) 3,4-диметилгексен-2
в) 3,4,4- триметилгексен-2 г) 3,3,4 триметилпентен-3
И бутан, и бутен вступают в реакцию с
а) хлором б) бромной водой в) водородом г) раствором перманганата калия
Ответы на тесты:
|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Вариант 1 | а | а | а | б | а | г | в | б | г | агд |
| Вариант 2 | а | б | б | а | в | б | а | в | в | а |






 Пропустите выделяющийся газ поочередно через подкисленный раствор перманганата калия и бромную воду.
Пропустите выделяющийся газ поочередно через подкисленный раствор перманганата калия и бромную воду. 









