© 2021, Цыганкова Татьяна Геннадиевна 426 2


СДЕЛАЙТЕ СВОИ УРОКИ ЕЩЁ ЭФФЕКТИВНЕЕ, А ЖИЗНЬ СВОБОДНЕЕ
Благодаря готовым учебным материалам для работы в классе и дистанционно
Скидки до 50 % на комплекты
только до
Готовые ключевые этапы урока всегда будут у вас под рукой
Организационный момент
Проверка знаний
Объяснение материала
Закрепление изученного
Итоги урока

Учебное пособие по химии для поступающих в СПО
Приступая к самостоятельному изучению курса химия, следует руководствоваться тем, чтобы усвоить основные химические законы, понятия и теории, знать терминологию предмета и общую характеристику важнейших элементов и их основных соединений, умело пользоваться периодической системой элементов Д.И.Менделеева, знать строение атома, типы химических связей и окислительно-восстановительные реакции, безошибочно решать задачи на выражение концентрации растворов.
Просмотр содержимого документа
«Учебное пособие по химии для поступающих в СПО»




Уважаемый абитуриент!
Приступая к самостоятельному изучению курса химия, следует руководствоваться тем, чтобы усвоить основные химические законы, понятия и теории, знать терминологию предмета и общую характеристику важнейших элементов и их основных соединений, умело пользоваться периодической системой элементов Д.И.Менделеева, знать строение атома, типы химических связей и окислительно-восстановительные реакции, безошибочно решать задачи на выражение концентрации растворов.
РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА
О.С. Габриелян,. Химия, 9 класс, М."Дрофа", 2002 г.
О.С. Габриелян, Ф.Н.Маскаев, С.Ю.Пономарев, В.И.Теренин. Химия, 10 класс, М."Дрофа", 2002 г.
О.С. Габриелян, Г.П.Лысова. Химия, 11 класс, М."Дрофа", 2002 г.
Г.П. Хомченко. Пособие по химии для поступающих в ВУЗы, "Высшая школа", 1971.
Я.Л. Гольдфарб, Ю.В. Ходаков. Сборник задач и упражнения по химии, "Просвещение", 1972.
Н.Л. Глинка. Задачи и упражнения по общей химии, "Химия", 1970.
"Репетитор по химии" под ред. А.С.Егорова – Ростов н/Д: изд-во "Феникс", 2004 г.
Примечание: рекомендуемые пособия могут иметь и другие годы издания.
Часть I. ОСНОВЫ ОБЩЕЙ ХИМИИ.
РАЗДЕЛ I.
Основные понятия и законы химии.
Химия – это наука о веществах, свойствах и превращениях.
Химический элемент – это вид атомов, характеризующийся определенным зарядом ядра.
Процесс превращения одних веществ в другие называется химической реакцией.
Химические формулы показывают количественный и качественный состав молекулы.
Молекула – это наименьшая частица вещества, которая сохраняет все его свойства.
Масса любой молекулы равна сумме масс образующих ее атомов. При расчетах пользуются относительными молекулярными массами .
Относительная молекулярная масса (Мr) – это число, которое показывает, во сколько раз абсолютная масса молекулы данного вещества больше 1/12 части абсолютной массы углерода С.
Например: Мr(Н2О) = 2 • Ar(H) + Ar(O)= 2•1 + 16 = 18
Моль (n) – это количество вещества, содержащее столько структурных единиц, сколько содержится в 0,012 кг углерода С.
Количество вещества можно определить по формулам:
![]()
![]()
![]()
![]()
Молярная масса (М) – это масса одного моля вещества. Она численно равна Мr.
По формуле вещества можно рассчитать массовую долю (ω) каждого химического элемента, который входит в состав вещества.
![]()
где ω(Х) – массовая доля элемента Х; Ar(Х) – относительная атомная масса элемента; Mr – относительная молекулярная масса вещества; n- число атомов элемента Х в молекуле вещества.
Например: Рассчитаем массовые доли водорода и кислорода в воде Н2О:
![]()
ω(О) = 100% - ω(Н) = 100% - 11,1% = 88,9%
Зная массовую долю вещества в смеси или в растворе, можно найти массу этого вещества или массу смеси и раствора
![]()
![]()
![]()
Например:
1. Закон сохранения массы вещества
( М.В.Ломоносов, 1748; Лавуазье, 1789)
М.В.Ломоносов, 1748; Лавуазье, 1789)
Масса всех веществ, которые вступают в химическую реакцию, равна массе всех
продуктов реакции.
NaOH + HCl = NaCl + H2O
m1 m2 m3 m4
m1 + m2 = m3 + m4
40 + 36,5 = 58,5 + 18
76,5 = 76,5
В результате реакции атомы не образуются и не исчезают, поэтому общее число атомов каждого вида остается неизменным.
На основе закона сохранения массы веществ расставляют коэффициенты в уравнениях реакций.
2. Закон постоянства состава (Ж.Пруст, 1808 г)
 Каждое вещество имеет постоянный количественный и качественный состав, который не
Каждое вещество имеет постоянный количественный и качественный состав, который не
зависит от способа получения.
3. Закон Авогадро (1811 г.)
 В равных объемах различных газов при одинаковых условиях содержится одинаковое
В равных объемах различных газов при одинаковых условиях содержится одинаковое
число молекул.
П ервое следствие из закона Авогадро.
ервое следствие из закона Авогадро.
Одинаковое число молекул различных газов при одинаковых условиях занимают
одинаковый объем .
Это дает возможность при расчетах газовых реакций вместо количества вещества (n) использовать объемы газов (V).
Второе следствие из закона Авогадро.
Моль любого газа при одинаковых условиях занимает одинаковый объем, называемый молярным (Vm), который при нормальных условиях (н.у.) равен 22,4 л/моль.
Нормальные условия (н.у.): р = 760 мм. рт. ст. =1 атм = 101325 Па
и t = 0°С или 273 К.
Зная молярный объем газа Vm , можно рассчитать объем любого количества n и любой массы m газа:
V=Vm · n V=Vm ·![]()
Рассматривая вопрос – закон Авогадро; – нужно запомнить число Авогадро N=6,02·1023, показывающее число молекул в г-молекуле, число атомов в г-атоме в любом агрегатном состоянии.
Задачи для самостоятельного решения
1.Расставьте коэффициенты в приведенных ниже схемах химических реакций:
Na + Н2О NaOH + Н2
2) Р2О5 + Н2О Н3РО4
3) Fе2О3 + Al А12О3 + Fе
4) Al + CuCl2 Сu + А1С13
5) Au + CuСl2 → Cu + AlCl3↑
6) Al + НС1 → А1С13 + H2 ↑
7) Fe(OH)3 → Fe2O3 + H2O
8) Al + S → Al2S3
9) FeBr3 + Na2S → Fe2S3 ↓ + NaBr
10) Zn + O2 → ZnO
2. Рассчитайте массовую долю марганца в оксиде марганца (IV) и оксиде марганца (VII).
Ответ:63,2 % в MnO2 и 49,5% в Mn2O7.
3. Сколько литров водорода выделится при взаимодействии железа массой 2,8 г с серной кислотой (н.у.)
Ответ: 1,12 л.
4.Сколько граммов кислорода содержится в 120 г: а) MgO; б) NaOH; в) FeSO4?
РАЗДЕЛ II.
Классификация неорганических веществ
Все неорганические вещества можно разделить на простые (металлы и неметаллы) и сложные, которые, в свою очередь, подразделяются на классы. Каждый класс объединяет вещества по составу и свойствам.
| Основные классы неорганических соединений | ||||
| Оксиды | Кислоты | Основания | Амфотерные гидроксиды | Соли |
| Это сложные вещества, состоящие из 2-х элементов, один из которых кислород. SO3,; Na2O | Это сложные вещества, состоящие из атомов водорода и кислотного остатка HCl,; H3PO4 | Это сложные вещества, диссоциирующие в растворе с образова-нием катионов металла и гидроксогруп-пы. Cu(OH)2,; KOH | Это гидроксиды амфотерных металлов, образующие соли как с каслотами, так и с основаниями Al(OH)3,Zn(OH)2 | Это сложные вещества , диссоциирующие в растворе с образованием катионов металла и анионов кислотного остатка Al2(SO4)2 |
Оксиды.
Классификация оксидов:
Оксиды

Несолеобразующие CO, NO, N2O
Солеобразующие
Основные
![]()
Амфотерные
![]()
Кислотные
![]()
Солеобразующие оксиды реагируют с кислотами или основаниями с образованием соли и воды; несолеобразующие оксиды не реагируют.
Номенклатура: «оксид» + название элемента в родительном падеже + валентность элемента. (Mn2O7 - оксид марганца (VII))
Получеиие оксидов:
1. Взаимодействие элементов с кислородом::
2Са + О2 =2СаО
S + О2 = SO2
2. Некоторые основания разлагаются под действием температуры:
гидроксид металла → оксид металла + вода
2А1(ОН)3 Al2O3 + 3H2O
3. Некоторые кислоты разлагаются под действием температуры:
кислота → оксид неметалла + вода
H2СO3 →CO2 +H2O
Химические свойства.
Кислотные оксиды – Это оксиды неметаллов (SiO2, P2O5, Cl2O7 и др.).
1. Кислотные оксиды реагируют с основаниями и основными оксидами с образованием солей:
CO2 + 2NaOH = Na2CO3 + H2O
SO2 + CaO ![]() СaSO3
СaSO3
2. Кислотные оксиды взаимодействуют с водой, если образующаяся при этом кислота растворима в воде
SO3 + H2O = H2SO4
SiO2 (оксид кремния IV) нерастворим в воде, поскольку кремниевая кислота в воде не растворима.
Основные оксиды – это оксиды типичных металлов
1. Взаимодействуют с растворами кислот и кислотными оксидами с образованием солей:
FeO + 2HCl = FeCl2 + H2O
Na2O + SiO2 ![]() Na2SiO3
Na2SiO3
2. Основные оксиды взаимодействуют с водой с образованием основания, если оно растворимо в воде ( щелочей ):
Na2O + H2O = 2NaOH
CaO + H2O = Ca(OH)2
Амфотерные оксиды реагируют как с кислотами, так и с основаниями с образованием солей:
Al2O3 + 6HCl = 2AlCl3 + 3H2O
Al2O3 + 2NaOH + 3H2O = 2Na[Al(OH)4]
ZnO + 2HCl = ZnCl2 + H2O
ZnO + 2NaOH + H2O = Na2[Zn(OH)4]
С водой амфотерные оксиды не взаимодействуют.
Восстановление оксидов.
Из оксидов металлов можно получить свободные металлы:
CuO + H2 ![]() Cu + H2O
Cu + H2O
Fe2O3 + 3CO = 2Fe + 3CO2
SnO2 + C = Sn + CO2
Следует добавить, что амфотерные, основные и кислотные оксиды могут реагировать друг с другом при нагревании:
Na2O + Al2O3 ![]() 2NaAlO2
2NaAlO2
2SO3 + Al2O3 ![]() Al2(SO4)3
Al2(SO4)3
CaO + SO3 ![]() CaSO4
CaSO4
Основания
Классификация оснований:
По содержанию ОН-групп (кислотности): однокислотные (NaOH), двухкислотные ( Mg(OH)2) и т.д.
По растворимости в воде: щелочи - растворимые в воде основания (NaOH, KOH, LiOH, Ca(OH)2, Ba(OH)2) ) и нерастворимы (все остальные)
По силе: сильные (щелочи) и слабые ( все остальные).
Номенклатура: «гидроксид» + название металла в родительном падеже + валентность металла :Fe(OH)3 – гидроксид железа (III)
Физические свойства: твердые кристаллические вещества. В воде растворимы щелочи: LiОН, NaOH, KOH, CsOH, RbOH, Ca(OH)2, Sr(OH)2, Ba(OH)2,, другие - малорастворимы. Водные растворы щелочей мылки на ощупь, разъедают кожу, ткань – едкие щелочи.
Химические свойства.
1. Основания реагируют с кислотами (реакция нейтрализации) Cu(OH) 2 + H2SO4 = CuSО4 + 2H2 O
Cu(OH) 2 + 2H+ =Cu2+ + 2H2 O
2.C кислотными оксидами cоль + вода
2KOH + CO2 = K2CO3 + H2 O
2NaOH + SiO2 = Na 2 SiO 3 + H2 O
3. Щелочи взаимодействуют с амфотерными оксидами соль + вода
2KOH + ZnO = K2ZnO2 + H2 O
4. Щелочи взаимодействуют с солями, если образуется малорастворимая соль или малорастворимое основание
Ba(OH) 2+ H2SO4 = BaSO4 + + 2NaOH
2NaOH+ + CuCl2 = Cu(OH) 2 +2NaCl
5.При нагревании нерастворимые в воде гидроксиды разлагаются
Cu(OH) 2 CuО +H2 O
6.Растворы щелочей имеют pH7, изменяют окраску индикаторов. В щелочной среде
окраска лакмуса – синяя, фенолфталеина – малиновая
Получение.
Щелочи можно получить по реакциям:
1 Взаимодействие металла с водой
2Na + 2H2 O = 2NaOH + H2
Ba + 2H2 O = Ba(OH) 2 + H2
2 Взаимодействие оксидов щелочных металлов с водой
Li2 O + H2 O = 2LiOH
CaO +2H2 O = Ca(OH)2
3 Электролиз водных растворов солей щелочных металлов
2NaCl +2H2 O = 2NaOH +Cl2 + H2
4. Нерастворимые в воде основания получают косвенным путем: взаимодействие соли соответствующего металла со щелочью:
CuSО4+ 2NaOH = Cu(OH) 2 + Na 2SO4
MgCl 2+ 2KOН = Mg(OH) 2 + 2KCl
Кислоты.
Классификация кислот:
По содержанию кислорода: кислородсодержащие (HNO3) и бескислородные (H2S).
По содержанию водорода (основности): одноосновные (HCl), двухосновные (Н2SО3), трехосновные (Н3РО4) и т.д.
По силе: сильные (HNO3,HCl, HBr, HI, Н2SО4 ) и слабые ( все остальные).
Номенклатура:
а). бескислородных кислот: элемент + «о» + «водородная кислота" (сероводородная кислота)
б) кислородсодержащих кислот:
| Формула кислоты | Название кислоты | Валентность кислотного остатка | Название солей |
| HN02 | Азотистая | I | Нитриты |
| HNO3 | Азотная | I | Нитраты |
| НС1 | Хлороводородная | I | Хлориды |
| HClO | Хлорноватистая | I | Гипохлориты |
| HClO2 | Хлористая | I | Хлориты |
| HClO3 | Хлорновататя | I | Хлораты |
| HClO4 | Хлорная | I | Перхлораты |
| HF | Фтороводородная | I | Фториды |
| HBr | Бромофодородная | I | Бромиды |
| HI | Йодоводородная | I | Йодиды |
| HMnO4 | Марганцовая | I | Перманганаты |
| H2S | Cероводородная | II | Сульфиды |
| Н2SО3 | Сернистая | II | Сульфиты |
| Н2SО4 | Серная | II | Сульфаты |
| H2SiO3 | Кремниевая | II | Силикаты |
| H2CO3 | Угольная | II | Карбонаты |
| H2CrO4 | Хромовая | II | Хроматы |
| H2Cr2O7 | Двухромовая | II | Бихроматы |
| Н3РО4 | Фосфорная | III | Фосфаты |
| H3BrO3 | Борная | III | бораты |
Получение кислот:
Взаимодействие кислотных оксидов с водой:
SО3 +H2O = H2SO4
Кислота1 + соль1 = кислота2 + соль2 (если образуются ↓ или ↑)
2НС1 + FeS = FeCl2 + H2S↑
3. Бескислородные кислоты получают непосредственным синтезом из водорода и неметалла :
Н2 + Сl2 =2HCl
Химические свойства.
1. Кислота + основной оксид= соль + вода:
Н2SО4 + CaO = СaSO4 + Н2О
2. Кислота + основание = соль + вода (реакция нейтрализации):
НС1 + NaOH = NaCl + H2O
3.Некоторые кислоты разлагаются под действием температуры:
кислота → оксид + вода
Н2СО3→CO2 + H2O
4.Кислота + металл (стоящий в ряду активности до водорода) = соль + Н2
Zn + 2HCl = ZnCl2 + H2
5.Реакция на индикатор: (синий лакмус-красный, метилоранж –розовый)
Соли
Соли можно рассматривать как продукт полного или частичного замещения атомов водорода (H) в молекуле кислоты на металл (H2SO4 NaHSO4, Na2SO4) или замещения гидроксогрупп в основании на кислотный остаток (Mg(OH)2 MgOHCI, MgCI2).
Классификация солей
| средние | кислые | основные | двойные | комплексные |
| Образуются при полном замещении атомов водорода в кислоте на металл MgCI2, ZnSO4 | Образуются при неполной нейтрализации кислоты или кислотного оксида гидроксидом Zn(НSO4)2 | Образуются при неполной нейтрализации гидроксида или основного оксида кислотой MgОНCI | Содержат в своем составе два различных металла и один кислотный остаток КАl(SO4)2 | Состоят из комплексных ионов и противоионов [Cu(NH3)4]Cl2 |
| НОМЕНКЛАТУРА | ||||
| Кислотный остаток + металл в родительном падеже + валентность металла | Приставка «гидро» + кислотный остаток + металл в родительном падеже + валентность металла | Приставка «гидроксо» + кислотный остаток + металл в родительном падеже + валентность металла | Кислотный остаток + перечисление металлов | Кислотный остаток + металл в родительном падеже + валентность металла |
| Хлорид магния, сульфат цинка | Гидросульфат цинка | Гидроксохлорид магния | Сульфат алюминия, калия | Хлорид тетрааминокупрата |
Получение солей:
1. Металлы с неметаллами: 2Mg + CI2 = MgCI2
2. Металлы с кислотами: Zn + H2SO4 = ZnSO4 + H2
3. Металлы с солями: Fe + CuSO4 = Cu + FeSO4
4 Основные оксиды с кислотами: CaO + 2HCI = CaCI2 + H2O.
5. Кислотные оксиды с основаниями: CO2 + Ca (OH)2 = CaCO3 + H2O
6. Кислотные оксиды с основными: CaO + CO2 = CaCO3
7. Амфотерные оксиды: Al2O3 + CaO = Ca (AlO2)2
8. Реакция нейтрализации H2SO4 + 2NaOH = Na2SO4 +2H2O
9. Из солей (если при этом образуется газ или осадок)
- кислота + соль : HCl + NaHCO3 = NaCl + H2O+CO2↑
- основание + соль: CuCl2 + 2NaOH = NaCl + Cu(OH)2↓
- соль1 + соль 2: NaCl + AgNO3 = Na NO3 + AgCl ↓
Типовая задача.
Какой объем аммиака, измеренный при н.у., должен прореагировать с избытком хлороводорода для получения хлорида аммония массой 10,7 г?
Дано: Решение:
m (НСl) =250 г 1.Записываем уравнение реакции и расставляем коэффициенты
(НСl) =250 г 1.Записываем уравнение реакции и расставляем коэффициенты
NH3 + HCl = NH4Cl
………………………. 1 моль 1 моль
V(NH3) - ? 2. Рассчитаем количество хлороводорода
![]()
3. По уравнению химической реакции: n(HCl)=n(NH3)=0,3 моль
4. Рассчитываем объем аммиака
![]() =0,3 моль·22,4 л/ моль = 6,72 л
=0,3 моль·22,4 л/ моль = 6,72 л
Ответ: объем аммиак 6,72 л.
Задачи для самостоятельного решения
№1. 28 г оксида кальция обработали 100 г азотной кислоты. Сколько граммов нитрата кальция при этом получилось?
Ответ: 82 г
№2. Какой объем оксида углерода (IV) получится при действие соляной кислоты на 50 г карбоната кальция?
Ответ:11,2 л.
№3 .Сколько литров оксида углерода (IV) можно получить путём обжига 500 г известняка, содержащего 5% примесей?
Ответ: 106,4 л
№4. Для получения азотной кислоты в лаборатории было взято 17 г нитрата натрия и 20 г серной кислоты. Сколько граммов азотной кислоты? Какое вещество и в каком количестве осталось в избытке?
Ответ: 12,6 г HNO3 : 10,2 г H2SO4
№5. Сколько килограммов силиката натрия получится при сплавлении оксида кремния (IV) с 63,6 кг соды (Na2CO3)?
Ответ:73,2 кг
РАЗДЕЛ III
Периодический закон и периодическая система химических элементов Д.И.Менделеева
Периодический закон – один из важнейших законов химии, он был открыт в 1869 г. великим русским ученым-химиком Дмитрием Ивановичем Менделеевым.
Периодический закон является основой современной химии. Изучение строения атома вскрывает физический смысл периодического закона и объясняет закономерности изменения свойств элементов в периодах и группах периодической системы химических элементов, которая является графическим изображением периодического закона.
Современная трактовка закона: Свойства элементов и их соединений находятся в периодической зависимости от значения заряда ядер атомов (равного атомному номеру элемента периодической таблице элементов).
Заряд ядра определяет число электронов в нейтральном атоме и число заполненных электронных оболочек в невозбужденном атоме, а также их заселенность (химические свойства).
Порядковый номер элемента заключает в себе физический смысл:
Порядковый Заряду Числу Числу
номер = ядра = протонов = электронов
элемента атома в ядре в атоме
Периодическая система состоит из семи периодов и восьми групп.
Период - это горизонтальный ряд элементов, расположенных по возрастанию порядкового номера, который начинается щелочным металлом и заканчивается благородным газом (исключения: первый период, который начинается водородом; и седьмой период, который является незавершенным).
Периоды разделяются на малые (I-III-й) и большие (IV-VII-й).
В малых периодах слева направо:
заряд ядер атомов увеличивается;
число электронных слоев атомов не изменяется;
число электронов на внешнем слое увеличивается от 1 до 8;
высшая валентность элементов (равная номеру группы) возрастает;
прочность связи внешнего слоя увеличивается;
радиус атома уменьшается (незначительно);
электроотрицательность увеличивается;
металлические свойства элементов, а следовательно и основный характер оксидов и гидрокисдов уменьшается;
неметаллические свойства элементов, а также кислотный характер оксидов и гидроксидов усиливается.
Электроотрицательность – это способность атомов элемента притягивать к себе электроны, которые участвуют в образовании химической связи.
В больших периодах с увеличением заряда ядра изменение свойств более сложное.
Группа – это вертикальный ряд элементов, которые имеют одинаковую высшую валентность в оксидах и других соединениях, которая равна номеру группы.
Каждая группа состоит их двух подгрупп: главной (в нее входят элементы больших и малых периодов) и побочной (содержащей только элементы больших периодов) . Свойства элементов одной группы, но разных подгрупп неодинаковы.
В главных подгруппах сверху вниз:
заряд ядер атомов увеличивается;
число электронных слоев атомов увеличивается;
радиус атома увеличивается (значительно);
число электронов на внешнем слое одинаково;
высшая валентность элементов одинакова;
прочность связи внешнего слоя увеличивается;
электроотрицательность уменьшается;
металлические свойства элементов, а следовательно и основный характер оксидов и гидрокисдов усиливается;
неметаллические свойства элементов, а также кислотный характер оксидов и гидроксидов уменьшается.
2. Расположение электронов в атоме.
Атом – это электронейтральная частица, состоящая из положительно заряженного ядра и отрицательно заряженных (одного или нескольких) электронов, вращающихся вокруг ядра.
Химические свойства элементов определяются строением электронных оболочек. Число электронов на внешнем уровне равно № группы, в которой находится элемент.
По современной теории строения атома нельзя говорить о какой-то определенной траектории движения электрона, а можно лишь судить о той или иной степени вероятности нахождения электрона в данной точке пространства.
Орбиталь – это область наиболее вероятного нахождения электрона.
Располагаясь на различных расстояниях от ядра электроны образуют энергетические уровни или слои. Для каждого элемента число энергетических уровней определяется номером периода.
Каждый уровень делится на подуровни:
s-подуровень - ближайший к ядру подуровень каждого уровня, включает в себя одну s-орбиталь, которая имеет форму шара, максимальная емкость s-подуровня 2 электрона;
p-подуровень включает в себя три p-орбитали, которые имеют форму гантели и взаимно перпендикулярны, максимальная емкость p-подуровня – 6 электронов;
d-подуровень включает в себя пять d-орбиталей, имеющих сложную форму, максимальная емкость d-подуровня – 10 электронов;
f -подуровень включает в себя семь f -орбиталей, имеющих сложную форму, максимальная емкость f -подуровня – 14 электронов.
Расположение электронов по уровням и подуровням называется электронной конфигурацией, при записи которой цифрой указывают значение главного квантового числа (номер периода), затем соответствующими буквами (s, р, d и f) – тип орбитали, а вверху справа над буквой – число электронов на данной орбитали.
Распределение электронов в атоме можно изображать с помощью графических формул орбиталь: изображается 
Если на орбитали располагается один электрон, то его называют неспаренным и он обозначается ↑, если два электрона, то спаренными - ↑↓.
П ример 1. Написать распределение электронов по энергетическим подуровням и дать характеристику элемента с порядковым номером Z=17.
ример 1. Написать распределение электронов по энергетическим подуровням и дать характеристику элемента с порядковым номером Z=17.
Электронная конфигурация: 1s22s22p6 3s2 3p5
Задания для самостоятельного решения.
1. По положению элемента в периодической системе определите, какой элемент имеет большую электроотрицательность; больший радиус атома, обладает более выраженными металлическими свойствами:
йод 53I или бром 35Br;
олово 50Sn или йод 53I;
магний 12Mg или барий 56Ba ;
фосфор 15P или висмут 83Bi .
2. Написать электронную и графическую формулы для элементов под №4, 7, 10, 13.
3. Напишите символы всех элементов, атомы которых содержат пят валентных электронов.
2.Химическая связь
Химическая связь – это сила которая удерживает атомы друг около друга.
Атомы стремятся создать вокруг себя устойчивые 2-х или 8-ми электронные энергетические уровни путем перераспределения электронов при соударениях атомов.
Для определения типа связи необходимы значения электроотрицательностей элементов, которые даны в таблице.
Атомы с небольшим числом электронов на внешнем энергетическом уровне (металлы) стремятся отдать их, с числом электронов близким к 8 (неметаллы), стремятся принять недостающие электроны.
Например: K – 1 ē K![]()
Cl + 1 ē Cl![]()
Химическая связь, образованная за счет электростатического притяжения противоположно заряженных ионов, называется ионной. Соединения с ионной связью образованы элементами, резко отличающимися по свойствам (активные металлы и неметаллы, ΔХ1,7). Такие соединения имеют высокие температуры плавления и кипения, в водных растворах легко диссоциируют на ионы.
При образовании молекул из одинаковых или близких по свойствам атомов происходит обобщение электронов.
Например, при образовании молекулы азота происходит обобществление 6-х электронов (по 3 от каждого атома), чтобы вокруг ядер обоих атомов вращалось по 8 электронов:
:![]() : : N
: : N![]() N : или N≡N или N2
N : или N≡N или N2
Химическая связь, образованная путем перекрывания атомных орбиталей и создания общих электронных пар, называется ковалентной.
Различают неполярные и полярные ковалентные связи.
Если связь образована атомами с одинаковой электроотрицательностью, то электронная пара в равной мере принадлежит обоим атомам и ковалентная связь неполярная.
Если связь образована атомами с различной электроотрицательностью (ΔХковалентной полярной.
![]()
Электронная пара смещена к атому хлора. Смещение электронной пары вызывает несимметричное расположение положительного и отрицательного зарядов внутри молекулы. Такие молекулы называются полярными (диполями). Таким образом, не всегда возможно провести границу между ионной и полярной ковалентной связями.
Разновидностью ковалентной связи является донорно-акцепторная или координационная связь. Например, в реакции NH3 + HCl = NH4Cl по такому механизму образуется ион аммония NH4+.
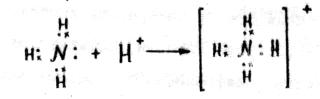
В молекуле NH3 атом азота имеет неподеленную пару электронов (двухэлектронное облако), у иона Н+ (HСl) 1s орбита свободна. При сближении молекулы NH3 и иона Н+ двухэлектронное облако атома азота (донора) попадает в сферу притяжения иона Н+, имеющего свободную орбиту (акцептора) и становится общим для атома азота и атома водорода. Связь, образуемая таким образом, называется донорно-акцепторной. Положительный заряд протона (Н+) сообщается всему иону NH4+ в целом.
Степень окисления (окислительное число или электрохимическая валентность) элемента – это условный заряд атома в молекуле, вычисленный исходя из предложения, что молекула состоит только из ионов.
Для соединений с ковалентной связью степень окисления характеризует направление смещения электронных пар. Например, в молекулах Н2, N2 степень окисления равна нулю, так как отсутствует смещение электронных пар. В молекуле HCl, степень окисления Cl =–1, Н=+1.
Металлическая связь. Валентные электроны атомов металлов слабо связаны со своими ядрами и обладают большой свободой перемещения в кристаллической решетке металла. Таким образом, металлическую связь можно рассматривать как связь между находящимися в узлах решетки атомами и ионами, удерживаемыми быстро перемещающимися электронами (так называемым "электронным газом").
Водородная связь – это химическая связь, между атомом водорода одной молекулы и сильноэлектроотрицательным атомом (O, F, N) другой молекулы.
Н – О ∙∙∙ Н − О Например, в молекуле воды общая электронная пара смещена к
| | электроотрицательному атому кислорода, а атом водорода превращается
H H в почти лишенный электрона протон. Наличие водородной связи
![]() обуславливает такое явление как ассоциацию(укрупнение) молекул.
обуславливает такое явление как ассоциацию(укрупнение) молекул.
O − H Например, молекулы воды образуют ассоциаты (Н2О)2, (Н2О) 3 и т.д.
| линейного или пространственного строения.
H
РАЗДЕЛ IV
Классификация химических реакций и закономерности их протекания
Явление, при котором одни вещества превращаются в другие, называются химической реакцией.
Возможные типы классификаций реакций
По количеству исходных и образующихся веществ.
По изменению степени окисления элементов.
По тепловому эффекту.
По обратимости.
1 и 2 типы реакций приведены в таблице:
| По числу исходных и образующихся веществ | По изменению степени окисления атомов | ||||
| Без изменения степени окисления | С изменением степени окисления (окислительно-восстановительные) | ||||
| СОЕДИНЕНИЯ А + В + С →D | PbO + SiO2 = PbSiO3
C2H4 + H2O = C2H5OH | H2 + Cl2 = 2HCl
4Fe(OH)2+2H2O+O2= =4Fe(OH)3
| |||
| несколько веществ более простого | продукт более сложного состава | ||||
| РАЗЛОЖЕНИЯ
А → В + С + D
| Разложение кристаллогидратов, кислот, оснований (не щелочей !) солей кислосодержащих кислот и др. Cu(OH)2 = CuO + H2O CaCO3 = CaO + CO2 NH4Cl = NH3 + HCl
|
4HNO3 = 2H2O + 4 NO2 + O2 диспропорцирование 4KClO3 = 3KClO4 + KCl
| |||
| более сложное | несколько веществ более простого состава | ||||
| ЗАМЕЩЕНИЯ
А + ВС → АВ + С
| ВСЕГДА с изменением степени окисления | СuSO4 + Fe = FeSo4 + Cu 2KBr + Cl2 =2KCl +Br2 | |||
| простое сложное | сложное простое | ||||
| ОБМЕНА АВ + CD → АС + ВD Наиболее распространены реакции между сложными веществами, протекающие без изменения степени окисления и сопровождающиеся удалением продукта (продуктов) реакции в виде газа, осадка или образованием малодиссоциирующего соединения. | Ag NO3+KBr = AgBr↓+K NO3 Нейтрализации NaOH+HCl = =NaCl +H2O малодиссоц. Гидролиза CH3COONa + H2O= =CH3COOH + NaOH малодиссоц | ВСЕГДА без изменения степени окисления | |||
3. По тепловому эффекту различают реакции эндотермические, протекающие с поглощением теплоты (–Q ) и экзотермические, протекающие с выделением теплоты (+Q).
4. По обратимости различают обратимые реакции, протекающие в прямом и обратном направлении (↔) и необратимые, протекающие только в одном направлении (→_
Необходимо отметить: существует много реакций, которые трудно отнести к одному определенному типу.
Окислительно-восстановительные реакции
Окислительно-восстановительными реакциями называются реакции, при которых происходит переход электронов от одних атомов, молекул или ионов к другим. Признак окислительно-восстановительной реакции – изменение степени окисления элементов в формулах продуктов реакции по сравнению с теми же элементами в формулах реагентов.
Основные положения теории ОВР.
Окисление – это процесс отдачи электронов, степень окисления при этом увеличивается:
S-2 – 6 ē → S+4
Атом, молекула или ион, отдающий электроны, окисляется, но является восстановителем;
Восстановление – это процесс присоединения электронов, степень окисления при этом уменьшается:
N+5 + 2 ē → N+3
Атом, молекула или ион, присоединяющий электроны во время реакции восстанавливается, но является окислителем;
Используется несколько методик составления уравнений окислительно-восстановительных реакций, протекающих в растворах с участием кислородных соединений.
Метод электронного баланса
1. Составить схему реакции и расставить степени окисления:
K+1Mn+7O4-2 + K2+1S+4O3-2 + H2+1O-2 —— Mn+4O2-2 + K2+1S+6О4-2 + K+1O-2H+1
2.Подчеркнуть, атомы каких элементов изменили степень окисления, и составить электронные уравнения процессов окисления и восстановления:
| 3 | 2 | восстановление | окислитель |
| 2 | 3 | окисление | восстановитель |
S+4 - 2 ē ———— S+6
коэффициенты
3. Число отданных электронов всегда равно числу принятых электронов, поэтому в электронных уравнениях подбираются соответствующие коэффициенты (закон электронного баланса):
4. Перенести эти коэффициенты в схему реакции. Затем подобрать коэффициенты перед формулами других веществ реакции:
2KMnO4 +3K2SO3 + H2O — 2MnO2 + 3K2SО4 + 2KOH
5. Заключительная часть: правильность составления уравнения определяется равенством числа атомов кислорода в левой и правой частях уравнения: 18 = 18.
Задания для самостоятельного решения.
1. Oхарактеризуйте реакции по 4-м типам:
1. Са(ОН)2 + 2НС1 = CaCl2 + 2Н2O
2. AgNO3 + HC1 = AgCl ↓ + HNO3
3. Cu(OH)2 = CuO + H2O - Q
4. ЗН2О + Р2О5 = 2H3РО4+Q
5. СаО + H2О = Са(ОН)2+ Q
5. 2А1 + ЗС12 = 2А1С13
6. 2H2О = 2Н2↑ + O2↑-Q
7. Zn + 2HC1 = ZnCl2 + H2↑+Q
8. Cl2 + 2KBr = 2KC1 + Br2
9. Fe + CuSO4 = FeSO4 + Cu
10. CuO + 2HC1 = СиCl2 + H2O
11. НС1 + NaOH = NaCl + H2O-Q
2. Расставьте коэффициенты методом электронного баланса
KI + KClO3 + H2SO4= KCl + I2 + K2SO4
I2 + HNO3 HIO3 + NO + H2O
Br2 + Cl2 + H2O HBrO3 + HCl
S + KOH K2S + K2SO3 = H2O
HNO2 HNO3 + NO+ H2O
Cu(NO3)2 CuO + NO2 + H2O
РАЗДЕЛ V.
Растворы. Электролитическая диссоциация.
Растворы – это гомогенные (однородные) системы, состоящие из 2-х или нескольких компонентов.
Основной характеристикой раствора является его концентрация.
Способы выражения концентрации растворов.
Концентрация раствора это весовое количество растворенного вещества, содержащееся в определенном весовом или объемном количестве раствора.
Рассматривают процентную, молярную и нормальную концентрации.
а) Массовая доля растворенного вещества (![]() )показывает количество граммов растворенного вещества, содержащегося в 100 г раствора.
)показывает количество граммов растворенного вещества, содержащегося в 100 г раствора.
Массовую долю ![]() % вычисляют из соотношения между массой растворенного вещества т1, и массой раствора т2 :
% вычисляют из соотношения между массой растворенного вещества т1, и массой раствора т2 :
![]()
В случае выражения количества раствора в объемных единицах (литрах или мл) массу его выражают в виде произведения объема V (мл) на плотность
mраствора = Vраствора ![]()
Масса растворенного вещества для приготовления раствора заданной концентрации:
![]()
* б) Молярная концентрация или молярность (М) выражается числом грамм-молекул (молей) растворенного вещества, содержащихся в 1 литре раствора.
Раствор, содержащий в 1 л. 1 г-м растворенного вещества, называется молярным; 0,1 г-м – децимолярным; 0,01 г-м – сантимолярным.
Молярность вычисляют из соотношения между массой растворенного вещества т1, его молекулярной массой М и объемом раствора V (в литрах).
![]() моль/л
моль/л
* в) Нормальная концентрация или нормальность (N) показывает число грамм-эквивалентов растворенного вещества, содержащееся в 1 литре раствора. Раствор, в 1 л. которого содержится 1 г-э растворенного вещества, называется нормальным; 0,1 г-э – децинормальным; 0,01 г-э – сантинормальным.
Число г-эквивалентов растворенного вещества ![]() содержится в V (л) раствора.
содержится в V (л) раствора.
![]()
Грамм-эквивалент – это количество вещества в граммах, численно равное его эквиваленту.
Эквивалент кислоты равен молекулярной массе кислоты, деленной на ее основность, т.е. на число атомов водорода в молекуле или на валентность кислотного остатка
![]() г/моль
г/моль
Эквивалент основания (гидроксида) равен молекулярной массе основания, деленной на число гидроксильных групп или на валентность металла.
![]() г/моль
г/моль
Эквивалент соли равен молекулярной массе соли, деленной на произведение валентности металла на число его атомов.
![]() г/моль
г/моль
Типовая задача:
Какую массу фосфата калия и воды надо взять для приготовления 250 грамм раствора с массовой долей K3PO4 8%?
Д ано: Решение:
ано: Решение:
ω(K3PO4) = 8% ![]() =
= ![]()
m(раствора) =250 г
----------------------------. ![]()
m(K3PO4) - ? m (H2O) = (250 – 20)г = 230 г
m (H2O) - ?
Задачи для самостоятельного решения
1. Плотность раствора азотной кислоты с массовой долей 40% равна 1,25 г/мл.
Определить молярную концентрацию вещества.
Ответ: C(HNO3)=7,937 моль/л.
2. Какой объем 0,5 М раствора фосфорной кислоты можно приготовить из 200 мл. 3М ее раствора.
Ответ: V(р-ра H3PO4)=1,2 л.
3. Определить молярную концентрацию азотной кислоты, полученной смешиванием 40 мл. 96% раствора HNO3 (плотность 1,5 г/мл.) и 30 мл. 48% раствора HNO3.
Ответ:
2. Электролитическая диссоциация
Диссоциация – это распад электролита на ионы.
Молекулы солей, кислот и оснований, имеющих полярные и ионные связи, при растворении в воде распадаются (диссоциируют) на ионы. Вещества, не растворяющиеся в воде, а также не имеющие полярных и ионных связей, не диссоциируют (гипс, зол, диэтиловый эфир). Диссоциация называется электролитической, т.к. растворы солей, кислот, щелочей могут проводить электрический ток, т.е. являются электролитами.
Многоосновные кислоты и многокислотные основания диссоциируют ступенчато.
Кислоты диссоциируют на ионы водорода и ионы кислотного остатка:
I ступень: H2SO4 ↔ H+ + HSO4-
II ступень: HSO4- ↔ H+ + SO42-
Гидроксиды металлов (основания) диссоциируют на ионы металла и ионы гидроксида:
I ступень: Cu(OH)2 ↔ CuOH+ + OH-
II ступень: CuOH+ ↔ Cu2+ + OH-
Соли диссоциируют на ионы металла и ионы кислотного остатка:
CuSO4 ↔ Cu2+ + SO42-
Основные соли диссоциируют на ионы основных и кислотных остатков:
I ступень: FeOHCl2 ↔ FeOH2+ + 2Cl-
Диссоциация ионов основных остатков на ионы металла и гидроксиды почти не имеют места.
Кислые соли диссоциируют на ионы металла и сложные кислотные остатки
NaHCO3 ↔ Na+ + HCO3-
Амфотерные гидроксиды диссоциируют по типу оснований и кислот:
Zn2+ + 2OH- ↔ Zn(OH)2 ↔ H2ZnO2 ↔ 2H+ + ZnO22-
в кислой среде в щелочной среде
В растворе устанавливается равновесие между ионами и недиссоциированными молекулами.
Отношение числа распавшихся на ионы молекул к числу молекул растворенного вещества называется степенью электролитической диссоциации (α).
![]()
В зависимости от степени электролитической диссоциации электролиты делят на сильные и слабые. Сильными электролитами считают электролиты, у которых степень диссоциации в 0,1N растворах не менее 30% и сравнительно мало изменяется с увеличением концентрации раствора. К ним относятся: большинство солей, кислоты (HCL,HBr, HI, HNO3, H2SO4 и др.), щелочи (NaOH, Ba(OH)2, KOH, Ca(OH)2). У слабых электролитов степень диссоциации даже в сильно разбавленных растворах очень мала и быстро падает с увеличением концентрации раствора. К ним относятся: почти все органические кислоты (CH3COOH и др.); минеральные кислоты (Н2СО3, H2SO3, H2S, HNO2); основания и NH4OH, Н2О.
3. Реакции ионного обмена
По теории электролитической диссоциации все реакции в водных растворах электролитов есть реакции между ионами. Ионные реакции протекает до конца, если одно из веществ выпадает в осадок (обозначается ↓), выделяется в виде газообразного продукта (↑) или образуется малодиссоциирующее вещество (Н2О).
Порядок написания ионных реакций следующий:
а) уравнение реакции записывается в молекулярной форме,
б) уравнение пишется в ионной форме (сильные электролиты – в виде ионов, остальные веществе в виде молекул),
в) ионы левой и правой части уравнения, не изменившиеся в процессе реакции, исключаются,
г) ионная реакция проверяется числом атомов и электрических зарядов в левой и правой частях уравнения.
Примеры:
BaCl2 + Na2SO4 = BaSO4↓+ 2NaCl
Ba2+ + 2Cl- + 2Na+ + SO42- = BaSO4↓+ 2Na+ + 2Cl-
Ba2+ + SO42- = BaSO4 ↓
2HCl + Na2CO3 = 2NaCl + CO2 ↑+ H2O
2H+ + 2Cl- + 2Na+ + CO32- = 2Na+ + 2Cl- + CO2 ↑+ H2O
2H+ + CO32- = CO2 ↑+ H2O
2NaOH + H2SO4 = Na2SO4 +2 H2O
2Na+ + 2OH- + 2H+ + SO42- = 2Na+ + SO42-+ 2H2O
2OH- + 2H+ = 2 H2O
OH- + H+ = H2O
Если в результате реакции не выпадает осадок, не выделяется газообразное вещество или не образуется слабодиссоциирующий продукт, то в растворе реакция между ионами не пойдет:
BaCl 2 +2 NaNO3 = Ba(NO3 )2+ 2NaCl
Ba2+ + 2Cl- + 2Na+ + 2 NO3- = Ba2+ + 2 NO3-+ 2Na+ + 2Cl-
4. Гидролиз солей
Гидролизом солей называется взаимодействие ионов соли с водой, приводящее к образованию слабого электролита (кислоты, основания, кислого или основного иона). Соли, в зависимости от силы образующих их кислот и оснований можно разделить на 4 типа по схеме:
| | Кислоты | ||
| сильные | слабые | ||
| Основания | сильные | I KCl, NaNO3 | II Na2CO3, K2S |
| слабые | III MgCl2, Zn(NO3)2 | IV CH3COONH4, (NH4)2CO3 | |
Гидролиз солей нескольких основных типов:
Соли, образованные сильным основанием и сильной кислотой, гидролизу не подвергаются. Их растворы нейтральны pH=7.
Соли, образованные слабой кислотой и сильным основанием , подвергаются гидролизу по аниону. Реакция среды щелочная: pH7.
Na2S +2H2O↔H2S +2NaOH;
Na1++ S2- + 2H2O↔H2S +2Na++ 2OH1-
Это полное ионное уравнение гидролиза ацетата натрия. Сократив одинаковые ионы в левой и правой частях уравнения (в данном уравнении Na1+), получим сокращенное ионное уравнение: S2- + 2H2O↔H2S + 2OH1- .
Соли, образованные слабым основанием и сильной кислотой, гидролизу по катиону. Реакция среды кислая: pH
NH4Cl+H2O↔NH4OH+HCl
NH41++Cl1-+H2O↔NH4OH+H1++Cl1-
NH41++H2O↔NH4OH+H1+
Соли, образованные слабой кислотой и слабым основанием, гидролизу и по катиону, и по аниону. Реакция среды близкая к нейтральной pH7.
CH3COOHNH4+H2O↔CH3COOH+NH4OH;
CH3COO1-+NH41++H2O↔CH3COOH+NH4OH.
В данном случае полное ионное уравнение совпадает с сокращенным ионным.
Если соль образована слабой летучей кислотой и слабым нерастворимым в воде основанием, то она подвергается полному необратимому гидролизу, т.е. такие соли в растворе не существуют:
Al2S3; Cr2S3; Al2(CO3)3; Fe2(CO3)3; Cr2(SO3)3 и т.п.
Задания для самостоятельного решения.
1. Напишите полные и сокращенные ионные уравнения следующих реакций:
а) Са(ОН)2 + 2НС1 = CaCl2 + 2Н2O
AgNO3 + HC1 = AgCl ↓ + HNO3
Fe + CuSO4 = FeSO4 + Cu
Na2СОз + НОН ↔ NaНСОз + NaОН
ЧАСТЬ II.
ОРГАНИЧЕСКАЯ ХИМИЯ
Органическая химия – это химия углеводородов и их производных.
Углеводороды (УВ) – это простейшие органические вещества, молекулы которых состоят только из двух элементов : углерода С и водорода Н.
Производные УВ – это продукты замещения атомов «Н» в молекулах УВ на другие атомы или группы атомов. Например:
Характер химических связей и валентность углерода
в органических соединениях
Во всех органических соединениях атом С находится в возбужденном состоянии, поэтому валентность его равна IV.
Основные положения теории химического строения
органических веществ Бутлерова.
I. Атомы в молекулах органических веществ соединяются друг с другом в определенной последовательности согласно их валентности.
II. Свойства веществ зависят не только от состава, но и от строения их молекул.
III. В молекулах органических веществ атомы и группы атомов взаимно влияют друг на друга, что определяет свойства веществ.
| Классы | Общая формула | Номенклатура | Примеры |
|
| Алканы
| СnH2n+2 | УВ+ «ан» | СН3-СН3 | Этан |
| Циклоалканы
| СnH2n | «цикло» +УВ+ «ан» | СН2– СН2 | | СН2 – СН - СН3 | Метилцикло- бутан |
| Алкены
| УВ+ «ен»+ №(С) | СН2=СН-СН3 | Пропен-1 | |
| Алкадиены
| СnH2n-2 | УВ+ «диен»+№(С) | СН2=СН-СН=СН2 | Бутадиен-1,3 |
| Алкины
| УВ+ «ин»+№(СКР.СВ) | СН3- С | Бутин-2 | |
| Ароматические УВ
| СnH2n-6 | R + «бензол» | С6Н5СН3 | метилбензол |
| Спирты
| СnH2n+1ОН | УВ+ «ол»+№(С) | СН3- СН2- СН2ОН | Пропанол-1 |
| Прстые эфиры
| R + R «овый» эфир | СН3-О-СН2- СН3 | Метил-этиловый эфир | |
| Альдегиды
| СnH2nО | УВ+ «аль» | СН3-СОН | этаналь |
| Кетоны
| УВ+ «он»+№(С)карб.гр | СН3-С-СН3 || О | Пропанон-2 | |
| Одноосновные карбоновые кислоты | СnH2nО2 | УВ+ «овая» кислота | СН3-СН2-СООН | Пропановая кислота |
| Сложные эфира карбоновых кислот | «спирт»+ый эфир «кислота» | // O СН3-С \ О-С2Н5 | Этиловый эфир уксусной кислоты | |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1. ХИМИЧЕСКИЕ ФОРМУЛЫ. ИЗОМЕРИЯ.
В органической химии применяют молекулярные (эмпирические), структурные и электронные формулы.
Молекулярные (эмпирические) формулы отражают только качественный и количественный состав молекул. Например, молекулярная формула метана - СН4. этилена – C2H4 ацетилена – C2Н2, уксусного альдегида – С2Н4О.
Структурные формулы, или формулы строения, изображают порядок соединения атомов в молекуле, их взаимосвязь друг с другой. Ниже приведены структурные формулы этана, пентана, этилового спирта.
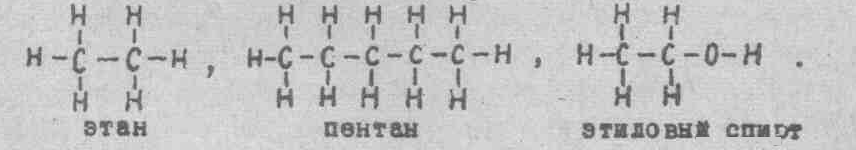
Структурные формулы веществ часто изображают в сокращенном виде;
![]()
В таких сокращенней формулах черточка обозначает связь атомов углерода между собой, но не показывают связи между атомами углерода и водорода. Надо иметь в виду, что структурные формулы отображают только последовательность соединения атомов, но не показывает, как атомы расположены в пространстве. Поэтому, как бы мы ни изобразили структурную формулу пентана:
это будет одна и та же молекула, так как порядок, последовательность, соединения атомов здесь не меняется.
Важную роль при изучении органической химии играет понятие изомерии, впервые правильно объясненное А.И.Бутлеровым.
Изомеры - это вещества, имеющие одинаковый качественный и количественный состав, одинаковую молекулярную массу, но различное строение молекул, а поэтому обладающие разными свойствами. На основе теории строения органических веществ А.И.Бутлеров предсказал существование двух изомер в бутана. В 1867 году он синтезировал один ив них (изобутан), еще не известный в то время.
| Типы изомерии | |||||
| Структурная | Пространственная | ||||
| Углеродного скелета | Положения кратной связи | Положения функциональной группы | Межклассовая изомерия | Геометрии-ческая (цис-; транс-) | Оптическая |
| | | | | | |
Сущность структурной изомерии заключается в способности атомов органических веществ соединяться в различной последовательности. Наличие структурных изомеров может быть обусловлено изомерией цепи; изомерией положения кратких связей, функциональных групп. Наличие изомеров у бутана вызвано изомерией цепи: в нормальной бутане цепь атомов углерода неразветвленная, в изобутане она разветвлена.
Структурные формулы изомеров:
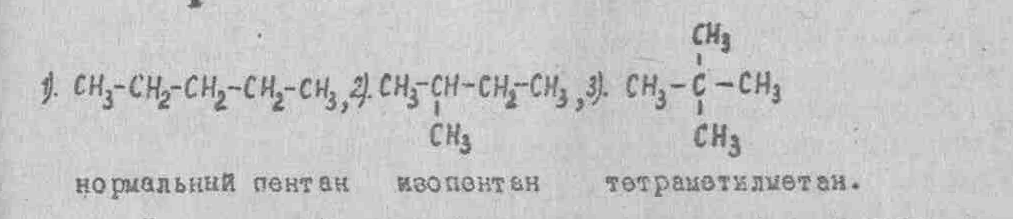
У соединений, в молекулах которых содержатся кратные (двойные, тройные) связи или функциональные группы, наличие структурных изомеров определяется не только изомерией цепи, но и положением кратных связей или функциональных групп. Например, непредельный углеводород с двойной связью (молекулярная формула C4Н8) известен в виде трех структурных изомеров:
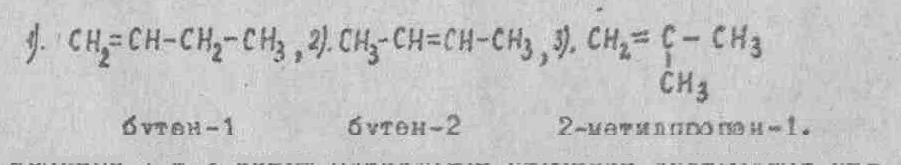
Изомеры 1 и 2 имеют одинаковое строение углеродной цепи и отличаются положением двойной связи. Изомер 3, отличается от изомеров 1 и 2 изомерией углеродного скелета.
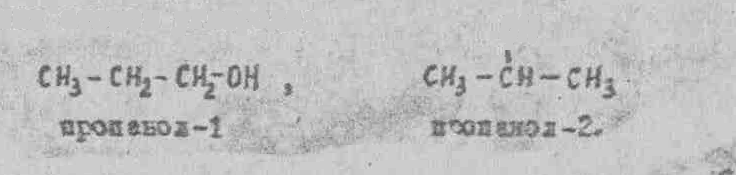
Изомеры пропанола отличаются положением функциональной группы ОН.
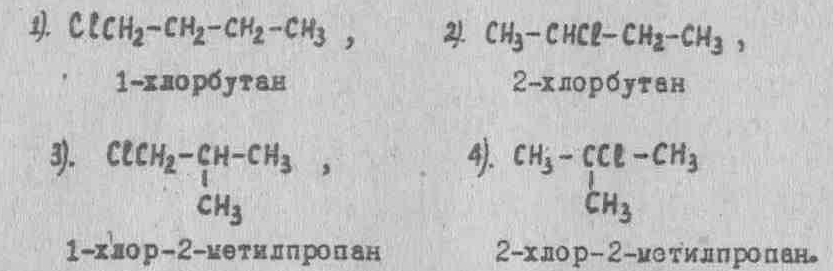
Изомеры I и 2 отличаются друг от друга положением атома хлора в углеродной цепи, их можно рассматривать как производные н.-бутана, в молекуле которого один атом водорода замещен на хлор (изомерия положения), а от изомеров 3 и 4 - строением углеродного скелета (изомерия цепи). Соединения 3 и 4 можно рассматривать как хлорпроизводные изобутана.
Структурная изомерия встречается не только среди соединений одного и того же класса, как это было в рассмотренных выше примерах. Органические вещества, относящиеся к различным классам, также могут быть структурными изомерами. Так, состав этилового спирта и диметилового эфира выражается одной молекулярной формулой С^О, но свойства их различны: этиловый спирт - жидкость с температурой кипения 78(2Рс, а диметиловый эфир - газ, сжижаюшийся при -23,6°С. Структурные формула их имеют следующий вид:
![]()
Для молекулярной формулы C3Н6 можно написать две структурные формулы:

Первый изомер - циклопропан, Относится к классу циклопарафинов, а второй - пропен-1 к этиленовый углеводородам. Естественно, что свойства этих соединений будут различными.
Стереоизомерия - это пространственная изомерия. Она обусловлена не разной последовательностью соединения атомов в молекуле, а различной конфигурацией в пространстве. Например, для соединений с двойной связью возможна цис-транс-изомерия. Если в изомере замещающие группы находятся по одну сторону плоскости двойной связи, то это будет цис-изомер, если они находятся по разные стороны плоскости двойной связи - транс-изомер. Такая изомерия характерна только для алкенов и циклоалканов.
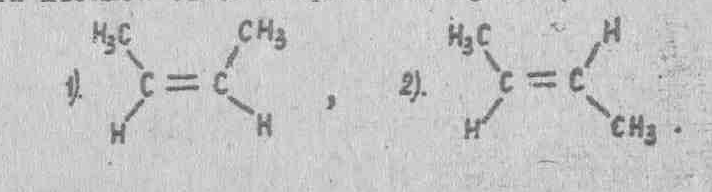
- Чтобы написать формулы структурных изомеров углеродного скелета, надо:
написать структурную формулу углеводорода неразветвленной цепи;
укоротить основную цепь на один атом углерода и приписать его где-нибудь в середине цепи;
если есть возможность, переместить этот атом углерода в другое положение;
укоротить основную цепь еще на один атом углерода и приписать его где-нибудь в середине цепи и т.д.;
- Чтобы написать формулы структурных изомеров положения кратной связи или функциональной группы, надо:
написать структурную формулу углеводорода неразветвленной цепи, при этом связь или функциональную группу написать у первого атома углерода;
переместить кратную связь или функциональную группу ко второму атому углерода и т.д.;
укоротить основную цепь на один атом углерода, приписать его где-нибудь в середине цепи и снова перемещать кратную связь или функциональную группу от первого атома углерода к последнему.
Задачи для самостоятельного решения;
1. Выпишите соединения, изомерные между собой:
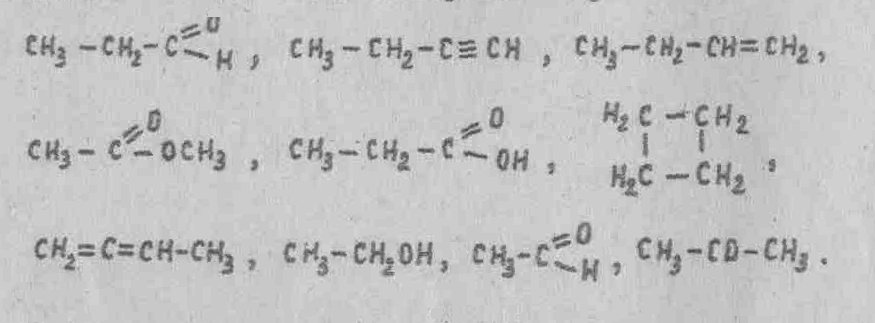
2. Составьте структурные формулы изомеров гексана C6Н14
(Ответ: пять изомеров).
3. Какие из приведенных ниже структур способны существовать в виде цис-, транс- изомерных форм?
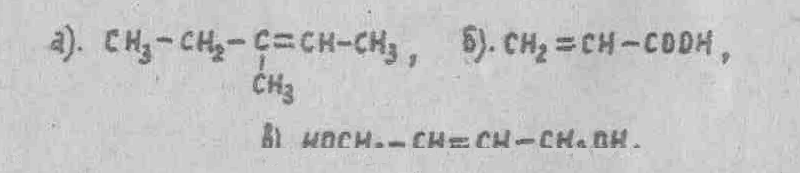
(Ответ: структуры а, в).
УГЛЕВОДОРОДЫ.
Углеводороды относятся к простейшим органическим соединениям. Как видно из названия, они состоят из двух элементов: углерода С и водорода Н.
Предельными называется углеводороды, в молекулах которых атомы углерода связаны между собой простой (одинарной) связью, а все остальные валентности насыщены атомами водорода. Их также называет насыщенными углеводородами, парафинами, алканами. Общая формула алканов CnH2n+2. Малоактивные в химическом отношении вещества. Химические связи в их молекулах являются σ-связями.
Номенклатура:
Найти самую длинную неразветвленную цепь углеродных атомов.
Пронумеровать атомы углерода с того конца, ближе к которому разветвление.
Указать положение заместителя (№ атома углерода)
Назвать алкильный радикал (по алфавиту)
Назвать алкан главной цепи.
Если в молекуле есть несколько одинаковых радикалов, то перед его названием добавляют приставку: 2- ди-; 3- три-; 4 – тетра-; 5- пента- и т.д.
Например: 2,5-диметил-3-этилоктан СН3-СН - СН-СН2-СН-СН2-СН2-СН3
| | |
СН3 С2Н5 СН3
Задания для самостоятельного решения
Напишите структурные формулы следующих веществ:
а) 3-метилпентан;
б) 2,3-дихлорбутан;
в) 2,3-диметил-4,4-диэтилгептан;
г) 2-бром-1-фторпропан;
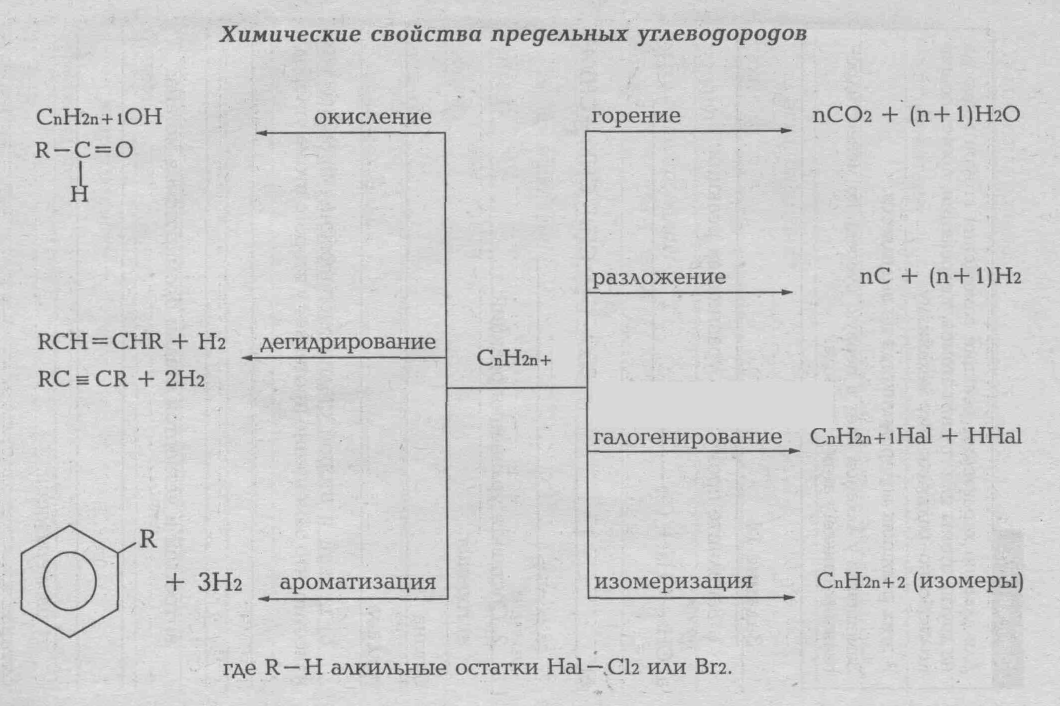
Циклоалканы или циклопарафины. Помимо предельных углеводородов с открытой цепью (парафинов) имеется большое количество соединений с замкнутой цепью - предельных циклических углеводородов. По строению они отличаются от предельных углеводородов тем, что содержат замкнутые цепи из трех, четырех и более атомов углерода. Формула гомологического ряда CnH2n.
Изомерия: а) структурная («С» -скелета и межклассовая); б) геометрическая (цис-, транс-).
Номенклатура: как у алканов
1.Пронумеровать атомы углерода с того атома углерода, от которого отходит радикал.
2.Назвать алкильный радикал (по алфавиту)
3.Назвать алкан, поставив перед ним приставку цикло-.
Например: метилциклобутан СН2 – СН2
| |
СН2 – СН - СН3
По химический свойствам они близки к парафиновым углеводородам: горючи, химически малоактивны, атомы водорода замечаются галогенами.
Циклобутан, циклопентан вступают как в реакцию замещения, так и в реакцию присоединения. Для больших циклов характерны только реакции замещения.
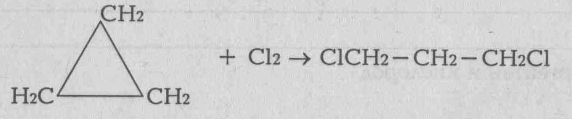
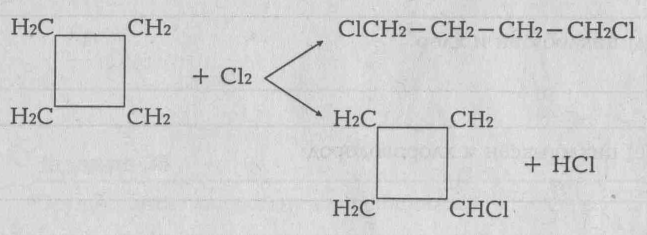
Непредельными называются органические соединения, содержащие, между атомами углерода кратные (двойные или тройные связи). Их также называет ненасыщенными углеводородами, так как их молекулы имеют меньшее число атомов водорода, чей насыщенные. Первыми представителями гомологических рядов непредельных углеводородов являются этилен (с двойной связью) и ацетилен (с тройной связью:
![]()
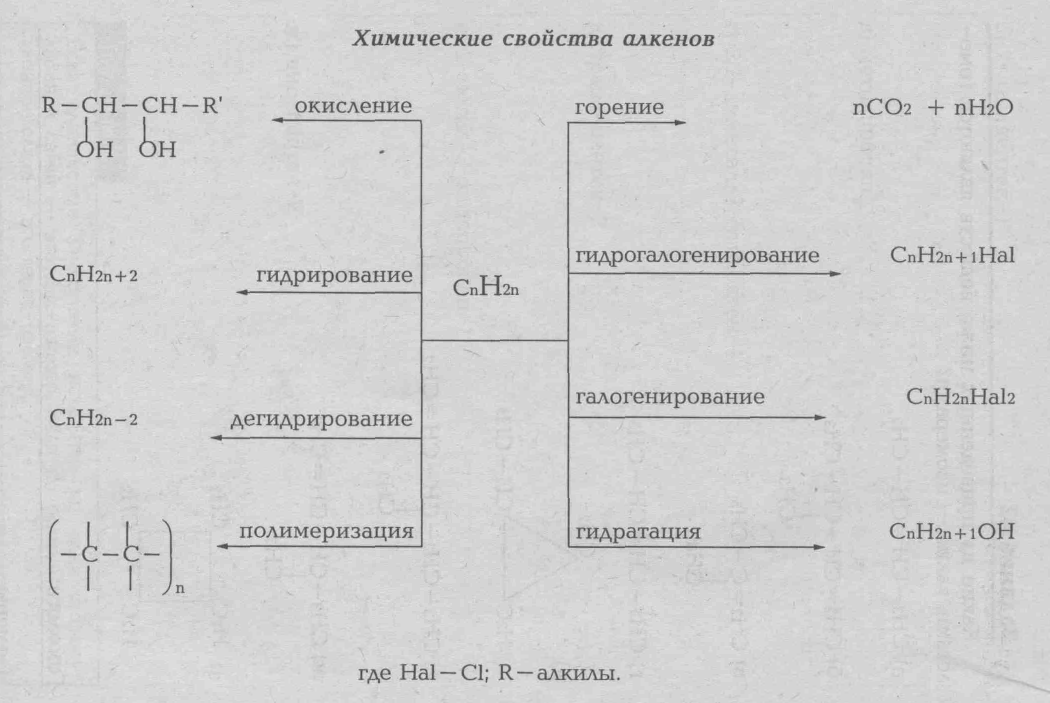
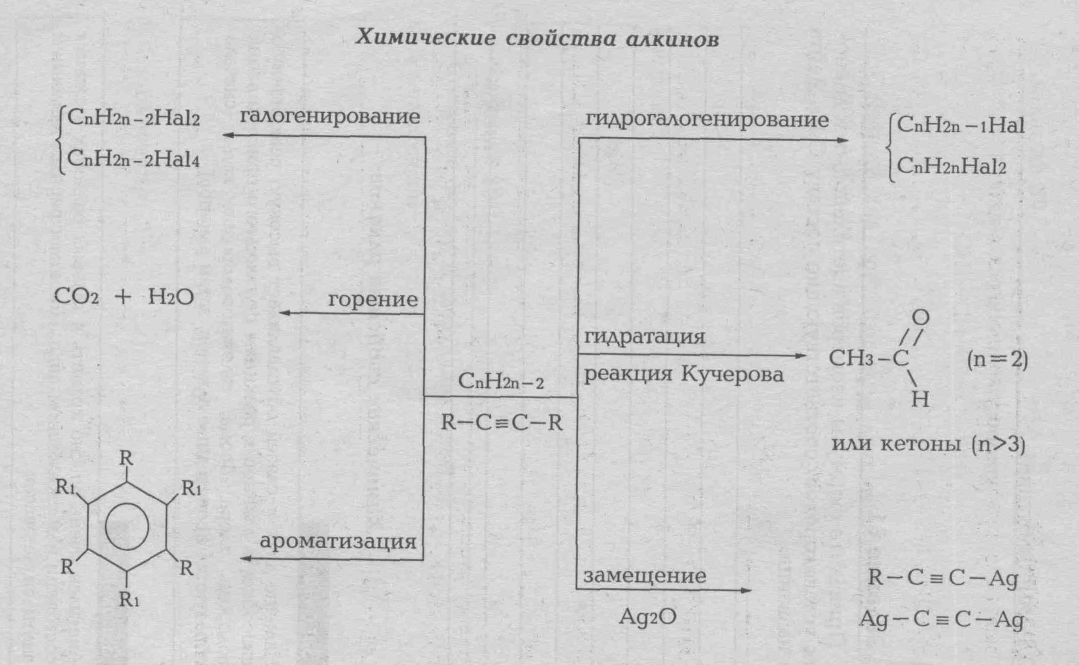
Общая формула этиленовых углеводородов CnH2n, ацетиленовых CnH2n-2 Кратные связи (двойные, тройные) менее прочные, чей одинарные, в поэтому сравнительно легко разрывается при химическом взаимодействии. Непредельные углеводороды отличаются высокой реакционной способностью: они вступают в реакции присоединения, полимеризации.
Номенклатура:
1. Найти самую длинную неразветвленную цепь углеродных атомов.
Пронумеровать атомы углерода с того конца, ближе к которому кратная связь.
3.Указать положение заместителя (№ атома углерода)
4.Назвать алкильный радикал (по алфавиту)
5.Назвать алкен или алкин главной цепи.
6.Указать № атома углерода, от которого отходит кратная связь.
Например: 3,4 – диметилпентен-2; 3-метилбутин-1.
СН3-СН = С - СН-СН3 СН ![]() С – СН – СН3
С – СН – СН3
| | |
СН3 СН3 СН3
Углеводороды, содержащие в углеродной цепи две двойных связи, называются диеновыми. Их состав может быть выражен облей формулой CnH2n-2. Значит они изомерны ацетиленовым углеводородам. Общее международное название диеновых углеводородов - алкадиены. Большое применение имеют алкадиены, в молекулах которых двойные связи разделены простой связью, это бутадиен-1,3 или 2-метилбутадиен-1,3.
По химическим свойствам алкадиены аналогичны непредельным углеводородам: для них характерны реакции присоединения по месту разрыва двойной связи.
![]()
Номенклатура:
1. Найти самую длинную неразветвленную цепь углеродных атомов.
2.Пронумеровать атомы углерода с того конца, ближе к которому кратная связь.
3.Указать положение заместителя (№ атома углерода)
4.Назвать алкильный радикал (по алфавиту)
5.Назвать алкан главной цепи + диен.
6.Указать № атома углерода, от которого отходят кратные связи
Например: 3-метилпентадиен-2,4 СН3-СН=С-СН=СН2
|
СН3
Алкадиены обладают высокой реакционной способностью: легко окисляются, вступают в реакции присоединения с водородом, галогеном, галогеноводородом; реакции полимеризации.
2. Сопряженные диены в реакциях присоединения образуют продукты 1,4-присоединения с одной двойной связью посередине.
Ароматическими называются углеводороды, в молекулах которых содержится одно или несколько бензольных ядер. Простейшим представителей ароматических углеводородов является бензол C6Н6. Атомы углероде в молекуле бензола образуют правильный плоский шестиугольник, хотя обычно (для удобства) его рисует вытянутым:
![]()
Гомологический ряд бензола имеет общую формулу CnH2n-6., где n ≥6. Гомологи можно рассматривать как производные бензола, в котором один или несколько атомов водорода замещены на различные углеводородные радикалы. Например, C7H8 -метилбензол или толуол, C8H10 диметилбензол, или ксилол, этилбензол и т.д. По химическим свойствам бензол и другие ароматические углеводороды отличается от предельных и непредельных углеводородов. Наиболее характерны для них реакции замещения атомов водорода бензольного ядра. Они протекают легче, чем у предельных углеводородов. Таким путей получается множество органических соединений. Реакции присоединения к бензолу протекают с трудом: при повышении температуры и давления, в присутствии катализаторов. Бензол не присоединяет галогеноводороды и воду. Он устойчив к окислителям.
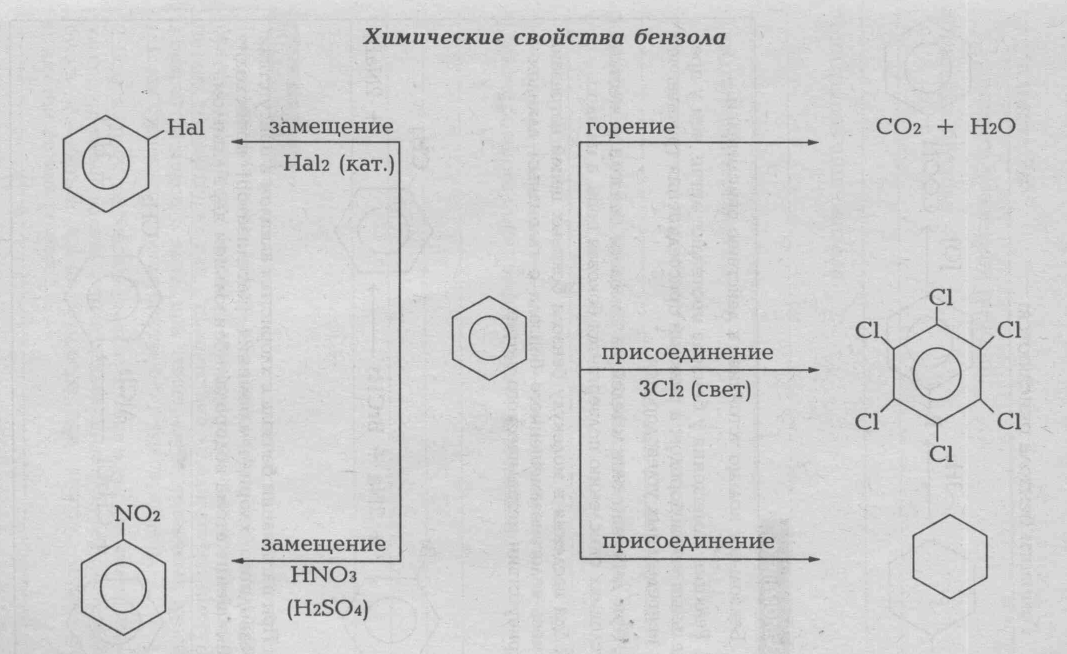
ГЕНЕТИЧЕСКАЯ СВЯЗЬ МЕЖДУ УГЛЕВОДОРОДАМИ
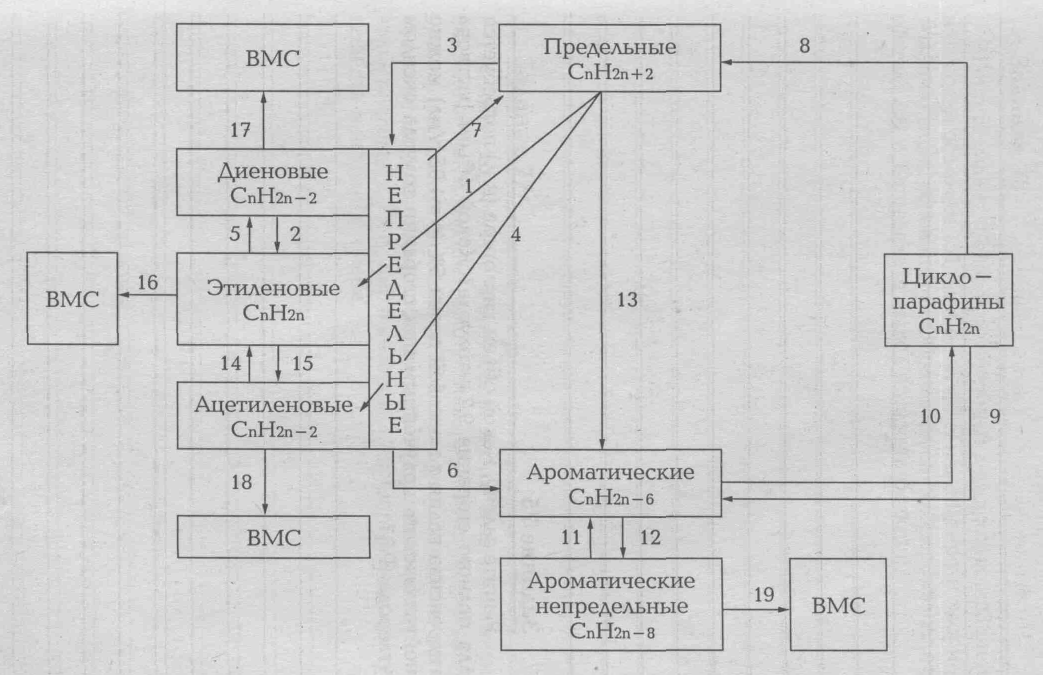
Задачи для самостоятельного решения:
1. Сколько литров ацетилена получится ив 400 г карбида кальция, содержащего 2,5% примесей ?
(Ответ: 136,5 л).
2- Сколько грамм брома может присоединить 10 л смеси, состоящей из 32,6% метана, 22,4% ацетилена и 45% этилена (по объему) ?
(Ответ: 64 г).
3.Сколько литров водорода может присоединиться в присутствии катализатора к 80 г смеси газов, содержащей 42% пропилена и 58% бутана ?
(Ответ: 35,64 л).
3. СОЕДИНЕНИЯ С ФУНКЦИОНАЛЬНЫМИ ГРУППАМИ.
В органической химии, наряду с углеводородами, известно много веществ, в состав которых кроме углерода и водорода входят кислород, азот и некоторые другие элементы.
Характерные химические свойства веществ (их химическая функция) обусловливается группами атомов, называемыми функциональными группами.
Спиртами называется органические вещества, молекулы которых содержат одну или несколько гидроксильных групп, соединенных с углеводородным радикалом. Спирты можно рассматривать как продукты частичного окисления углеводородов. Общая формула предельных одноатомных спиртов CnH2n+1ОН или CnH2n+2О. Общие химические свойства спиртов определяются функциональной группой -ОН. Они взаимодействуют с металлическим натрием или калием с выделением водорода, легко окисляются, с галогеноводородными кислотами дают галогенопроизводные углеводородов. Важное свойство спиртов - их способность к дегидратации (потере воды).
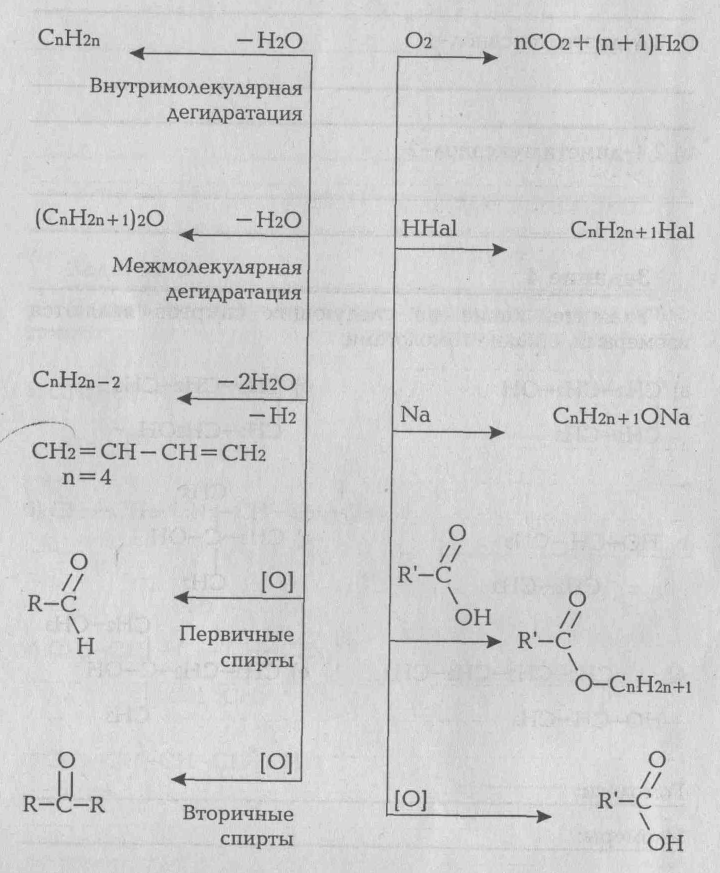
Фенолы- это органические соединений, в молекулах которых гидроксильные группы связаны с бензольным ядром. Они является производными ароматических углеводородов. По химическим свойствам фенолы отличается от спиртов. Это отличие вызвано взаимным влиянием в молекуле фенола гидроксилъной группы и бензольного радикала, навиваемого фенилом (C6H5-). Фенол проявляет свойства слабой кислоты (слабее угольной). Поэтому он легко взаимодействует не только с металлическим натрием, но и с едкими щелочами. Вследствие влияния гидроксильной группы водородные атомы бензольного ядра становятся более подвижными и легко замещается на другие атомы или радикалы. Так, например, фенол без нагревания и без катализаторов энергично взаимодействует с бромом, азотной кислотой.
Альдегидами называются органические веществе, молекулы которых содержат функциональную группу -С=О , соединенную с углеводородным радикалом-(в муравьиной альдегиде функциональная группа соединена с атомом водорода):
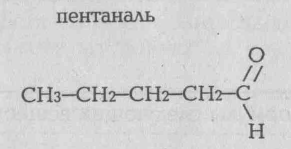

Альдегиды можно рассматривать как продукты окисления спиртов. Общая формула альдегидов CnH2nО. Группа атомов -С=О называется карбонилома поэтому альдегиды можно рассматривать еще как органические соединения, в молекулах которых карбонильная группа -С=О соединена с углеводородным радикалом и атомом водорода.
Химические свойства альдегидов обусловливается прежде всего наличием в их молекуле карбонильной группы. По месту двойной связи в ней могут происходить реакции присоединения. Альдегиды легко окисляются по связи С-Н в альдегидной группе.
Химические свойства
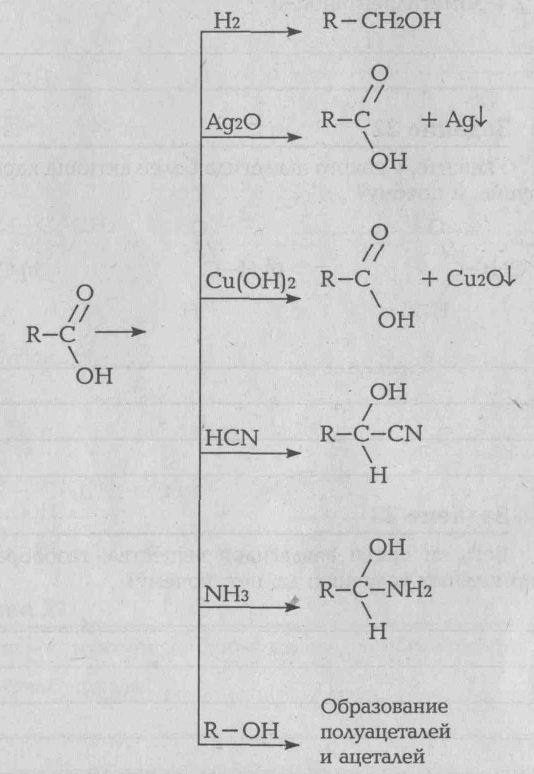
Карбоновыми кислотами называются органические вещества, молекулы которых содержат одну или несколько карбоксильных групп — CООН, соединенных с углеводородных радикалом (в молекуле муравьиной кислоты карбоксильная группа соединена с атомом водорода):
Строение одноосновных карбоновых кислот можно выразить формулой
![]() муравьиная кислота
муравьиная кислота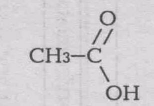 уксусная кислота
уксусная кислота
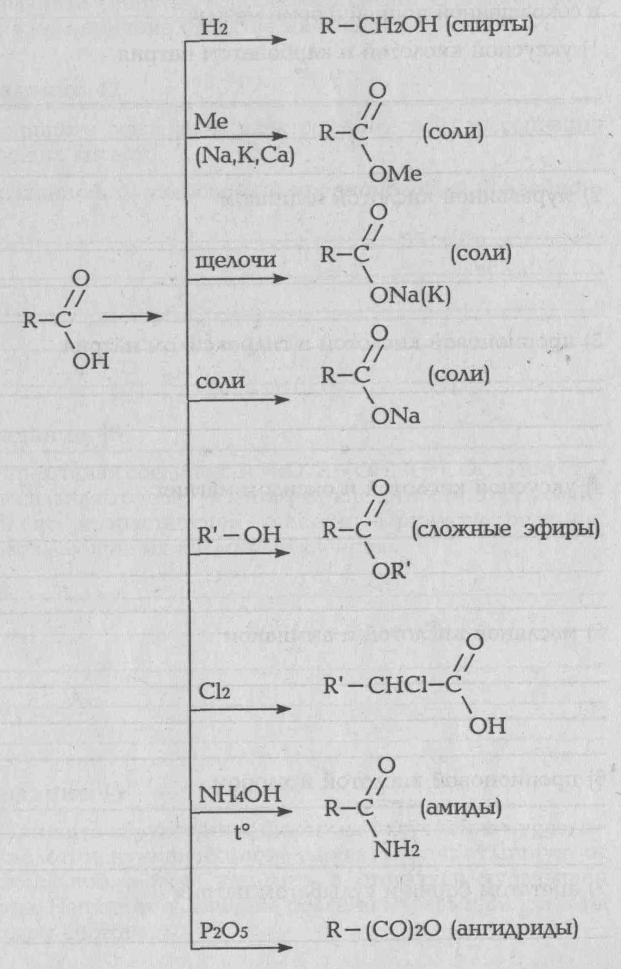
Карбоновые кислоты можно рассматривать как производные углеводородов, в которых атомы водорода замещены на карбоксильные группы. Химические свойства карбоновых кислот определяется главный образом карбоксильной группой. Карбоновые кислоты подобно минеральным, образуют в водных растворах гидратированные ионы водорода. Поэтому они проявляет все свойства кислот: имеют кислую реакцию, образуют соли с металлами, взаимодействуют с основаниями (реакция нейтрализации). Атомы водорода, стоящие при атоме углерода, соседнего с карбоксильной группой, могут замещаться на галогены. Характерным свойством карбоновых кислот является взаимодействие их со спиртами с образованием сложных эфиров.
Химические свойства:
Углеводы - это органические соединения. состоящие из трех элементов - углерода, водорода и кислорода, причем в большинстве случаев водород и кислород находятся в таком же соотношении, как и в воде. Их общая формула Сn(H2O)m. Углеводы по степени сложности обычно делятся на три основные группы: моносахариды (например, глюкоза - C6H12О6) дисахариды (сахароза – C12H22О11) и полисахариды (крахмал, целлюлоза).
А м и н а м и называются производные аммиака, в котором один, два или все три атома водорода замещены органическими радикалами, Важное значение имеет ароматический амин - анилин: С6Н5 – NH2
Его можно рассматривать как производные бензола, в молекуле которого атом водорода заменен аминогруппой, или как производное аммиака, в молекуле которого один атом водорода заменен радикалом фенилом. Химические свойства анилина обусловлены наличием функциональной группы -NH2 и ароматического ядра . Анилин, проявляя основные свойства, взаимодействует с сильными кислотами. С бромной водой при обычных условиях он образует триброманилин.
Аминокислотами называются органические соединения, в молекулах которых содержатся одновременно аминогруппа – NH2 и карбоксильная группа-СООН.
Например, NH2-CH2COOH - аминоуксусная кислота. Их можно рассматривать как производные карбоновых кислот, получающиеся замещением одного или нескольких атомов водорода в углеводородном радикале аминогруппами. Аминокислоты содержат в молекуле две функциональных группы и поэтому проявляют одновременно и свойства кислот и свойства оснований. Это органические амфотерные соединения. Из остатков аминокислот построены белки.
3. Нахождение формулы вещества по результатам анализа
Задача №1. Вывести молекулярную формулу вещества, содержащего 93,75% углерода и 6,25% водорода, если плотность его паров по воздуху равна 4,41.
I способ.
Формула вещества СхНу. Находим соотношение между числами атомов углерода и водорода (х:у) в данной молекуле: делим процентные весовые содержания на величину г-атомной массы элемента:
![]()
Поскольку соотношение атомов в молекуле выражается целыми числами, наименьшее значение принимаем за единицу, т.е. делим на 6,25
![]()
Простейшая формула вещества С5Н4, ее молекулярная масса 64 у.е.
Молекулярную массу газообразного вещества (следствие из закона Авогадро) можно определить, зная плотность этого вещества по воздуху
![]() где:
где:
Мвозд. = 29, средняя молекулярная масса воздуха
отсюда Мв-ва = Двозд. · Мвозд. = 4,41·29 = 128 у.е.
Для нахождения истинной формулы вещества нужно узнать, сколько раз в ней повторится звено простейшей формулы
![]() (то есть, во сколько раз величина молекулярной массы, определенная по плотности больше величины молекулярной массы, рассчитанной по простейшей формуле вещества).
(то есть, во сколько раз величина молекулярной массы, определенная по плотности больше величины молекулярной массы, рассчитанной по простейшей формуле вещества).
Следовательно, истинная формула вещества С10Н8.
II способ.
Определив молярную массу вещества по относительно плотности, можно сразу определить количество атомов каждого элемента в молекуле по формуле:
![]() →
→
![]() =
=
Задача №2. При полном сгорании 13,8 г. органического вещества получилось 26,4 г. углекислого газа и 16,2 г воды. Плотность паров этого вещества по водороду равна 23. Вывести молекулярную формулу вещества.
Сгорая полностью, вещество образует с О2 окислы всех элементов, входящих в его формулу, следовательно, по массе СО2 и H2O можно определись mс и mн в составе соединения.
Определим количество углерода и водорода в веществе:
г-м СО2 весит 44 г; г-м H2O весит 18 г
44 г. СО2 содержат 12 г. С 18 г Н2O содержат 2 г Н
26,4 г. СО2 –"– х г. С 16,2 –"– у г Н
х=7,2 г С у=1,8 г Н
Количество углерода и водорода (7,2+1,8)=9 г меньше количества вещества; следовательно, разность (13,8 – 9)= 4,8 г приходится на кислород.
Находим простейшую формулу вещества; СхНуОz
![]()
С2Н6О, ее молекулярная масса = 46 у.е.
Молекулярная масса вещества по плотности (следствие из закона Авогадро):
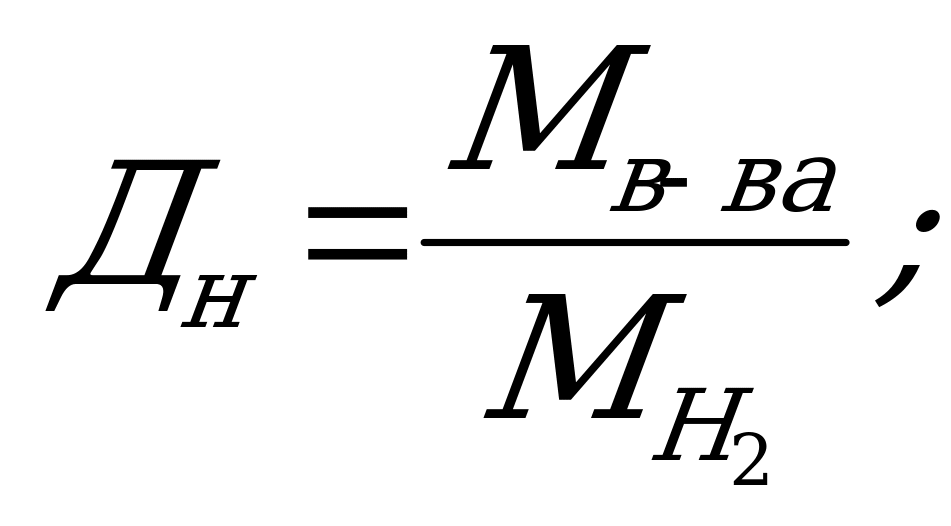 Мв-ва=МН2·Дн = 2,23 = 46 у.е.
Мв-ва=МН2·Дн = 2,23 = 46 у.е.
Значения молекулярных масс, рассчитанных по плотности и по простейшей формуле вещества, одинаковы.
Следовательно, простейшая формула является истинной формулой вещества.
Задача №3. При окислении 10,8 г вещества аммиачным раствором оксида серебра выделилось 30,4 г серебра. Установите формулу исходного вещества.
Решение.
Реакцию "серебряного зеркала" дают альдегиды (функциональная группа-СОН). Составим уравнение реакции:
R-COH +Ag2O ![]() R-COOH + 2 Ag
R-COOH + 2 Ag
по у.х.р. 10,8 г вещества выделяют 32,4 г Ag ,
1 моль вещества выделяет 2•108 г Ag моль вещества составляет:
10.8 -2-108 / 32,4 = 72 г/моль.
Таким образом, относительная молекулярная масса альдегида равна 72.
М(СnH2nO)= 12n+2n+16=72
14n = 56
n=4
Исходное вещество имеет формулу С3Н6О.
Задачи для самостоятельного решения:
1. Сколько литров водороде выделится при взаимодействии 19,2 г натрия со 100 мл 36%-го этилового спирта, имеющего плотность 0,8 г/см3.
(Ответ: 4,46 л ),
2. Сколько литров оксида углерода (IV) выделится при брожении глюкозы, если я при этом образуется 460 г этилового спирта (при нормальных условиях) ?
(Ответ: 224 л ).
3. В 50 г снеси анилина, бензола и фенола пропущен хлористый водород. Выпавший при этоа осадок отфильтрован. Масса его 26 г. Фильтрат, обработанный раствором гидронсида натрия, разделился на два слоя. Найти процентный состав снеси, если объем верхнего слоя 17,7 мл, а плотность 0,88. *
(Ответ: 37,256 анилина: 31,236 бензола и 31,6% фенола).
4. ГЕНЕТИЧЕСКАЯ СВЯЗЬ МЕЖДУ КЛАССАМИ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ.
Различные классы органических соединений находятся между собой в генетической связи (связи по происхождению), а поэтому из веществ одних классов можно получить вещества других классов. Например, углеводорода можно превратить в галогенопроизводные, а из галогенопроизводных получить спирты, из спиртов можно получить альдегиды, а ив альдегидов -.карбоновые кислоты. Таким образом, эти классы соединений - от углеводородов до кислот - находятся в тесной генетической связи и представляют собой как бы ступени постепенного усложнения органических соединений.
Задачи, включающие переходы от веществ одного класса соединений к другим классам играют важную роль в органической хинин. Для их решения надо хорошо знать свойства классов соединений и их представителей.
Схема 1.
Связь между классами органических соединений
| Предельные углеводороды | → | Галогено- производные |
|
|
| Полипептиды |
| ↕ |
|
|
|
|
| ↑ |
| Этиленовые УВ | ↔ | Спирты | ↔ | Сложные эфиры |
| Аминокислоты |
| ↕ |
| ↕ |
| ↕ |
| ↑ |
| Ацетиленовые УВ | → | Альдегиды | ↔ | Карбоновые кислоты | → | Галогенопроизводные кислот |
| ↕ |
|
|
|
|
|
|
| Ароматические углеводороды | ← | Циклопарафины |
|
|
|
|
| ↓ |
|
|
|
|
|
|
| Нитросоединения | → | Амины |
|
|
|
|
Схема 2.
С2H6 ![]() C2H5Cl
C2H5Cl
+H2 ↑↓ -H2 +H2O↑↓+HCl
C2H4 ![]() C2H5OH
C2H5OH ![]() CH3COOC2H5 NH2CH2COOH
CH3COOC2H5 NH2CH2COOH
+H2↑↓ -H2 +H2↓↑+[О] +H2O↑↓ +C2H5OH ↑+NH3
C2H2![]() CH3COH
CH3COH ![]() CH3COOH
CH3COOH ![]() ClCH2COOH
ClCH2COOH
↓тримеризация
C6H6 ![]() C6H5Cl
C6H5Cl ![]() C6H5OH
C6H5OH
↓+HNO3
C6H5NO2 ![]() C6H5NH2
C6H5NH2
Пример 1. Как перейти от ацетилена к сложному эфиру – этилацетату? Написать уравнение соответствующей реакций.
Решение.
В задаче исходным веществом является не определённый углеводород этилен, конечным – сложный эфир. Очевидно, надо этилен превратить в этиловый спирт, спирт окислить в уксусный альдегид а затем, в уксусную кислоту, после чего произвести этерификацию спирта кислотой. Переход от этилена к спирту осуществляется гидратацией этилена:
![]()
Переход от спирта к альдегиду возможен двумя путями:
дегидрогенизацией спирта:
![]()
окислением спирта:
2H3C-CH2OH+O2 2H3C-COH+H2
Переход от альдегида к кислоте осуществляется с помощью различных окислителей в том числе и кислорода воздух:
2H3C-COH+O2 2H3C-COOH.
Этилацетат получаем реакцией этерификации:
C2H5OH+H3C-COOHC2H5-O-CO-CH3+H2O.
Реакция этерификации протекает медленно (быстро протекают ионные реакции), к тому же она обратима. Обратный процесс называется гидролизом (омылением). Ионы водорода (например, из H2S04, HCl) ускоряют прямую и обратные реакции. Избыток соответствующего вещества смещает равновесие в нужном направлении: избыток воды благоприятствует гидролизу. Избыток спирта или кислоты - этерификации
Задача 2
Написать схему последовательного окисления этане до кислоты и вычислить, сколько граммов уксусной кислоты можно получить из 4,48 л этана, взятого при нормальных условиях?
Решение.
Окисляем этан до спирта:
2 CH3-CH3 + O2 ![]() 2 CH3CH2OH
2 CH3CH2OH
Спирт окисляем дальше до альдегида:
2 CH3CH2OH + 2O ![]() 2 CH3COH + H2O
2 CH3COH + H2O
А альдегид до кислоты:
2 CH3COH + + 2O ![]() 2 CH3COOH
2 CH3COOH
Из 22.4 л г этана получается 60 г уксусное кислоты,
из 4.48 л этана получается X г уксусной кислота,
![]()
Задачи для самостоятельного решения:
1. Какой объем кислорода потребуется для полного сгорания 92 г этилового спирта.
(Ответ: 134,4 л)
2. Какая масса технического карбида кальция, содержащего 30% CaC2 потребуется для получения 12 кг уксусной кислота?
(Ответ: 160 кг).
3. Какой объем ацетилена (н.у.) следует взять для того, чтобы в результате полимеризации получить 443 мл бензола а (ρ= 0,38 г/мл)?
(Ответ: 672 л).
Осуществите превращения:
СН2 = СН2 ![]() Х1
Х1 ![]() Х2
Х2 ![]() Х3
Х3
СН ≡СН ![]() Х1
Х1 ![]() Х2
Х2![]() Х3
Х3
СН2 = СН –СН3 ![]() Х1
Х1 ![]() Х2
Х2 ![]() Х3
Х3
СН3 – СН3 ![]() Х1
Х1 ![]() Х2
Х2 ![]() Х3
Х3
СН4 → СН≡СН → С6Н6 → С6Н5NO2 → C6H5NH2
CH2 = CH2→ CH3 – CH2OH → CH3COH → CH3COOH














