« Фосфор».
Тип урока: информационный, получение новых знаний.
Цель урока: обеспечить усвоение учащимися знаний о фосфоре как химическом элементе и простом веществе.
Задачи урока:
образовательные: овладеть новыми знаниями о фосфоре, его аллотропных видоизменениях, свойствах
воспитательные: способствовать формированию материалистического мировоззрения, обучить диалогической речи и воспитать способность прислушиваться к мнению товарищей и отстаивать своё
развивающие: развивать коммуникативные и творческие способности обучающихся, умения сравнивать и анализировать.
-
Методы обучения: словесный, демонстрационный опыт.

Средства обучения: проектор, призентация.
Формы организации: фронтальная.
Межпредметные связи: биология, география, литература, физика.
Ожидаемые результаты: учащиеся должны уметь различать аллотропные видоизменения фосфора, знать свойства фосфора как простого вещества.
Ход урока:
Эпиграф «Без фосфора нет мысли»
(примечание: высказывание появилось после того, как в 1715 году И. Генсинг обнаружил фосфор в мозговой ткани человека).
Мотивация.
Вступление учителя:
С фосфором знакомы все, кто хотя бы раз держал в руках коробку спичек. Более того, каждый из нас носит в себе довольно много (4,5 кг) этого элемента, но, конечно, в виде химических соединений. Фосфорсодержащие белки присутствуют в мышцах, мозговой ткани и нервах. Но особенно много фосфора содержат кости и зубы: их химический состав почти точно совпадает с формулой минерала фосфорита Ca3(PO4)2.
Фосфор в периодической системы химических элементов таблицы Д.И.Менделеева находится под № 15, это самый мистический и таинственный. Хотите узнать почему?
Пример 1: из воспоминаний академика С.И.Вольфковича «Ночью я шёл из университета по тёмным, неосвещённым улицам Москвы. Моя одежда излучала голубоватое сияние. И за мной каждый раз собиралась толпа, которая видела во мне «новоявленного» представителя потустороннего мира. Вскоре по всей Москве из уст в уста передавались рассказы о «светящемся монахе». Хотите узнать, что это такое?
Пример 2: Ночью на кладбище или болотах можно встретить массу вертящихся над могилами таинственных огоньков. Хотите узнать, что это за явление?
Пример 3: отрывок их произведения А.К.Дойля «Собака Баскервилей: Да!. Это была собака, огромная, чёрная, как смоль. Такой собаки ещё никто из нас, смертных, не видывал. Из её пасти вырывалось пламя, глаза метали искры, по морде и загривку переливался мерцающий огонь. Ни в чьём воспалённом мозгу не могло возникнуть видение более страшное, более омерзительное, чем это адское существо, выскочившее на нас из тумана. Страшный пёс, величиной с молодую львицу. Его огромная пасть светилась голубоватым пламенем, глубоко сидящие дикие глаза были обведены огненными кругами. Я дотронулся до этой светящейся головы и, отняв руку, увидел, что мои пальцы тоже засветились в темноте. Фосфор – сказал я.» Хотите узнать, почему этого на самом деле быть не может?
Пример 4: церковные чудеса ( божественные надписи на иконах, самовозгорание свечи) – всё это обычные реакции фосфора. Хотите узнать, как это происходит?
Пример 5: в переводе с греческого слово «фос» - свет, «ферро» - несу, несущий свет.
Почему его так назвали? Интересно! Хотите ответить на эти вопросы?
Значит мы можем начинать!
План урока:
Всё, что мы уже знаем.
Всё, что мы хотим узнать.
1.Какая информация о фосфоре нам известна?
Каждый ученик по очереди ( их в классе 2) вспоминает знакомый материал и выясняется, что про фосфор многое нам известно:
- это неметалл
- занимает третий период, третий ряд, пятую группу, главную подгруппу
- имеет высший оксид Р2О5
- валентность V и III
- порядковый номер 15
- заряд ядра +15
- имеет 15 электронов с общим зарядом -15
- 15 протонов и 16 нейтронов
- имеет три энергетических уровня
- распределение электронов 2 8 5
- возможные степени окисления +5, -3
На основе текста учебника с. 225 – 226 и текста заполните таблицу аллотропные модификации фосфора (3 – 4 минуты)
| | | |
| Белый фосфор - вещество с молекулярной кристаллической решеткой, состоящей из 4-х атомов в молекуле: P4. Нерастворим в воде, хорошо растворяется в органических растворителях. На воздухе легко окисляется, а в порошкообразном состоянии воспламеняется. Очень ядовит. Светится в темноте. Хранят его под водой | Красный фосфор - темный красно-малиновый порошок. Не растворяется ни в воде, ни в органических растворителях. На воздухе окисляется медленно и не самовоспламеняется. Не ядовит и не светится в темноте. | Черный фосфор - самая малоизученная модификация, имеет слоистую атомную кристаллическую решетку. По внешнему виду похож на графит, является полупроводником. Не ядовит, не светится в темноте. |
Свойства фосфора.
Слайд 1.
Красный фосфор – это порошок. Белый фосфор – воскообразное вещество. Белый и красный фосфор – аллотропные модификации фосфора. Под действием света белый фосфор превращается в красный, поэтому для хранения белого фосфора используют емкости темного стекла. Белый фосфор хранят под водой, во избежание окисления.
Фосфор может переходить из одной аллетропной модификации в другую. Смотрим как это происходит.
Слайд 2.
Убедимся, что белый фосфор более активен, чем красный.
P4 + 5O2 = 2 P2O5
Слайд 3.
С красным фосфором ничего не происходит. Мы увидели, что аллотропные модификации фосфора имеют не только разные физические свойства, но и разную химическую активность. Внимание! Белый фосфор - ядовитое вещество.
Белый фосфор настолько активен, что может загореться прямо на коже.
Теперь посмотрим горение красного фосфора.
4P + 5O2 = 2P2O5
Слайд 4.
Рассмотрим реакцию взаимодействие фосфора с кальцием
3Ca + 2P = Ca3P2
Слайд 5.
Посмотрим как взаимодействует фосфор с хлором
В зависимости от соотношения реагирующих веществ, в результате может получаться хлорид фосфора ( III ) или хлорид фосфора (V ).
2P + 3CI2 = 2PCI3
2P + 5CI2 = 2PCI5
Слайд 6.
С водородом фосфор непосредственно не реагирует в отличие от азота. Но в природе существет вещество состава РН3.
Фосфин. РН3 — чрезвычайно ядовитый газ с чесночным запахом. По своим химическим свойствам он напоминает аммиак, однако, по сравнению с аммиаком является более сильным восстановителем.
Его получают путем гидролиза фосфидов.
При взаимодействии фосфидов с водой выделяется фосфин РН3:
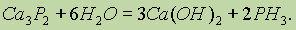
По аналогии с NH3 фосфин способен к реакциям присоединения:
Так, на воздухе фосфин самопроизвольно воспламеняется, реакция протекает весьма энергично с образованием различных кислородных кислот фосфора (в основном ортофосфорной или просто фосфорной кислоты):
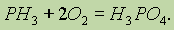
Рассмотрим взаимодействие фосфора со сложными веществами:
Например, при трении спичечной головки, в состав которой входят хлорат калия и сера, о спинку спичечной коробки, в состав которой входит красный фосфор, происходит воспламенение: 6 P + 5 KClO3 = 5 KCl + 3 P2O5.
Посмотрим горение фосфора под водой.
Слайд 7.
Основные пункты записываются в тетрадь.
Гамбургский аптекарь Хеннинг Бранд решил попытать счастья в алхимии и выбраться из нищеты. Он провёл множество опытов и однажды решил провести эксперимент с мочой. Выпарил её досуха и светло-жёлтый осадок смешал с углём и песком, нагревая в реторте без доступа воздуха. В результате ночью заметил, что вещество светится. Так в 1669 году был открыт фосфор. Был Бранд великий предприниматель, он нажился на этом открытии и стал богатым человеком. Он демонстрировал за деньги светящийся фосфор. А способ получения держал в тайне. А позже продал его сразу нескольким учёным.
В тетради: Х.Бранд в 1669 году открыл фосфор.
Фосфор встречается в природе только в виде соединений. С чем это связано? Основные соединения фосфориты и апатиты, в состав которых входит в ортофосфат кальция. Составьте его формулу. Известно около 200 минералов, в состав которых входит фосфор. Содержание фосфора в земной коре 0, 093%. Кроме этого фосфор входит в состав живых организмов: он содержится в мозговых клетках, костной ткани.
В тетради: фосфор содержится в живых организмах (мозговая и костная ткань) , некоторых минералах ( Ca3(PO4)2).
Получение: Ca3(PO4)2+ 3SiO2 + 5C = 3CaSiO3 + 2P + 5CO
Вспомним начало урока. Как объяснить удивительные и мистические свойства фосфора? Выслушиваем версии учащихся.
- «светящийся монах»: академик Вольфкович в своей лаборатории получал фосфор.
Так как эти работы в СССР проводились впервые, то он не предпринял меры предостережения в работе с фосфором – ядовитым, самовоспламеняющимся и светящимся в темноте. Часть газообразного фосфора пропитала его одежду.
- светящиеся огоньки на кладбищах и болотах объясняются тем, что при гниении остатков человека и животных образуется вещество фосфин РН3. На воздухе он самовоспламеняется.
- собака, намазанная фосфором, в произведении «Собака Баскервилей» никак не могла бы жить и тем более бежать, она просто бы погибла.
- церковные чудеса объясняются следующей реакцией: на фитиль свечи или икону наносят раствор фосфора в сероуглероде. Растворитель испаряется, а оставшиеся крупинки фосфора окисляются кислородом воздуха и самовоспламеняются.
3. Домашнее задание: § 32 с.225 – 227 (до соединений фосфора); подготовить доклады: Оксана «Применение фосфора и его соединений», Даша «Биологическое значение фосфора и его соединений»
Известно несколько аллотропных видоизменений фосфора. Наиболее известные белый и красный фосфор. Вспоминаем, что такое аллотропия, какие элементы имеют аллотропные модификации?
В тетради: сравнительная характеристика:
| Характеристика | Свойства фосфора |
| белого | красного |
| Агрегатное состояние | Кристаллическое вещество | Порошкообразное вещество |
| Цвет | Бесцветный с желтоватым оттенком | Темно-красный |
| Запах | Чесночный | Без запаха |
| Плотность,г/см3 | 1,8 | 2,3 |
| Растворимость в воде | Не растворяется | Не растворяется |
| Растворимость в сероуглероде | Хорошо растворяется | Не растворяется |
| Температура плавления | 44 | При сильном нагревании превращается в пары белого фосфора |
| Температура воспламенения | 40, в измельчённом состоянии при обычной температуре | 260 |
| Свечение | Светится в темноте | Не светится |
| Действие на организм | Сильный яд ( доза 0,15 г смертельна для человека) | Не ядовит |
Чем объясняются различия в свойствах? Рассматриваем рисунок в учебнике (схемы строения кристаллической решётки). Как доказать, что это аллотропные видоизменения одного и того же элемента.
4Р + 5О2 = 2Р2О5 + Q Это один из примеров реакций, при которых химическая энергия превращается в световую ( фосфоресценция).
- производство спичек:
С 1806 по 1855 год учёные постепенно усовершенствовали спички, при этом даже есть примеры гибели как первых потребителей, так и самих учёных ( так как вначале применяли в составе спичек белый фосфор). В 1855 году на международной выставке в Париже были представлены так называемые безопасные спички, и это изобретение получило золотую медаль.
- он входит в состав минеральных удобрений, так как фосфор – один из основных элементов питания растений
- во время войны его использовали для приготовления дымовых и зажигательных составов, фосфорные бомбы использовали в 2004 году американские войска во время иракского конфликта.
Физические свойства Фосфора. Элементарный Фосфор существует в виде нескольких аллотропических модификаций, главные из которых - белая, красная и черная.
Белый Фосфор - воскообразное, прозрачное вещество с характерным запахом, образуется при конденсации паров Фосфора. Белый Фосфор в присутствии примесей - следов красного Фосфора, мышьяка, железа и т. п. - окрашен в желтый цвет, поэтому товарный белый Фосфор называется желтым. Белый Фосфор ядовит: на воздухе при температуре около 40 °С самовоспламеняется, поэтому его следует хранить под водой. Нагреванием белого Фосфора без доступа воздуха при 250-300 °С в течение нескольких часов получают красный Фосфор.
Обычный товарный красный Фосфор практически полностью аморфен; имеет цвет от темно-коричневого до фиолетового. Красный Фосфор на воздухе не самовоспламеняется, вплоть до температуры 240-250 °С, но самовоспламеняется при трении или ударе; нерастворим в воде. При температуре возгонки красный Фосфор превращается в пар, при охлаждении которого образуется в основном белый Фосфор.
При нагревании белого Фосфора до 200-220 °С под давлением образуется черный Фосфор. Черный Фосфор представляет собой кристаллы ромбической структуры, решетка построена из волокнистых слоев с характерным для Фосфора пирамидальным расположением атомов. По внешнему виду черный Фосфор похож на графит; полупроводник:. При нагревании до 560-580 °С под давлением собственных паров превращается в красный Фосфор. Черный Фосфор малоактивен, с трудом воспламеняется при поджигании, поэтому его можно безопасно подвергать механической обработке на воздухе.
Химические свойства Фосфора. Конфигурация внешних электронов атома Фосфор 3s23p3; в соединениях наиболее характерны степени окисления +5, +3, и -3. Подобно азоту, Фосфор в соединениях главным образом ковалентен. Ионных соединений, подобных фосфидам Na3P, Са3Р2, очень мало.
Фосфор химически активен, наибольшей активностью обладает белый Фосфор; красный и черный Фосфор в химических реакциях гораздо пассивнее. Окисление белого Фосфора происходит по механизму цепных реакций. Окисление Фосфора обычно сопровождается хемилюминесценцией. При горении Фосфора в избытке кислорода образуется оксид (V) Р4O10 (или Р2О5), при недостатке - в основном оксид (III) Р4О6 (или Р2О3).
Фосфор непосредственно соединяется со всеми галогенами с выделением большого количества тепла и образованием тригалогенидов (РХ3, где X - галоген), пентагалогенидов (РХ5) и оксигалогенидов (например, РОХ3).
При сплавлении Фосфора с серой ниже 100 °С образуются твердые растворы на основе Фосфора и серы, а выше 100 °С происходит экзотермическая реакция образования кристалличических сульфидов P4S3, P4S5, P4S7, P4S10, из которых только P4S5 при нагревании выше 200 °С разлагается на P4S3 и P4S7, а остальные плавятся без разложения. Известны оксисульфиды фосфора: P2O3S2, P2O2S3, P4O4S3, P6O10S5 и P4O4S3.
Фосфор по сравнению с азотом менее способен к образованию соединений с водородом. Фосфористый водород фосфин РН3 и дифосфин Р2Н4 могут быть получены только косвенным путем.
Из соединений Фосфора с азотом известны нитриды PN, P2N3, P3N5 - твердые, химически устойчивые вещества, полученные при пропускании азота с парами Фосфора через электрическую дугу.
При температурах выше 2000°С Фосфор реагирует с углеродом с образованием карбида РС3- вещества, не растворяющегося в обычных растворителях и не взаимодействующего ни с кислотами, ни со щелочами. При нагревании с металлами Фосфор образует фосфиды.
Фосфор образует многочисленные фосфорорганические соединения.
Получение Фосфора. Производство элементарного Фосфора осуществляется электротермическим восстановлением его из природных фосфатов (апатитов или фосфоритов) при 1400-1600 °С коксом в присутствии кремнезема (кварцевого песка):
2Са3(РО4)2 + 10С + nSiO2 = P4 + 10СО + 6СаО·nSiO2
| Белый фосфор | Красный фосфор | Черный фосфор |
|
|
|
|
























