Типы химических реакций на примере свойств воды
Цель урока: Познакомить учащихся с химическими свойствами воды и рассмотреть их по признаку “число и состав исходных веществ и продуктов реакции”, рассмотреть условия взаимодействия оксидов металлов и неметаллов с водой, рассмотреть понятия электролиз, фотолиз, гидролиз, продолжить формирование умений составлять уравнения химических реакций, определять тип химических реакций по числу и составу реагирующих веществ и продуктов.
Задачи:
Образовательные задачи:
применение знаний, умений и навыков в новых условиях - создание проблемной ситуации;
контроль и самоконтроль знаний, умений и навыков с помощью домашней работы;
уметь устанавливать существенные признаки, являющиеся основой различных классификаций;
уметь составлять уравнения химических реакций, определять тип химических реакций по числу и составу реагирующих веществ и продуктов
Развивающие задачи:
развитие умений сравнивать, обобщать, правильно формулировать задачи и излагать мысли;
развитие логического мышления, внимания и умения работать в проблемной ситуации.
Воспитательные задачи:
формирование у учащихся познавательного интереса к химии;
воспитание таких качеств характера, как настойчивость в достижении цели;
воспитание интереса и любви к предмету через содержание учебного материала, умение работать в коллективе, взаимопомощи, культуры общения.
Элементы содержания: электролиз, фотолиз, фотосинтез, гидролиз
Оборудование: натрий, карбид кальция, оксид кальция, оксид железа, вода, медиапроектора, наборы для лабораторной работы, фенолфталеин, пробирки, штатив для пробирок, флаконы с реактивами.
Тип урока: изучения нового материала
План урока:
1. Организационный момент.
2. Промежуточный контроль знаний.
3. Изучение новой темы.
4. Закрепление.
5. Домашнее задание.
6. Рефлексия
Ход урока
I. Организационный момент.
Цель: подготовиться к проведению урока, к наиболее эффективной работе на уроке.
Проверяется готовность к уроку, раздаются план урока (Приложение 1), листы с тестом (Приложение 2), инструкции для выполнения лабораторной работы (Приложение 5), лотки с демонстрационным материалом, лист наблюдений (Приложение 5), объявляются этапы урока.
Вступительное слово учителя. На этом уроке мы рассмотрим новую тему “Типы химических реакций на примере свойств воды”. Для этого нам нужно вспомнить материал, который мы уже прошли в темах “Типы химических реакций”, “Химические уравнения”. Сейчас мы выполним тест по этим темам.
II. Промежуточный контроль знаний по темам “Типы химических реакций”, “Химические уравнения” по технологии “Взаимопередачи заданий”
Цель: проверить умения составлять уравнения химических реакций, определять тип химических реакций по числу и составу реагирующих веществ и продуктов и продолжить формировать эти умения в случае недостаточной сформированности..
Учащиеся выполняют тест – 5 минут (Приложение 2). После того, как учащиеся выполнят тест, необходимо проверить работу соседа и поставить оценку, затем тесты передать на проверку учителю. Учитель просит класс поднять руки, кто написал тест на 5 или 4 балла. На закрытой доске или на экране медиапроектора открывают заранее подготовленные ответы теста для самопроверки.
Для медиапроектора, правильные варианты
Тест по темам “Типы химических реакций”, “Химические уравнения”
Время выполнения - 5 минут
I вариант
Расставьте коэффициенты в схемах реакций, укажите тип химической реакции по признаку “число и состав исходных веществ и продуктов реакции”
1 часть карточки
1. 2 Cu + O2 — 2 CuO реакция соединения
2. 2 Fe(OH)3 — Fe2O3 + 3 H2O реакция разложения
2 часть карточки
3. 2 AL + 3 CuBr2 — 2 AlBr3 + 3 Cu реакция замещения
4. 3 Ca(OH)2 + 2 Na3PO4 — Ca3(PO4)2 + 6 NaOH реакция обмена
II вариант
Расставьте коэффициенты в схемах реакций, укажите тип химической реакции по признаку “число и состав исходных веществ и продуктов реакции”
1 часть карточки
1. 2 Cr(OH)3 — Cr2O3 + 3 H2O реакция разложения
2. Si + 2 F2 — SiF4 реакция соединения
2 часть карточки
3. 2 Fe(OH)3 + 3 H2SO4 — Fe2(SO4)3 + 6 H2O реакцияобмена
4. 2 FeBr3 + 3 Zn —3 ZnBr2 + 2 Fe реакция замещения
III. Изучение нового учебного материала.
Учебная цель: В результате этого урока мы должны рассмотреть химические свойства воды. В ходе урока мы узнаем, в каких реакциях разложения, соединения, замещения и обмена участвует вода. Вывод цели с помощью учеников
Слово учителя: Моя цель на уроке рассказать вам об этом, помочь вам запомнить эти реакции, и мы продолжим учиться составлять уравнения химических реакций, определять тип химических реакций по числу и составу реагирующих веществ и продуктов.
Основные положения нового учебного материала, который вы сегодня должны освоить.
Самое удивительное вещество на нашей планете - оксид водорода H2O
Доклад ученика (Приложение 3), возможно презентация, индивидуальная форма работы
В это время ученики составляют конспект доклада в объеме пяти предложений.
Примерное содержание конспекта
Россия занимает первое место в мире по запасам пресной воды.
Вода в России сосредоточена в реках, озерах, водохранилищах
40% суши – это засушливые и полузасушливые регионы мира, имеют только 2% мировых запасов пресной воды
Наш регион также относится к засушливым регионам
Вскоре 2/3 населения планеты будут жить в странах, испытывающих нехватку воды.
Химические свойства воды. Объяснение с опорой на знания учеников.
1. Реакция разложения. Что такое реакция разложения?
Сегодня мы познакомимся с новым типом реакций разложения - электролиз
Электролиз – реакция, протекающая под действием постоянного электрического тока
электрический ток
2H2O — 2H2 + O2
Давайте вспомним процесс фотосинтеза.
Доклад ученика (Приложение 4), возможно презентация, индивидуальная форма работы
Здесь мы познакомимся с еще одним типом реакции разложения
Фотолиз – разложения воды под действием света
свет, пластиды
2H2O — 2H2 + O2
H2 + CO2 — C6H12O6 (схема процесса)
Совокупность этих процессов называют фотосинтезом
Уравнение реакции фотосинтеза (реакция синтеза)
свет, пластиды
6CO2 + 6H2O — C6H12O6 + 6O2
Коэффициенты в уравнении реакции выставляются с опорой на знания учеников фронтально или у доски вызванным учеником
2. Реакции соединения. Фронтальный опрос класса: дать определение реакции соединения.
Сегодня мы рассмотрим реакции соединения на примере взаимодействия оксидов металлов и неметаллов с водой
1. Реакция гашения извести
Запись реакции на доске, с помощью ученика, демонстрация ее учителем и демонстрация ЦОР, видео “Взаимодействие оксида кальция с водой”,
| CaO + H2O
негашеная известь | — | Ca(OH)2
гашеная известь |
гидроксид кальция, растворимое основание, щелочь
Обратить внимание учеников, что такое щелочь
Закрепление. Фронтальный опрос: Что такое щелочь? (Щелочи – это растворимые основания.)
Какие металлы и оксиды каких металлов образуют растворимые основания – щелочи? (Щелочи образуют металлы I группы, главной подгруппы, металлы II группы, главной подгруппы, начиная с кальция.)
2. Реакция образования растворимых, кислородсодержащих кислот из оксидов неметаллов
P2O5 + 3 H2O — 2H3PO4 фосфорная кислота или гидроксид фосфора
Обратить внимание учеников, что гидроксиды – это не только основания, но и кислородсодержащие кислоты.
Составить схему
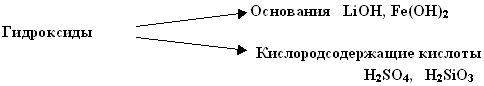
Правило – вода реагирует с оксидами металлов и неметаллов, если образуются растворимые гидроксиды (основания или кислоты)
Закрепление, фронтальный опрос: Посмотрите в учебник, страница 171, и объясните, почему в одном случае оксиды взаимодействуют с водой, а других случаях взаимодействие не происходит?
Выполнение Лабораторной работы “Исследование взаимодействия оксидов металлов с водой” (Приложение 5), работа в группах, по методу КСО
Организация работы класса. Перед началом работы один ученик напоминает правила техники безопасности всему классу.
Класс делится на малые группы по 4 человека, например, по скорости работы или по желанию учащихся.
Во всех группах учащимся раздаются инструкции лабораторной работы.
3. Реакции замещения. Объяснение учителя с опорой на знания учеников.
Что такое реакция замещения?
Уравнение реакции взаимодействия натрия с водой на доске записывает вызванный ученик, остальные ученики в Приложение 1. План урока. После этого демонстрируется ЦОР “Взаимодействия натрия с водой” и объясняются учителем особенности эксперимента.
4. Реакция соединения. Объяснение учителя с опорой на знания учеников.
Актуализация знаний. Что такое реакция соединения? Почему в таблице растворимости в некоторых клетках стоят прочерки?
Гидролиз – это реакция обменного разложения вещества с водой. То есть это одновременно реакция и обмена и разложения.
Демонстрация опыта учителем и объяснение его результатов с записью уравнения на доске учеником
Са3Р2 + 6 Н2О = 2РН3 + 3 Са(ОН)2
Гидролиз фосфида кальция.
IV. Закрепление учебного материала
Учебная цель: Закрепить новые понятия и учебные навыки
Фронтальный опрос:
Что такое электролиз воды?
Что такое фотолиз воды?
Что такое гидролиз?
Что объединяет эти реакции?
Использование ЦОР
Интерактив. Химические свойства воды
Задание учащимся во время просмотра ресурса
1. Расставить коэффициенты
2. Определить тип реакции
V. Задание на дом
Представлено в рабочих листах.
Цель: выучить реакции соединения, разложения, обмена, замещения на примере реакций с участием воды, научиться писать эти реакции самостоятельно, уметь применять полученные знания в новой ситуации (проблемный вопрос).
Формулируется проблемный вопрос, для домашнего задания, выставляются оценки за урок, уметь применять полученные знания в новой ситуации (проблемный вопрос).
Домашнее задание.
Проблемный вопрос. Как химические свойства воды зависят от строения молекулы воды и химической связи этой молекулы?
Параграф 33 “Типы химических реакций на примере свойств воды”, страница168-173, упражнение 1-3
VI. Рефлексия
Обсуждение с учащимися, что понравилось в проведенном уроке, а что вызвало затруднение.
Список литературы.
1. Химия 8, 9 класс. Мультимедийное приложение к учебнику О.С.Габриеляна. Электронное учебное издание. ООО “Дрофа” 2011.
2. Планирование к учебнику “Химия”, 8, 9 класс, Габриелян О.С. Единая коллекция цифровых образовательных ресурсов
Приложение. Вода.
Вода – самое привычное и самое необычное вещество на планете. Нет на Земле вещества более важного для нас, чем обыкновенная вода, и в то же время не существует другого такого же вещества, в свойствах которого было бы столько противоречий и аномалий, сколько в её свойствах.
Почти ¾ поверхности нашей планеты занято океанами и морями. Твёрдой водой – снегом и льдом – покрыто 20% суши. Поверхностные воды сосредоточены в Мировом океане - 91% всей воды на Земле. Поверхность Мирового океана (акватория) составляет 361 млн/км квадратных. Она в 2 раза больше площади суши, занимающей 149 млн/км квадратных. Если распределить воду ровным слоем, то она покроет Землю толщиной в 3000 метров. На каждого жителя Земли приблизительно приходится 0,33 кубических километров морской воды и 0,008 кубических километров пресной воды. Подавляющая часть пресной воды на Земле находится в таком состоянии, которое делает её труднодоступной для человека. Почти 70% пресных вод заключено в ледниковых покровах полярных стран и в горных ледниках, 30% - в водоносных слоях под землёй, а в руслах всех рек содержатся одновременно всего лишь 0,006% пресных вод.
Тело человека почти на 63 – 68 % состоит из воды. Почти все биохимические реакции в каждой живой клетке – это реакции в водных растворах. С водой удаляются из нашего тела ядовитые шлаки; вода, выделяемая потовыми железами и испаряющаяся с поверхности кожи, регулирует температуру нашего тела. Большинство обитателей земного шара и растения состоят более чем на половину из воды. Например, млекопитающие содержат 60 – 68 %; рыбы – 70 %; водоросли – 90 – 98 %.
В растворах же (преимущественно водных) протекает большинство технологических процессов на предприятиях химической промышленности, в производстве лекарственных препаратов и пищевых продуктов.
Вода – это важный источник энергоресурсов. Все гидроэлектри-ческие станции мира, от маленьких до самых крупных, превращают механическую энергию водного потока в электрическую исключительно с помощью водяных турбин с соединёнными с ними электрогенераторами. На атомных электростанциях атомный реактор нагревает воду, водяной пар вращает турбину с генератором и вырабатывает электрический ток.
От воды зависит климат планеты. Геофизики утверждают, что Земля давно бы остыла и превратилась в безжизненный кусок камня, если бы не вода. У неё очень большая теплоёмкость. Нагреваясь, она поглощает тепло; остывая, отдаёт его. Земная вода и поглощает, и возвращает очень много тепла и тем самым "выравнивает" климат. А от космического холода предохраняет Землю те молекулы воды, которые рассеяны в атмосфере – в облаках и в виде паров… без воды обойтись нельзя – это самое важное вещество на Земле.
Молекулы воды обнаружены в межзвёздном пространстве. Вода входит в состав комет, большинства планет солнечной системы и их спутников.
Примерно до конца 19 века вода считалась бесплатным неистощимым даром природы. Её не хватало только в слабонаселённых районах пустынь. В 20 веке взгляд на воду резко изменился. В результате быстрого роста населения земного шара и бурного развития промышленности проблема снабжения человечества чистой пресной водой стала чуть ли не мировой проблемой номер один. В настоящее время люди используют ежегодно около 3000 млрд кубических метров воды, и эта цифра непрерывно быстро растёт. Во многих густонаселённых промышленных районах чистой воды уже не хватает.
В настоящее время проблема загрязнения водной среды является очень актуальной, т.к. сейчас люди начинают забывать всем известное выражение «вода – это жизнь». Без воды человек не может прожить более трех суток, но, даже понимая всю важность роли воды в его жизни, он все равно продолжает наносить вред водным объектам, безвозвратно изменяя их естественный режим сбросами и отходами.
Каждый житель Земли в среднем потребляет 650 м кубических воды в год (1780 литров в сутки). Однако для удовлетворения физиологических потребностей достаточно 2,5 литра в день, т.е. около 1 м кубического в год. Большое количество воды требуется сельскому хозяйству (69%) главным образом для орошения; 23% воды потребляет промышленность; 6% расходуется в быту.
Недостаток пресной воды на земном шаре можно восполнить различными путями: опреснять морскую воду, а также заменять ею, где это возможно в технике, пресную воду; очищать сточные воды до такой степени, чтобы их можно было спокойно спускать в водоёмы и водотоки, не боясь загрязнить, и использовать вторично; экономно расходовать пресную воду, создавая менее водоёмкую технологию производства, заменяя, где это можно, пресную воду высокого качества водой более низкого качества и т.д.
Вода участвует во многих химических реакциях, например, в живых организмах – фотосинтез, дыхание, передвижение веществ к органам и тканям. В воде растворяются оксиды, образуя кислоты и щелочи. Гидролиз – это разложение веществ водой.
Загрязнение нефтью и нефтепродуктами приводит к появлению нефтяных пятен, что затрудняет процессы фотосинтеза в воде из-за прекращения доступа солнечных лучей, а также вызывает гибель растений и животных. Каждая тонна нефти создает нефтяную пленку на площади до 12 кв. км. Восстановление пораженных экосистем занимает 10-15 лет.
Загрязнение сточными водами в результате промышленного производства, минеральными и органическими удобрениями в результате сельскохозяйственного производства, а также коммунально-бытовыми стоками ведет к эвтрофикации водоемов – обогащению их питательными веществами, приводящему к чрезмерному развитию водорослей, и к гибели других водных экосистем. Загрязнение ионами тяжелых металлов нарушает жизнедеятельность водных организмов и человека.
Кислотные дожди приводят к закислению водоемов и к гибели экосистем.
Радиоактивное загрязнение связано со сбросом в водоемы радиоактивных отходов.
Тепловое загрязнение вызывает сброс в водоемы подогретых вод ТЭС и АЭС, что приводит к массовому развитию сине-зелёных водорослей, так называемому цветению воды, уменьшению количества кислорода и отрицательно влияет на флору и фауну водоемов.
Механическое загрязнение повышает содержание механических примесей.
Бактериальное и биологическое загрязнение связано с разными патогенными организмами, грибами и водорослями непроточной водой (озер, прудов), а иногда к заболачиванию местности
| Методическая информация |
| Дата |
|
| Учитель | Набиуллина Татьяна Федоровна |
| Школа | МБС(К)ОУ « Школа-интернат №1 VII вида» г.Перми |
| Предмет | Химия |
| Класс | 8 |
| Название учебного пособия и образовательной программы | Габриелян О.С. Химия. 8 класс – М.: Дрофа, 2010 Программа «курс химии для 8-11 классов общеобразовательных учреждений (авт. Габриелян О.С. – М.:Дрофа, 2010) |
| Название темы и раздела учебного курса | Название раздела «Изменения, происходящие с веществами» Тема урока «Типы химических реакций на примере свойств воды» |
| Тип урока | Изучения нового материала |
| Цели урока | изучить химические свойства воды и рассмотреть их по признаку «число и состав исходных веществ и продуктов реакции», рассмотреть условия взаимодействия оксидов металлов и неметаллов с водой, рассмотреть понятия электролиз, фотолиз, гидролиз, продолжить формирование умений составлять уравнения химических реакций, определять тип химических реакций по числу и составу реагирующих веществ и продуктов. |
| Задачи урока | Образовательные: сформировать знания учащихся о составе, строении и свойствах воды, закрепить знания о типах химических реакций, научить комментировать слайды и работать с компьютерными схемами. Продолжить формирование умений работать самостоятельно с учебником, текстом, тестами. Развивающие: развивать наблюдательность, память при просмотре компьютерной презентации и демонстрационного эксперимента. Развивать умение сравнивать, прогнозировать, обобщать и делать выводы. Развивать информационную культуру учащихся. Воспитательные: воспитывать бережное и экономное отношение к водным ресурсам, продолжить экологическое просвещение школьников, прививать заботу к окружающей среде и своему здоровью, развивать чувство прекрасного. |
| Формируемые химические знания, умения, навыки учащихся: | систематизация знаний учащихся о распространенности воды в природе, физических и химических свойствах, областях применения воды, о типах химических реакций, расширение знаний учащихся об экологических проблемах, связанных с охраной воды. |
| Формируемые компетенции:
| учебно-познавательная компетенция: развитие умений сравнивать, анализировать, доказывать, составлять схемы на основе работы с текстом, быть способными решать следующие жизненно-практические задачи: умение давать оценку состояния окружающей среды, выдвижение своих идей по охране водных ресурсов родного края; информационная компетенция: развитие умения анализировать и отбирать необходимую информацию, умения готовить и делать сообщения, умения пользоваться Интернатом для поиска учебной информации; коммуникативная компетенция: развитие умений вести беседу, диалог, задавать вопросы. |
| Формы организации работы детей: | групповая (просмотр презентации, работа с текстом), индивидуальная (беседа, работа с тестом), проблемное обучение (решение проблемных вопросов). |
| Формы организации работы учителя: | организует эмоциональный настрой учащихся, вводит детей в тему урока, обобщает ранее полученные знания, организует беседу по слайдам и опытам, анализирует и дополняет ответы детей, создает проблемные ситуации. |
| Оборудование, дидактический материал | Компьютер, презентация, видеоопыты тексты, тесты, таблица «Изменение окраски индикаторов» |
Ход урока.
| Этапы урока Методы | Содержание этапов |
| 1.Орг. момент Цель: подготовиться к проведению урока, к наиболее эффективной работе на уроке.
| Приветствие. Проверяется готовность к уроку, раздаются), листы с заданием (Приложение ), инструкции для выполнения лабораторной работы (Приложение), лотки с демонстрационным материалом, лист наблюдений (Приложение), объявляются этапы урока.
|
| Повторение | Химия это |
| 2.. Промежуточный контроль знаний. Цель: определять тип химических реакций по числу и составу реагирующих веществ и продуктов и продолжить формировать эти умения в случае недостаточной сформированности | Тестирование по теме: «Типы химических реакций» Найдите соответствие: 1) Реакция соединения a) АВ = А+ В 2) Реакция разложения b) А+В=АВ 3) Реакция замещения c) А+ СД=АД+С 4) Реакция обмена d) АВ+СД=АД+СВ
Найдите соответствие: 1) Реакция соединения a) 2Na +2 H2O = 2NaОН + H2 2) Реакция разложения b) BaO +H2O = Ba(OH)2 3) Реакция замещения c) 2KOH + H2SO4 = K2SO4 + 2H2O 4) Реакция обмена d) 2NH3 = N2 + 3H2 Назовите вещества
|
| 3. Активизация познавательной деятельности (проблемная ситуация) | Ребята Перед вами черный ящик. Ваша задача догадаться о каком из названных вами веществ идет речь: (Даю подсказку) - - у него есть свой день в календаре 22 марта; - это вещество может принимать разную форму, и агрегатное состояние и здесь оно находится в жидком состоянии; - это самое главное вещество для нас в окружающем мире. О чем идет речь? Формула этого вещества? (H2O) Ну и при чем тут вода если мы изучаем типы хим реакций? Значит мы будем изучать….. типы химических реакций на примере свойств воды На доске Тема: «Типы химических реакций на примере свойств воды» Цель: определить характерны ли для воды, те типы реакций которые мы изучили (разложения, соединения, замещения, обмена). Как? -Предполагать (выдвигать гипотезу). -Подтверждать гипотезу опытами и делать выводы,т.е провести исследование Задачи реакции разложения на примере воды, - реакции соединения на примере воды - реакции замещения на примере воды - реакции обмена на примере воды
|
| 4.Изучение нового материала
Самостоятельная работа в парах
Посмотрите видеоопыт
О.А.
Л.О.
Словесно-наглядный
ДЕМ. опыт
Словесно-наглядный
Видиоопыт
ОА | Химические свойства воды. Реакция разложения: Допишите уравнение реакции расставте коэффициенты, , назовите вещества 2H2 O Эл. Ток__ 2H2 + O2 Реакция разложения Прпр Какие условия необходимо создать для протекания реакции Теперь вы знаете, что если через воду пропустить эл. ток, то она разлагается на водород и кислород. Такие реакции разложения, которые протекают под действием эл тока, называются …..электролизом А водород хорошо горит, и это свойство используют в качестве топлива для движения автомобилей. Подобные процессы разложения протекает и в зеленых листьях, только вместо эл тока используется энергия солнца. Вы помните из курса ботаники, что этот процесс называется фотолиз. 2H2 O свет____ 2H2 + O2 и Еще О.А. А знаете ли вы … . Контрольное Задание 1 (взаимопроверка 1 бал) Электролизом называют реакции разложения, которые протекают под действием (выберите правильный ответ): А) электрического тока, Б) температуры, В) давления , Г) осадков.
Реакция соединения: Запишите обратную реакцию, реакции разложения (2H2+ O22H2O) Лабораторная работа ( «Исследование взаимодействия оксидов металлов и неметаллов с водой»
Правило: Вода реагирует с оксидами только в том случае, если образуется растворимый гидроксид.
Реакция оксида металла с водой происходит в том случае, если образуется растворимое основание – щёлочь. Оксиды неметаллов, взаимодействуя с водой, образуют растворимые кислоты, в которых неметалл будет иметь ту же степень окисления, что и в соответствующем оксиде. Посмотрим таблицу растворимости. Кремниевая кислота и гидроксид железа не растворимы..А еще….
Контрольное задание 2 (взаимопроверка 1 бал) 5. Вода реагирует с оксидами металлов и оксидами неметаллов в том случае, если получается: 1) растворимый оксид 2) нерастворимое вещество 3) растворимый гидроксид 4) всегда 2. Какие оксиды не будут реагировать с водой: 1) Na2O 2) FeO 3) SiO2 4) P 2O5
Реакция замещения: Перейдём к следующему опыту. Какие вещества вступили в реакцию? Какие вещества образовались? Запишем уравнение реакции, назовем вещества Ca + 2HOН = Ca(OH)2 + Н2 К какому типу относится данная реакция? Сл реакция самостоятельно Контрольное задание 3 (взаимопроверка 1 бал) Ва+ HOН → Ва (OH)2 + Н2
Реакция обмена Если вы обратите внимание на уже знакомую вам таблицу растворимости гидроксидов и солей в воде, то заметите, что в некоторых клетках этой таблицы стоят прочерки, которые обозначают, что данное вещество в водной среде разлагается, или как говорят, гидролизуется. Посмотрим последний видеофрагмент. Запишем уравнение реакции. CaC2 + 2HOH = Ca(OH)2↓ + C2H2↑ Гидролиз может быть обратимым и необратимым. Мы рассмотрели пример необратимого гидролиза. А знаете ли Вы? Контрольное задание 4(взаимопроверка 1 бал) FeS + HOH →
|
| 5.закрепление | Итоговое контрольное задание:
Сегодня на уроке мы еще раз убедились, что вода удивительное вещество и участвует во всех типах химических реакций. Я предлагаю вам задание Задание «Удивительная цифра». Обвести верные ответы кружком ( у учащихся карточки ).
|
| 6.Полведение итога | Давайте вернемся к нашей теме урока Что узнали на уроке? В какие типы химических реакций она вступает? А пригодятся ли вам полученные знания на уроке в жизни? Как вы думаете, достигли мы цели? Что мы делали для этого?
|
| 7. Домашнее задание | Доклад «Самое удивительное вещество на нашей планете - оксид водорода
|
| 8.Рефлексия |
|
















