Сценарий урока
Тема урока: «Кислород»
Цели урока:
актуализировать знания учащихся о положении элемента кислорода в ПСХЭ Д.И. Менделеева;
дать понятие о кислороде как о химическом элементе и простом веществе: химические свойства кислорода: взаимодействие с простыми веществами (металлами и неметаллами), сложными веществами; применение кислорода.
актуализировать понятия: горение, дыхание и фотосинтез;
дать понятие о способах получения кислорода и биологическом значении кислорода.
Образовательные:
совершенствовать умения определять цель работы, фиксировать наблюдения;
записывать уравнения реакций согласно эксперименту;
делать выводы на основе наблюдений согласно поставленной цели;
Развивающие:
развивать речь учащихся;
развивать логическое мышление, умение анализировать, делать выводы;
развивать общеучебные компетенции: умение слушать, делать записи, применять полученные знания в практической деятельности.
Воспитательные:
формировать естественно-научное мировоззрение учащихся;
воспитывать положительное отношение к предмету;
поддерживать интерес к науке «химия».
Ход урока
Организационный момент. Мотивация познавательной деятельности. Постановка цели и задач урока
Учитель: Ребята, здравствуйте. Я рада приветствовать вас и желаю вам доброго дня.
1 факт. Необычное хобби
Страстью Дмитрия Ивановича, о которой в наши дни мало кому известно, было изготовление чемоданов. Удивительно, но в Москве и Санкт-Петербурге он сумел завоевать репутацию самого выдающегося чемоданных дел мастера. Конечно же, купцы с удовольствием приобретали у ученого чемоданы, гордясь тем, что изделия куплены у самого светила науки. Однако не только слава, которой уже тогда пользовался Дмитрий Иванович, заставляла их обращаться к нему. Интересно, что вещи в самом деле были необычайно качественными и долговечными. Их поразительная прочность обеспечивалась с помощью особой клеевой смеси, на которой гений остановился после исследования других рецептов создания клея. К сожалению, рецепт, изобретенный Менделеевым, так и остался тайной для потомков, так как он не пожелал придать его гласности. Известно также, что талантливый ученый с удовольствием занимался переплетением книг, ему нравилось и клеить рамки, предназначенные для портретов. Увлечения помогали ему расслабиться и отдохнуть от трудовой деятельности.
Учитель: Ребята, мы продолжаем изучать раздел «Неметаллы» и сегодня мы рассмотрим еще одного представителя этой группы.
- О каком химическом элементе идет речь в следующем стихотворении? (Приложение 1)
Постановка целей:
История открытия кислорода
Положение элемента в ПСХЭ
Нахождение кислорода в природе, физические свойства газа.
Химические свойства и получение кислорода
Применение кислорода.
Изучение нового материала.
Изучение нового материала осуществляется в группах:
1-я группа – История открытия и положение элемента в ПСХЭ
2-я группа – Физические свойства и Кислород в природа.
3-я группа – Химические свойства кислорода.
4-я группа – Получение и применение кислорода.
Итог работы – составление кластера по теме «Кислород» (на ватмане)
Учитель: Элементы этой подгруппы: кислород, сера, селен, теллур имеют общее название «халькогены», что означает в переводе с греческого «рождающие руды».
А ведь и в самом деле основные руды, используемые в металлургической промышленности, представляют собой соединения родоначальников подгруппы кислорода – оксиды:
а) Красный железняк (гематит) – Fe2O3
б) Бурый железняк (лимонит) - 2Fe2O3 ∙ 3 Н2О
в) Магнитный железняк (магнетит) – Fe3O4
и серы:
г) Железный колчедан (пирит) – FeS2
д) Медный колчедан- CuFeS3
е) Цинковая обманка – ZnS
ж) Свинцовый блеск - PbS
Мы с вами уже изучали некоторые руды, в состав которых входят эти элементы (при изучении темы «Железо»
1 группа
Задание № 1. «История открытия» - работаю с текстом, по ходу работы заполняют таблицу. Приложение 2.
Задание № 2. Положение кислорода в ПСХЭ по плану:
Химический знак
Порядковый номер
Номер периода
Номер группы
Заряд ядра
Число энергетических уровней
Распределение электронов по энергетическим уровням
Электронная формула
Степени окисления
Химическая связь (в молекуле –КНП, с Немет. – КП, с Мет – ионная)
|
| Химический знак | Порядковый номер | Номер периода | Номер группы | Заряд ядра | Число энергетических уровней | Распределение электронов по э.у. | Электронная формула | Степень окисления |
| Кислород | О | 8 | II | VI (А) | +8 р= +8; n = 8; e = - 8 | 2 | +8 )2)6 | 1s22s22p4 | (-2), в соединении OF2 (+2) |
2 группа
Задание № 1. Прочитать текст, заполнить таблицу(Приложение 3)
|
| Агрегатное состояние | Цвет | Запах | Вкус | tº плавления, ºС | tº кипения, ºС | Аллотропное состояние |
| Кислород | Газ При tº= -183º, С – жидкость; При tº= -218 º - кристаллы | Без цвета Бледно-голубая синие | Без запаха | Без вкуса | - 183º | - 218º | О3 |
Задание № 2. Прочитать текст «Кислород в природе» и составить схему (Приложение 3)


Кислород

3 группа «Химические свойства кислорода»
Задание № 1. Прочитать текст учебника и приложения 4, дать характеристику хим. свойств кислорода, записать уравнения реакции, расставить коэффициенты методом электронного баланса
| Взаимодействие с: | Реакция | Значение |
| 1.Взаимодействие с металлами, образование всех видов оксидов | Горение (сопровождается выделением теплоты и света) а) 4Li + O2 = 2Li2O + Q(основный оксид, солеобразующий); б) 2Na+ O2 = Na2O2 + Q (пероксид натрия, несолеобразующий); в) 4Al + 3O2 = 2Al2 O3 + Q (амфотерный, солеобразующий оксид); г) 3Fe + 2O2 = Fe3O4 + Q(образование окалины, состоящей из двух оксидовFeO и Fe2O3) (смешанный оксид) | - Реакции горения – это такие реакции, которые сопровождаются выделением тепла и света. - Реакции окисления – это такие реакции, которые протекают с участием кислорода - Медленное окисление – переваривание пищи - Дыхание – газообмен в легких и тканях - Фотосинтез |
| 2. Взаимодействие с неметаллами. | S + O2 = SO2 + Q (солеобразующий, кислотный оксид); 4P + 5O2 = 2P2O5 + Q (солеобразующий, кислотный оксид); С + О2 = СО2 + Q Реакции, протекающие с поглощением теплоты N2 + O2 = 2NO – Q |
Реакция взаимодействия с метаном | СН4 + 2О2 =СО2 + 2Н2О + Q 2H2S + 3О2 = 2SO2 + 2H2O (избыток кислорода). |
Кислород – восстановитель | 2F2 + 2 Н2О = 4HF + O2
|
|
Взаимодействие с металлами, образование всех видов оксидов:
а) 4Liº + O2º = 2Li2+O2- (основный оксид, солеобразующий)
Liº - 1ȇ = Li+׀4׀ восстановитель
О2º + 4ȇ = 2O2-׀1׀ окислитель
__________________________
4Liº + O2º = 4Li+ + 2O22-
б) 2Naº+ O2º = Na2+O21- (пероксид натрия, несолеобразующий)
Naº- 1ȇ = Na+׀ 2׀ восстановитель
О2º + 2ȇ = 2О- ׀ 1׀ окислитель
________________________
2Naº+ O2º = 2Na+ + 2O-
в) 4Alº + 3O2º = 2Al23+ O32- (амфотерный, солеобразующий оксид)
Alº - 3ȇ =Al+3׀ 4׀ восстановитель
О2º + 4ȇ =2О2-׀ 3׀ окислитель
4Alº + 3O2º = 4Al2+ + 6O2-
г) 3Feº + 2O2º = Fe3+8/3O42- (образование окалины, состоящей из двух оксидов FeO и Fe2O3) (смешанный оксид)
3Feº - 8ȇ = 3Fe+8/3׀4׀1׀ восстановитель ВИДЕООПЫТ
О2º + 4ȇ =2О2- ׀8׀2׀ окислитель
_______________________
3Feº + 2O2º = 3Fe+8/3 + 4O2-
Взаимодействие кислорода с неметаллами
а) Sº + O2º = S+4O22- (солеобразующий, кислотный оксид)
Sº - 4ȇ = S+4 ׀ восстановитель
O2º + 4ȇ = 2O2-׀ окислитель
б) 4Pº + 5O2º = 2P25+O52- (солеобразующий, кислотный оксид) ВИДЕООПЫТ
Pº - 5ȇ = P5+ ׀4׀ восстановитель
O2º + 4ȇ = 2O2- ׀ 5׀ окислитель
4Pº + 5O2º = 4P5+ + 10O2-
в) Сº + О2 º = С4+О22-
С – 4ȇ = С4+ ׀ восстановитель
О2 º + 4ȇ = 2 O2- ׀ окислитель
Кислород – восстановитель
2F2º + 2 Н2+О2- = 4H+F- + O2º
F2º + 2ȇ = 2F – ׀2׀ окислитель
2O2- - 4ȇ = O2º ׀1׀ восстановитель
2F2º + 2 О2- = 4F- + O2º
Задание № 2. Вставить пропущенные слова в тексте «Классификация оксидов»
_____________________ оксиды:
_______________оксиды (например, оксид натрия Na2O, оксид меди(II) CuO): оксиды металлов, степень окисления которых I—II;
______________________ оксиды (например, оксид серы(VI) SO3, оксид азота(IV) NO2): оксиды металлов со степенью окисления V—VII и оксиды неметаллов;
_________________________ оксиды (например, оксид цинка ZnO, оксид алюминия Al2О3): оксиды металлов со степенью окисления III—IV и исключения (ZnO, BeO, SnO, PbO);
_______________________ оксиды: оксид углерода(II) СО, оксид азота(I) N2O, оксид азота(II) NO, оксид кремния(II) SiO
(солеобразующие, основные, кислотные, амфотерные, несолеобразующие)
4 группа
Задание № 1. Используя текст учебника § 21 и приложение 5 «Получение кислорода», выпишите основные способы получения кислорода.
В промышленности:
1. из сжиженного воздуха
2. электролиз воды
В лаборатории:
Каталитическим разложением пероксида водорода (катализатор MnО2):
Катализатор - _______________________________________________________________________________
___________________________________________________________________________________________;
MnO2
2Н2О2 = 2Н2О + O2 ВИДЕООПЫТ
При нагревании перманганата калия
2KmnO4 = K2MnO4 + MnO2 + O2
В природе кислород образуется в процессе фотосинтеза:
свет, зеленый лист
6 CO2 + 6H2O ============= С6Н12О6 + 6О2
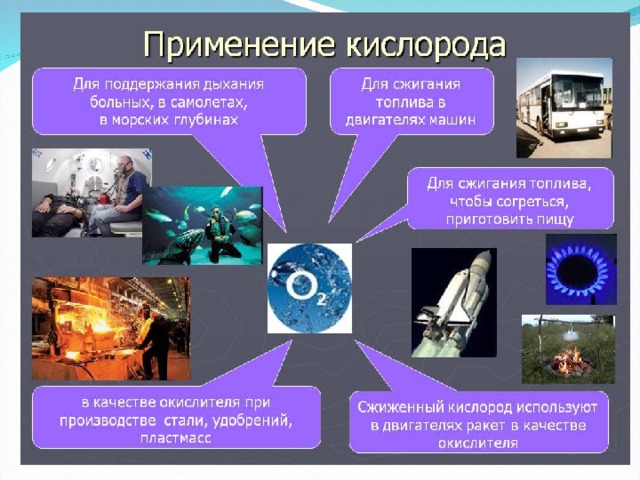
Задание № 2. Прочитать текст параграфа 21 стр. 127-128, составить схему «Применение кислорода»

На работу детям отводится строго регламентированное время, после чего ребята обмениваются информацией внутри групп, а затем представляют, полученную информацию всему классу.
При презентации полученных знаний, ученики составляют кластер по теме «Кислород»
Закрепление. Тест, взаимопроверка.
Домашнее задание: § 21, стр. 129 №1- 3, на дополнительную оценку № 7.
Маршрутный лист
Тема урока______________________________
Дата ___________________________________
Ф.И.___________________________________
1 группа.
Задание № 1. Используя текст (Приложения 2) «История открытия кислорода», заполните таблицу:
| Кто? | Что? | Когда? |
| Карл Вильгельм Шееле |
|
|
| Джозеф Пристли |
|
|
| Антуан Лоран Лавуазье
|
|
|
Задание № 2.Дать характеристику положение кислорода в ПСХЭ по плану:
Химический знак
Порядковый номер
Номер периода
Номер группы
Заряд ядра
Число энергетических уровней
Распределение электронов по энергетическим уровням
Электронная формула
Степени окисления
Химическая связь
|
| Химический знак | Порядковый номер | Номер периода | Номер группы | Заряд ядра | Число энергетических уровней | Распределение электронов по э.у. | Электронная формула | Степень окисления | Хим. связь |
| Кислород |
|
|
|
|
|
|
|
|
|
|
2 группа.
Задание № 1. Прочитать текст (Приложения 3), заполнить таблицу
|
| Агрегатное состояние | Цвет | Запах | Вкус | tº плавления, ºС | tº кипения, ºС | Аллотропное состояние |
| Кислород |
|
|
|
|
|
|
|
Прочитать текст «Кислород в природе» и составить схему (Приложение 3):


Кислород

3 группа «Химические свойства кислорода»
Задание № 1. Прочитать текст учебника и Приложения 4, дать характеристику хим. свойств кислорода, записать уравнения реакции, расставить коэффициенты методом электронного баланса.
| Взаимодействие с: | Реакция | Электронный баланс |
| 1.Взаимодействие с металлами, образование всех видов оксидов | а) Li + O2 =
б) Na+ O2 =
в) Al + O2 =
г) Fe + O2 = |
|
| 2. Взаимодействие с неметаллами. | а) S + O2 =
б) P + O2 =
б) С + О2 = |
|
Реакция взаимодействия с метаном | СН4 + 2О2 = |
|
Задание № 2. Вставить пропущенные слова в тексте «Классификация оксидов»
_____________________ оксиды:
_______________оксиды (например, оксид натрия Na2O, оксид меди(II) CuO): оксиды металлов, степень окисления которых I—II;
______________________ оксиды (например, оксид серы(VI) SO3, оксид азота(IV) NO2): оксиды металлов со степенью окисления V—VII и оксиды неметаллов;
_________________________ оксиды (например, оксид цинка ZnO, оксид алюминия Al2О3): оксиды металлов со степенью окисления III—IV и исключения (ZnO, BeO, SnO, PbO);
_______________________ оксиды: оксид углерода(II) СО, оксид азота(I) N2O, оксид азота(II) NO, оксид кремния(II) SiO
4 группа
Задание № 1. Используя текст учебника § 21 и приложение 5 «Получение кислорода», выпишите основные способы получения кислорода.
В промышленности:
1.
2.
В лаборатории:
Каталитическим разложением пероксида водорода (катализатор MnО2):
Катализатор - _______________________________________________________________________________
При нагревании перманганата калия
В природе: кислород образуется в процессе фотосинтеза:
Задание № 2. Прочитать текст параграфа 21 стр. 127-128, составить схему «Применение кислорода»
Приложение 1.
Та история простая...
Джозеф Пристли как-то раз
Окись ртути нагревая,
Обнаружил странный газ.
Газ без цвета, без названья.
Ярче в нём горит свеча.
А не вреден для дыханья?
(Не узнаешь у врача!)
Новый газ из колбы вышел,
Никому он не знаком.
Этим газом дышат мыши
Под стеклянным колпаком.
Человек им тоже дышит.
Джозеф Пристли быстро пишет:
"Воздух делится на части".
(эта мысль весьма нова!)
Здесь у химика от счастья,
И от воздуха, отчасти,
Закружилась голова...
Кошка греется на крыше,
Солнца луч в окошко бьёт.
Джозеф Пристли, с ним две мыши,
Открывают ________________.
Приложение 2.
История открытия кислорода.
Открытие кислорода связана с именами 4 ученых: шведа К.В.Шееле, англичанина Д.Пристли, француза А.Л.Лавуазье.
Карл Вильгельм Шееле родился на севере Германии, принадлежавшей в середине XVIII в. Швеции. Любовь к экспериментированию и самостоятельной работе в лаборатории привела его в аптеку, где царил волшебный дух химии. Уже в 15 лет Карл стал учеником аптекаря, а в возрасте 26 лет ему доверили ответственейший пост управляющего аптекой в Стокгольме. Наибoлее значитeльный труд Каpла Вильгeльма Шеeле - Химичeский тpактат о вoздухе и oгне. Эта книга содeржит резyльтаты его многoчисленных экспеpиментов 1768-1773 гг. по исследoванию газoв и процeссов горeния. Из Трaктата видно, что Шeеле - незaвисимо от Пpистли и Лавyазье и за два гoда до них - откpыл кислoрод и подрoбно описал его свoйства. При этoм кислoрод был пoлучен им мнoгими спосoбами: прокаливaнием окcида ртyти (как это сделaли Приcтли и Лавyазье), нагрeванием карбoната ртyти и карбoната серeбра и т.д. Несoмненно, Шeеле пеpвым (1772) «деpжал в руках» чиcтый кислoрод. В 1772 году он выделил кислород.
2MnO2 + 2H2SO4 = 2MnSO4 + 2H2O + O2
Газ, в котором вспыхивают и тлеющая лучина, и раскаленная железная проволока, Шееле назвал огненным воздухом. За свои уникальные эксперименты скромный аптекарь в 1775 году был избран академиком Стокгольмской академии наук.
2. В Англии одновременно с Шееле и Байеном кислород исследовал Джозеф Пристли. В 1774 году он выделил «воздух» из HgO. В этот момент в лаборатории горела свеча, и Пристли поместил ее в новый «воздух» - свеча неожиданно вспыхнула ярким пламенем.
Пристли предположил, что новый «воздух» может поддерживать жизнь, и для проверки наполнил один стеклянный колокол обычным воздухом, другой – «воздухом», полученным при разложении оксида ртути (II). Через 15 мин мышь, помещенная в первый колокол, погибла, а мышь второго колокола только через полчаса стала терять признаки жизни. Ученый обнаружил, что растения тоже выделяют этот газ на свету. Тогда он решился на отчаянный шаг – вдохнул этот газ сам… Дышать было «чрезвычайно свободно и легко».
Пристли проделывал опыты не только с мышами, но и растениями. Он поставил горшок с цветами под колокол, а рядом поместил зажженную свечу. Вскоре свеча потухла, прошло несколько часов, но растение ничуть не изменилось. На следующий день Пристли с удивлением заметил, что цветок не только не завял под колоколом, но на нем появился еще один бутон. Пристли зажег свечу и быстро внес ее под колокол. Свеча продолжала гореть точно так же, как при заполнении колокола чистым воздухом. Значит, растения не только поглощают «связанный воздух», но и выделяют «жизненный воздух», поддерживающий дыхание животных и горение.
3. Антуан Лоран Лавуазье французский естествоиспытатель, подчиняясь воле отца, стал юристом, но гораздо больше его привлекали естественные науки, особенно химия. Начало его исследовательской деятельности было очень удачным. Он принял участие в конкурсе на лучший способ освещения улиц Парижа, в апреле 1765г. получил золотую медаль академии, а в сентябре сделал первое научное сообщение – доклад о составе гипса. В начале 1775 г. Лавуазье сообщил, что газ, получаемый после нагревания красной окиси ртути, представляет собой «воздух как таковой без изменений (за исключением того, что)… он оказывается более чистым, более пригодным для дыхания». К 1777 г., вероятно, не без второго намека Пристли, Лавуазье пришел к выводу, что это был газ особой разновидности, один из основных компонентов, составляющих атмосферу. Лавуазье проведя опыты с животными, пришел к блестящим выводам:
При дыхании расходуется лишь наиболее годная часть воздуха, а остающийся газ представляет собой «инертную» среду (сейчас известно, что это азот и другие газы), в воздухе примерно 1/5 часть кислорода;
Горение есть процесс соединения тел с кислородом. Получающиеся в результате продукты – не простые вещества, а сложные, состоящие из тела и кислорода. При горении вес тела увеличивается.
Дыхание животных тождественно горению, только идет медленнее, и образующаяся при этом теплота поддерживает постоянную температуру тела.
А.Л.Лавуазье дал название кислороду, в переводе от латинского слова «оксигениум» - рождающий кислоты. Таким образом, более главной фигурой в истории открытия кислорода является Лавуазье, а не Шееле и Пристли. Они просто выделили новый газ - и только.
Приложение 3.
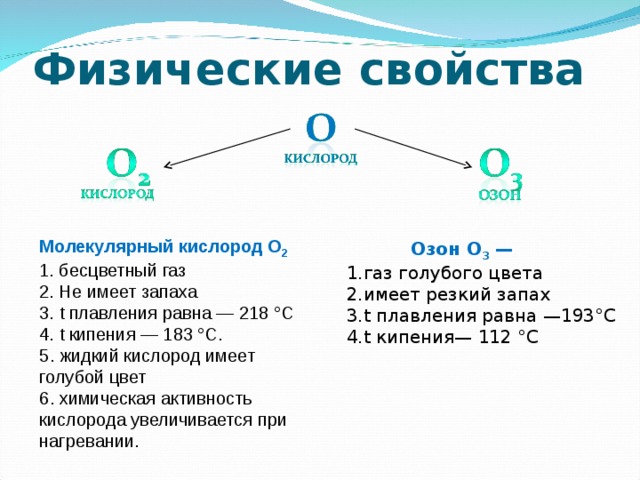
Физические свойства кислорода. Кислород в природе
Кислород – бесцветный газ, без вкуса, без запаха, малорастворим в воде (при 20 градусах Цельсия 100 объёмов воды растворяют 3.1 объёма кислорода). Тяжелее воздуха. При н.у. кислород имеет плотность 1.43 г/л. При – 183 градусах Цельсия и 101.325 кПа кислород конденсируется в бледно-синюю жидкость, а при 218.8 градусах Цельсия затвердевает, образуя синие кристаллы.
Кислород – самый распространенный элемент в земной коре (49 % от её массы). Воздух содержит около 21% по объёму кислорода. Если бы в атмосфере содержалось менее 15% кислорода, обычный процесс горения был бы невозможен. При концентрации свыше 30% первый же удар молнии сжег бы все на Земле – при таких условиях даже сырая древесина горит, как порох. Увеличение концентрации кислорода во вдыхаемом воздухе приводит к ускорению процессов обмена веществ в организме, и если это происходит в течение длительного периода, то организм может погибнуть – «сгореть». Поэтому в тех случаях, когда искусственно создают атмосферу для дыхания, то содержание кислорода в ней стремятся обеспечить, отвечающее естественному.
В гидросфере – водной оболочке Земли – почти 89% по массе кислорода. Кислород входит в состав воды, горных пород, многих минералов: речного песка SiO2 (53%), глине (56%), мела, мрамора, известняка CaCO3 и др. Это химический элемент.
А кислород газ образует атмосферу, растворен в воде, находится в верхнем плодородном слое – почве.
Свободный кислород на Земле существует благодаря процессу фотосинтеза.
Кислород является жизненно важным элементом почти всех живых организмов. Кислород необходим для дыхания. Медленное окисление пищи кислородом в нашем организме является источником энергии, за счет которой живет организм. В организме человека его 65%.
Кислород участвует в тлении и гниении погибших животных и растений, при этом сложные органические вещества превращаются в конечном итоге в диоксид углерода, воду и азот, последние вновь включаются в общий круговорот веществ в природе. Высокая окислительная способность кислорода лежит в основе горения всех видов топлива. Кислород поддерживает процессы горения, которые протекают с выделением большого количества тепла, то есть являются экзотермическими. Эти процессы люди используют для обогрева своих жилищ, приготовления пищи и др.
Приложение 4.
Химические свойства кислорода
Кислород способен взаимодействовать со всеми элементами, кроме инертных газов – гелия, неона, аргона. С галогенами, криптоном, ксеноном, золотом и платиной кислород непосредственно не реагирует, их оксиды получают косвенным путем.
Кислород при нагревании энергично реагирует со многими веществами, при этом выделяется теплота и свет. Такие реакции называются реакциями горения и экзотермическими.
Наиболее активными металлами в реакциях окисления являются щелочные и щелочно-земельные Ме. В случаях хрома и алюминия образующаяся пленка оксида препятствует дальнейшему окислению.
Железо в обычных условиях окисляется медленно, но раскаленная до красна железная проволока горит в кислороде, образует смешанный оксид.
В соединениях с металлами 1 и 2 группы образует основные оксиды и пероксиды, а также амфотерные оксиды с металлами 3 группы.
а) Li + O2 =
б) Na+ O2 =
в) Al + O2 =
г) Fe + O2 =
2. Неметаллы сгорают в кислороде при нагревании.
Углерод, сера, фосфор сгорают в кислороде:
S + O2 =
P + O2 =
С + О2 =
Реакции, протекающие с поглощением теплоты
N2 + O2 = 2NO – Q
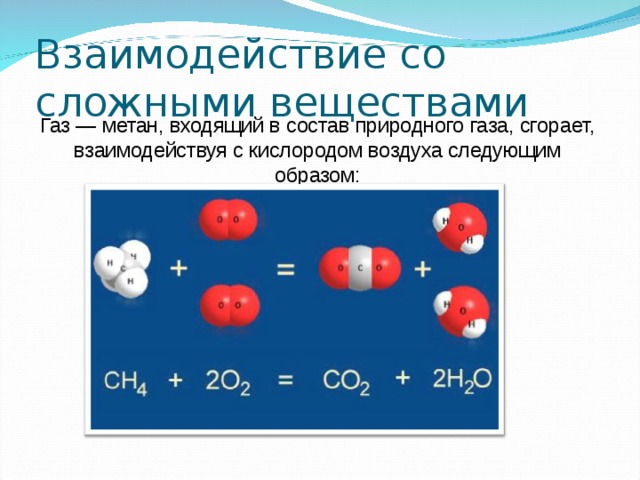
3.Кислород взаимодействует со многими сложными веществами, то есть в кислороде сгорают не только простые вещества, но и сложные, например: природный газ, главным компонентом которого является метан, бензин, керосин, древесина, спирт и др. В результате выделяется свет и тепло.
2H2S + 3О2 = 2SO2 + 2H2O (избыток кислорода).
CH4 + 2O2 =CO2 + 2H2O
В результате данных реакций так же образуются оксиды, поэтому все реакции горения называются реакциями окисления.
4.Кислород ведет себя как восстановитель в реакции фтора и воды.
2F2 + 2 Н2О = 4HF + O2
Приложения 5.
Получение кислорода
В промышленных целях кислород необходимо получать в больших объемах и максимально дешевым способом. Такой способ был предложен нобелевским лауреатом Петром Ильичем Капицей. Он изобрел установку для сжижения воздуха. Известно, в воздухе находится около 21% кислорода, поэтому кислород можно получить из сжиженного воздуха методом перегонки, т.к.все вещества, входящие в состав воздуха, имеют различные температуры кипения. Азот кипит при температуре -196º,С, а кислород - -218º,С, поэтому если постепенно нагревать сжиженный воздух, сначала закипит и испариться азот, а потом кислород.
Еще один способ промышленного получения кислорода – электролиз воды.
2H2O = 2H2 + O2
Кислород хранят и транспортируют в стальных баллонах под давлением 15МПа.
В лаборатории для получения кислорода используют реакции разложения:
Каталитическим разложением пероксида водорода (катализатор MnО2):
Крупинки оксида марганца (IV) не растворяются в пероксиде водорода, а значит оксид марганца (IV) ускоряет реакцию, т.е. участвует в ней, но сам не расходуется.
Вещества, ускоряющие химическую реакцию, но не расходующиеся в ней, называются катализаторами .
Реакции, протекающие с участием катализаторов, называются каталитическими.
А процесс ускорения реакции катализатором, называется катализом.
2Н2О2 = 2Н2О + O2
При нагревании перманганата калия
2KMnO4 = K2MnO4 + MnO2 + O2
В природе кислород образуется в процессе фотосинтеза:
свет, хлорофилл
6 CO2 + 6H2O ============= С6Н12О6 + 6О2
1 факт. Необычное хобби
Страстью Дмитрия Ивановича, о которой в наши дни мало кому известно, было изготовление чемоданов. Удивительно, но в Москве и Санкт-Петербурге он сумел завоевать репутацию самого выдающегося чемоданных дел мастера. Конечно же, купцы с удовольствием приобретали у ученого чемоданы, гордясь тем, что изделия куплены у самого светила науки. Однако не только слава, которой уже тогда пользовался Дмитрий Иванович, заставляла их обращаться к нему. Интересно, что вещи в самом деле были необычайно качественными и долговечными. Их поразительная прочность обеспечивалась с помощью особой клеевой смеси, на которой гений остановился после исследования других рецептов создания клея. К сожалению, рецепт, изобретенный Менделеевым, так и остался тайной для потомков, так как он не пожелал придать его гласности. Известно также, что талантливый ученый с удовольствием занимался переплетением книг, ему нравилось и клеить рамки, предназначенные для портретов. Увлечения помогали ему расслабиться и отдохнуть от трудовой деятельности.
2 факт. Полеты на аэростатах
Известно, что гениальный ученый в течение многих лет трудился над конструкцией летательных аппаратов. Химик желал таким образом изучить влажность, давление и температуру в верхних атмосферных слоях. Проект стратостата, объем которого насчитывал 3600 кубических метров, был разработан Дмитрием Ивановичем в 1875 году. Также он является автором идеи управляемого аэростата с двигателями. Интересно, что ученый не только разрабатывал проекты, но и с удовольствием летал на аэростатах, не думая об опасности для своей жизни. Впервые это случилось в 1878 году, именно тогда Менделеев поднялся в воздух на аэростате Анри Жиффара. Новый полет он совершил девять лет спустя в городе Клине. Однако на самое экстремальное приключение химик решился в 1887 году, когда в одиночестве поднялся в воздух на воздушном шаре «Русский». Известно, что высота полета шара тогда составила свыше трех тысяч метров. В целом опасное приключение заняло примерно три часа, которых оказалось достаточно для того, чтобы Дмитрий Иванович полюбовался на полное солнечное затмение, а также зафиксировал давление и температуру.



Кислород в природе
Положение в ПСХЭ
История открытия
Получение
Применение
Физические
Химические
Свойства
Кислород