Просмотр содержимого документа
«Урок по теме "Альдегиды"»

Химия – 10 класс
Альдегиды
Голобокова Татьяна Николаевна
МОУ «СОШ с. Михайловка Саратовского района Саратовской области»

Цель урока:
- Изучить гомологический ряд, изомерию, физические, химические свойства и применение альдегидов.
- Продолжить совершенствовать умение составлять структурные формулы гомологов и изомеров.
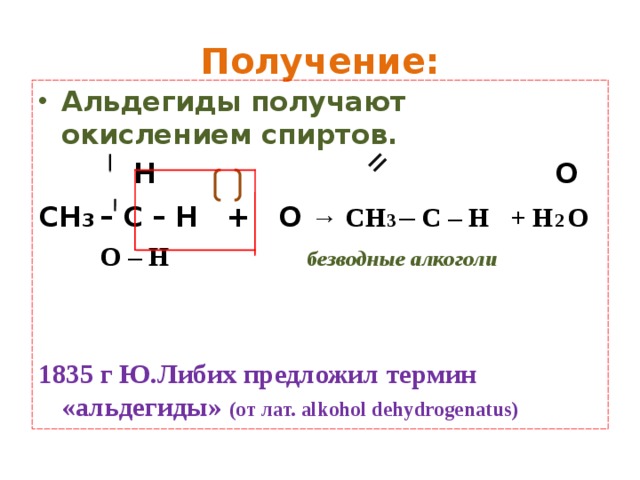
Получение:
- Альдегиды получают окислением спиртов.
Н О
СН 3 – С – Н + О → СН 3 – С – Н + Н 2 О
О – Н безводные алкоголи
1835 г Ю.Либих предложил термин «альдегиды» (от лат. alkohol dehydrogenatus)

Проанализируйте структурные формулы веществ и укажите особенности строения их молекул.
О О
Н – С – Н СН 3 – С – Н
О
СН 3 – СН 2 – СН 2 – СН 2 – С - Н
- Карбонильная группа С = О , связанная с атомом водорода и углеводородным радикалом

Альдегиды – это органические соединения, молекулы которых содержат карбонильную группу С = О , связанную с атомом водорода и углеводородным радикалом.
С n H 2n -1 - C- H
где n = 1,2,3, ….

Кетоны
О
Ацетон
Органические вещества, в молекулах которых карбонильная функциональная группа связана с двумя глеводородными радикалами, называются кетонами

Номенклатура
- Суффикс – аль
- Нумерация атомов углерода в главной цепи начинается с атома углерода карбонильной группы
5 4 3 2 1 О
СН 3 – СН 2 – СН – СН 2 – С- Н
СН 3
2 - метилпентаналь
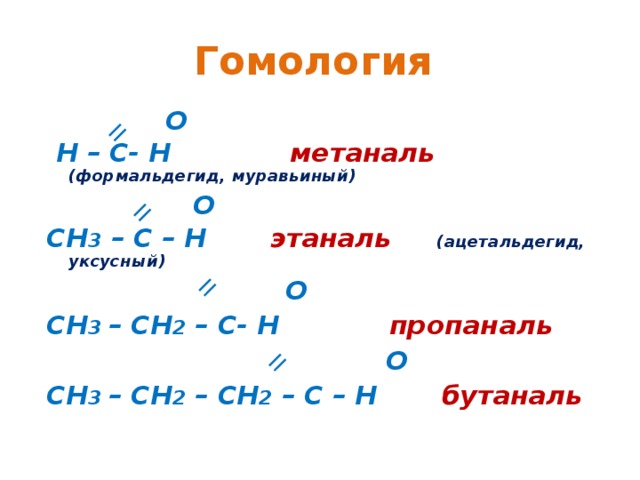
Гомология
О
Н – С- Н метаналь (формальдегид, муравьиный)
О
СН 3 – С – Н этаналь (ацетальдегид, уксусный)
О
СН 3 – СН 2 – С- Н пропаналь
О
СН 3 – СН 2 – СН 2 – С – Н бутаналь
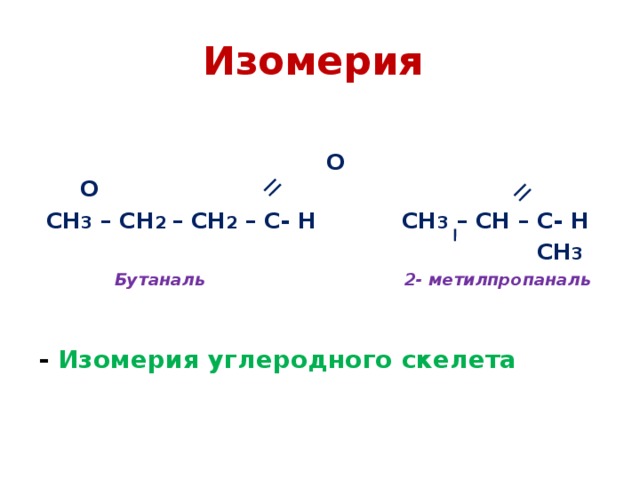
Изомерия
О О
СН 3 – СН 2 – СН 2 – С- Н СН 3 – СН – С- Н
СН 3
Бутаналь 2- метилпропаналь
- Изомерия углеродного скелета

Физические свойства
- Формальдегид – газ без цвета, с резким запахом, t кип = 21 С, хорошо растворим в воде, ядовит . 40 % раствор формальдегида в воде называется формалином
- Уксусный альдегид – летучая жидкость с резким запахом, t кип = 21 С, хорошо растворим в воде, ядовит.

Химические свойства
- А) Реакция «серебряного зеркала»

Химические свойства
- Б) со свежеприготовленным гидроксидои меди ( II )

Химические свойства
- 2) Реакция восстановления

Химические свойства
2. Реакция восстановления:
О
С n H 2n– 1 C -H + Н 2 → С n H 2n– 1 C Н 2 - О H
3. Реакция поликонденсации фенола с формальдегидом.
альдегид спирт
Показывает генетическую взаимосвязь органических соединений
Получение формальдегидных смол

Химические свойства
Характеристика реакции, уравнение реакции
Применение реакции, её продуктов
1. Реакции окисления:
Б) реакция «серебряного зеркала»
Качественная реакция на альдегиды
А) реакция со свежеприготовленным гидроксидом меди (II) при нагревании
Примечание
О О С n H 2n– 1 C -H + Ag 2 O →C n H 2n -1 C- OH +
Качественная реакция на альдегиды
Признак реакции – образование осадка кирпично – красного цвета
O O
С n H 2n– 1 C -H + Cu(OH) 2 → C n H 2n -1 C- OH +
На стенках пробирки появляется «серебряное зеркало»
альдегид карбоновая кислота
Альдегид карбоновая кислота
+ 2 Ag↓
+ 2 CuOH↓.
2CuOH → Cu 2 O + H 2 O

Химические свойства
- 3) Реакция поликонденсации

Применение
- Дезенфицирующее средство
- Формацевтическая промышленность
- Пластмассы
А) Уксусной кислоты
Б) Пластмасс
В) Ацетатного волокна


































