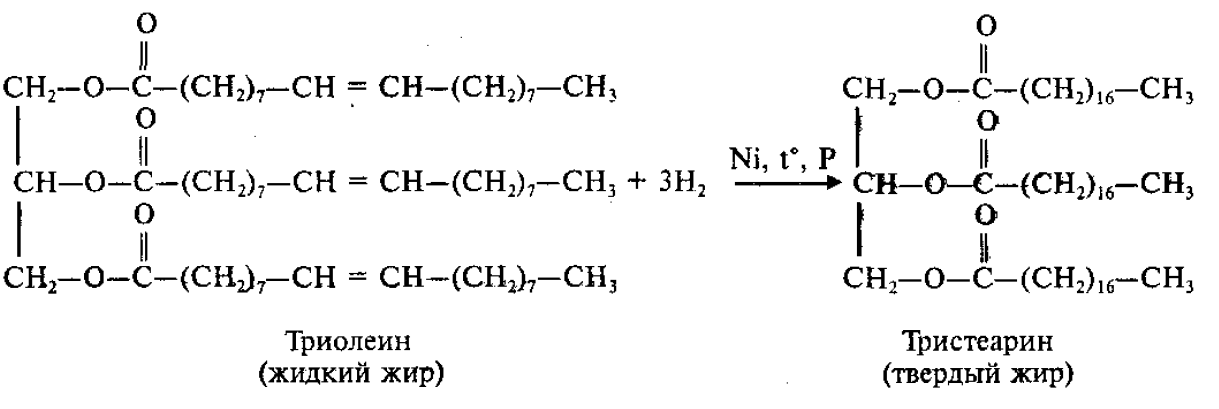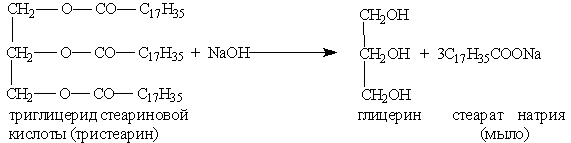Учитель химии Магкеева А.К.
План урока по химии.
Тема урока: Сложные эфиры и жиры.
Цели:
обучающие: изучить строение и свойства сложных эфиров как производных спиртов и карбоновых кислот; выяснить химическую природу жиров, познакомиться с их применением, получением и биологической ролью;
развивающие: активизировать познавательную деятельность учащихся, развитие логического и аналитического мышления;
воспитательные: создать положительную мотивацию изучения химии, а также через достижение успеха на различных этапах учебной деятельности.
Задачи:
обучающие:
дать представление об эфирах и их образовании, рассмотреть распространение эфиров в природе, их применение;
развивающие:
формировать умение сравнивать, устанавливать причинно – следственные связи, делать аргументированные выводы, развитие умений работать вместе, развитие коммуникативных умений;
воспитательные:
формирование культуры межличностного общения на примере умения слушать друг друга, анализировать ответы, познавательного интереса к предмету.
Тип урока: изучение нового материала.
Оборудование, средства обучения: компьютер и проектор, экран, цифровые образовательные ресурсы, учебник.
Средства наглядности: таблицы, презентация.
Формы организации познавательной деятельности обучающихся: коллективная, индивидуальная, фронтальная, парная.
Методы обучения: проблемный, эвристический, экспериментальный.
Изучение нового материала.
Что такое сложные эфиры?
Сложные эфиры — это вещества, которые образуются в результате взаимодействия органических или кислородсодержащих неорганических кислот со спиртами (реакции этерификации).
Общая формула сложных эфиров одноатомных спиртов и одноосновных карбоновых кислот:
R-COO-R, где R и R1 углеводородные радикалы, исключение – эфиры муравьиной кислоты
H–COO–R1.
Сложные эфиры – жидкости, обладающие приятными фруктовыми запахами. В воде они растворяются очень мало, но хорошо растворимы в спиртах. Сложные эфиры очень распространены в природеОни даже могут находиться в коре некоторых деревьев.
Эфиры высших одноосновных кислот и высших одноатомных спиртов – основа природных восков. Воски не растворяются в воде. Их можно формовать в нагретом состоянии. Примерами животных восков могут служить пчелиный воск, а также ворвань (спермацет), содержащийся в черепной коробке кашалота (кашалотовый воск). Пчелиный воск содержит сложный эфир пальмитиновой кислоты и мирицилового спирта (мирицилпальмитат): CH3(CH2)14–CO–O–(CH2)29CH3.
Как могут быть получены сложные эфиры?
Cложные эфиры могут быть получены при взаимодействии карбоновых кислот со спиртами (реакция этерификации). Катализаторами являются минеральные кислоты.
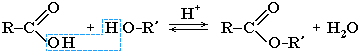
Обратный процесс – расщепление сложного эфира при действии воды с образованием карбоновой кислоты и спирта – называют гидролизом сложного эфира.
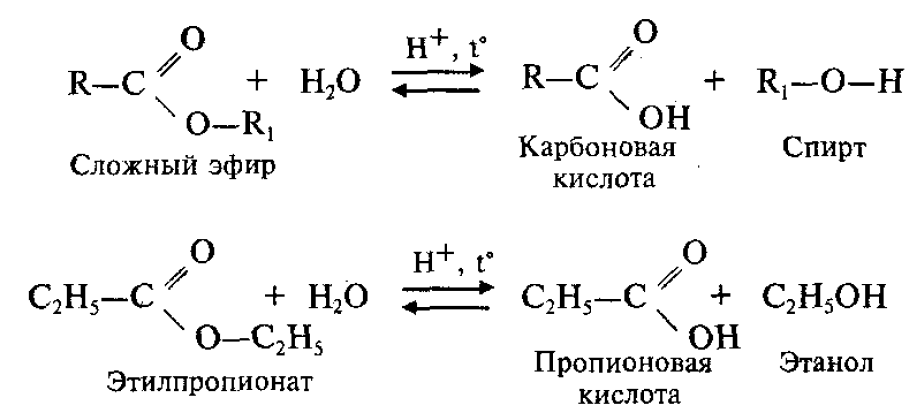
Гидролиз в присутствии щелочи протекает необратимо (т.к. образующийся отрицательно заряженный карбоксилат - анион RCOO– не вступает в реакцию с нуклеофильным реагентом – спиртом).
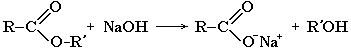
Эта реакция называется омылением сложного эфира.
Изомерия и номенклатура сложных эфиров
| Структурная изомерия | Межклассовая изомерия |
| Цепи | Положения группы |
| CH3 – COO – CH2 – CH2 – CH3 Пропилацетат Пропилэтаноат Пропиловый эфир уксусной кислоты
CH3 – COO – CH – (CH3)2 Изопропилацетат Изопропилэтаноат Изопропиловый эфир уксусной кислоты | C2H5 – COO – C2H5 Этилпропионат Этилпропаноат Этиловый эфир пропионовой кислоты
CH3 – CH2 – CH2 – COO – CH3 Метилбутират Метилбутаноат Метиловый эфир масляной кислоты | CH3 – CH2 – CH2 – CH2 – COOH н-Пентановая кислота и ее изомеры
(Сложные эфиры изомерны карбоновым кислотам) |
Применение сложных эфиров очень разнообразно.
Их применяют в промышленности в качестве растворителей и промежуточных продуктов при синтезе различных органических соединений. Сложные эфиры с приятным запахом используют в парфюмерии и пищевой промышленности. Сложные эфиры часто служат исходными веществами в производстве многих фармацевтических препаратов.
ЖИРЫ
Важнейшими представителями сложных эфиров являются жиры.
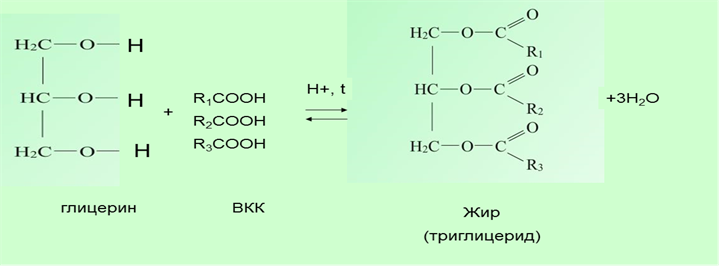
В 1854 французский химик Марселен Бертло (1827–1907) провел реакцию этерификации, то есть образования сложного эфира между глицерином и жирными кислотами, и таким образом впервые синтезировал жир.
Впервые химический состав жиров определил в начале прошлого века французский химик Мишель Эжен Шеврёль, основоположник химии жиров. Действуя водными растворами кислот и щелочей на различные жиры, он получил в результате реакции гидролиза (омыления) открытый еще Шееле глицерин
и неизвестные ранее химические соединения – различные жирные кислоты, многим из которых он и дал названия. А «сладкое масло» Шееле Шеврёль назвал глицерином.
На основании этих экспериментов сделали вывод, что жиры (триглицериды) – это сложные эфиры трехатомного спирта глицерина и высших карбоновых кислот.
Общая формула: 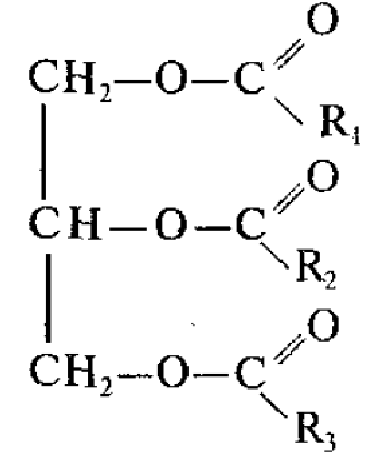 , где R1, R2, R3 – УВ радикалы (могут быть одинаковые или разные), содержащие от 3 до 25 атомов углерода.
, где R1, R2, R3 – УВ радикалы (могут быть одинаковые или разные), содержащие от 3 до 25 атомов углерода.
Жиры, как это не удивительно, тоже относятся к сложным эфирам. В их образовании участвуют стеариновая кислота С17Н35СООН (или близкие к ней по составу и строению другие жирные кислоты) и трехатомный спирт глицерин С3Н5(ОН)3. Вот как выглядит схема молекулы такого эфира:
Н2С- О –С(О)С17Н35
|
НС- О –С(О)С17Н35
|
Н2С- О –С(О)С17Н35 тристеарин, эфир глицерина и стеариновой кислоты, тристеарат глицерина.
Жиры имеют сложное строение – это подтверждает модель молекулы тристеарата.
Физические свойства
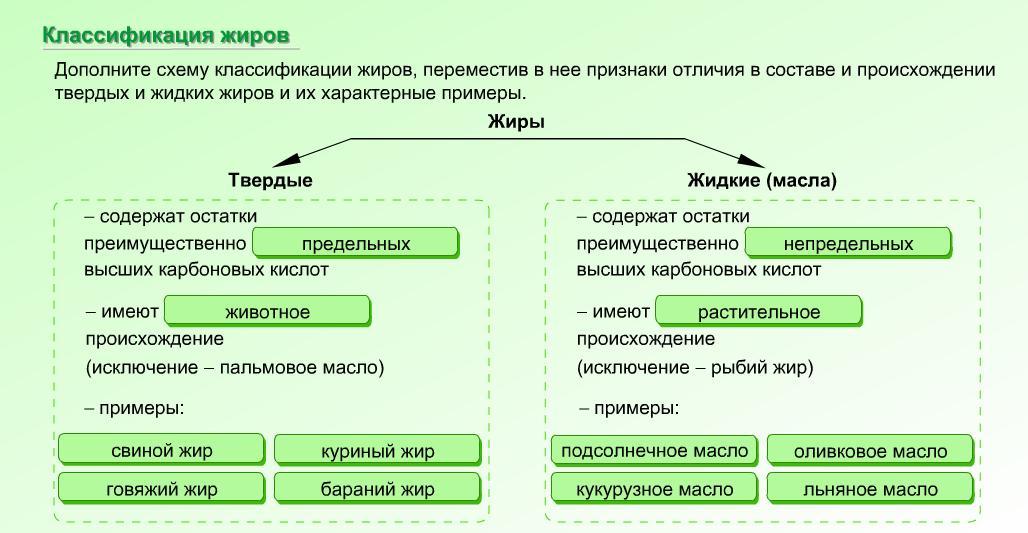
Рассмотрим классификацию жиров:
Классификация жиров
Наиболее важные ВКК, входящие в состав жиров:
| Насыщенные кислоты | Ненасыщенные кислоты |
| Эмпирическая формула ВКК | Название кислоты (кислотного остатка) | Эмпирическая формула ВКК | Название кислоты (кислотного остатка) |
| С15Н31СООН | Пальмитиновая (пальмитат) | С17Н33СООН | Олеиновая (олеат) |
| С17Н35СООН | Стеариновая (стеарат) | С17Н31СООН | Линолевая (линолеат) |
|
|
| С17Н29СООН | Линоленовая |
Получение жиров
Химические свойства жиров
Как распознать входят ли в состав жира непредельные кислоты? Правильно, провести реакцию с бромной водой (видеоролик) или с раствором перманганата калия.
Присоединение галогенов (взаимодействие с бромной водой):
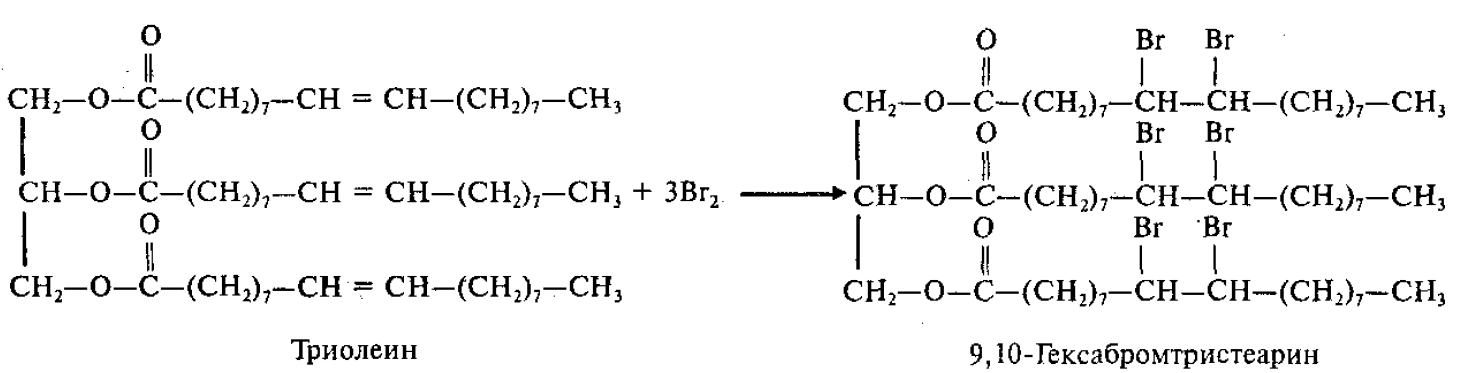
Бромная вода в результате этой реакции обесцвечивается.
Гидрирование:
Для жиров, содержащих остатки ненасыщенных карбоновых кислот, характерны все реакции непредельных соединений. Они обесцвечивают бромную воду, вступают в другие реакции присоединения. Наиболее важная в практическом плане реакция – гидрирование жиров. Гидрированием жидких жиров получают твердые сложные эфиры. Именно эта реакция лежит в основе получения маргарина – твердого жира из растительных масел.
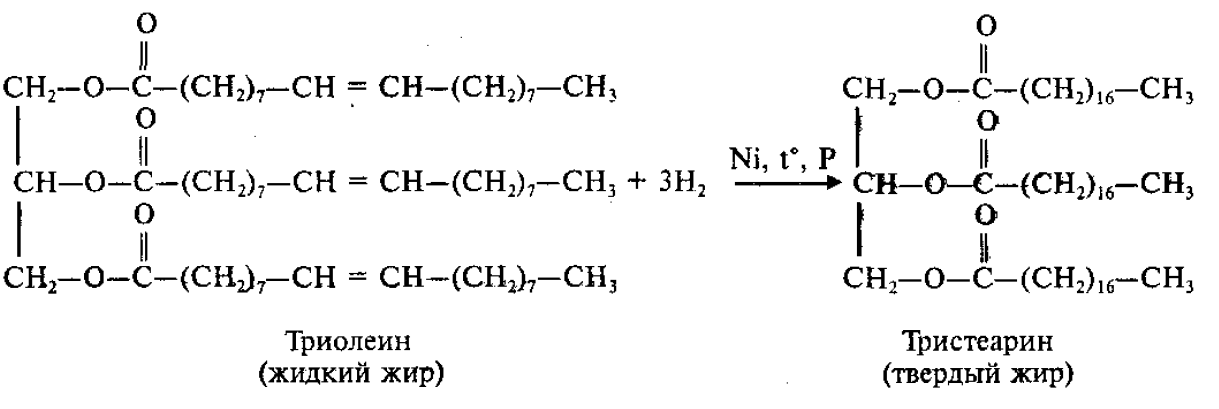
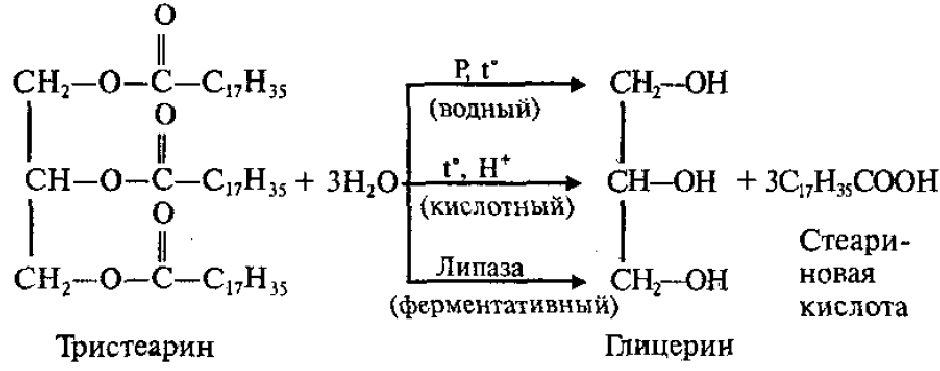
Гидролиз
В зависимости от условий гидролиз бывает:
Водный (без катализатора, при высоких температуре и давлении),
Кислотный (в присутствии кислоты в качестве катализатора),
Ферментативный (происходит в живых организмах):
Щелочной (под действием щелочей):
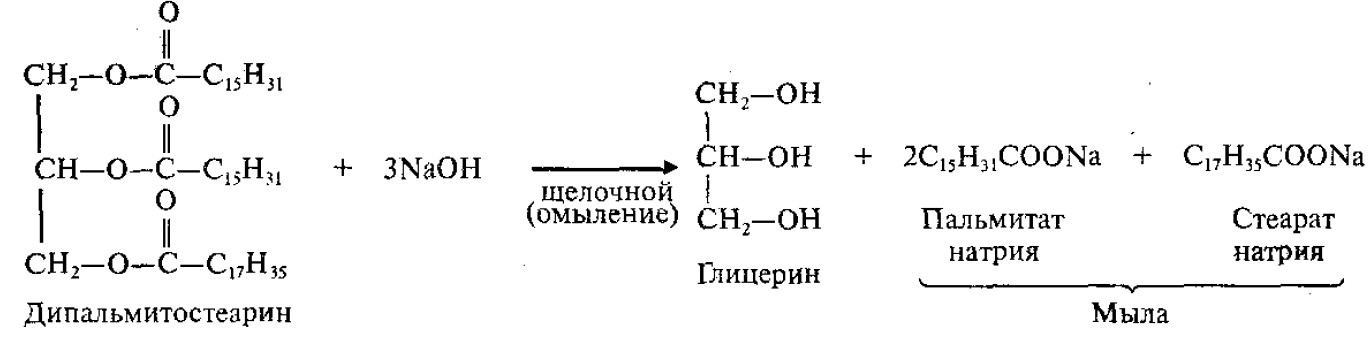
Мыла – натриевые или калиевые соли ВКК.
Натриевые соли являются основным компонентом твердого мыла, калиевые соли – жидкого мыла.
Исходным сырьем для получения мыла служат растительные масла (подсолнечное, хлопковое и др.), животные жиры, а также гидроксид натрия или кальцинированная сода. Растительные масла предварительно подвергаются гидрогенизации, т. е. их превращают в твердые жиры. Применяются также заменители жиров — синтетические карбоновые жирные кислоты с большей молекулярной массой.
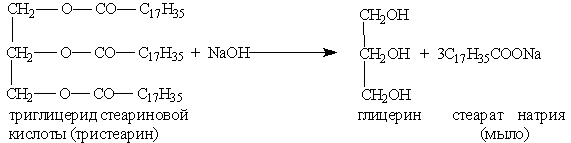
Почему мыло теряет свою моющую способность в жесткой воде? (видеоролик)
Биологическая роль жиров
Жиры нам необходимы, точно так же, как белки и углеводы: они источник энергии и носители незаменимых веществ. И первые среди незаменимых - жирные кислоты с несколькими двойными связями в молекуле. Если организм лишить их, замедлится развитие организма в целом, будет угнетена репродуктивная функция, начнутся проблемы со здоровьем. У детей жиры и вовсе служат главным строительным материалом для развивающегося мозга. Наконец, целый ряд необходимых витаминов растворяется только в жирах и без них не усваивается организмом. Жиры выполняют различные функции:
строительная (входят в состав клеточных мембран);
энергетическая (1 г жира при окислении дает 9 ккал энергии);
защитная (теплорегуляционная, механическая защита органов);
запасная (запас энергии и воды);
регулирующая (обмен веществ в организме).
Применение жиров .
Многие жиры при стоянии на воздухе прогоркают – приобретают неприятные запах и вкус, так как при этом образуются кетоны и альдегиды. Такой процесс стимулируется железом, поэтому нельзя оставлять масло в сковороде до следующего дня. Для предотвращения его применяют антиоксиданты.
Прокисание жира связано с гидролизом его. Кислый вкус обусловлен появлением карбоновых кислот.
Весьма важными являются реакции полимеризации масел. По этому признаку растительные масла делят на высыхающие, полувысыхающие и невысыхающие. Высыхающие в тонком слое образуют блестящие тонкие пленки. На этом основано использование этих масел для приготовления лаков и красок (льняное). К полувысыхающим относятся, например, подсолнечное, а к невысыхающим относится оливковое, содержащее мало непредельных кислот.
Рефлексия
Достигли ли мы поставленных целей?
Все ли было понятно на уроке?
Что заинтересовало вас сегодня на уроке более всего?
Завершение урока
Выставляются оценки с учетом работы учащихся в течение всего урока, кратко комментируются.
Домашнее задание: п.22-24







 , где R1, R2, R3 – УВ радикалы (могут быть одинаковые или разные), содержащие от 3 до 25 атомов углерода.
, где R1, R2, R3 – УВ радикалы (могут быть одинаковые или разные), содержащие от 3 до 25 атомов углерода.