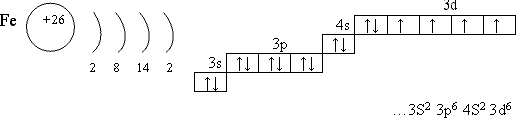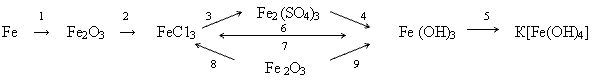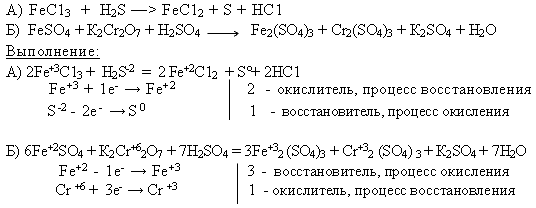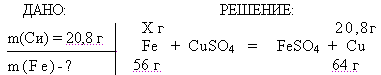| Задачи урока: Образовательные: обеспечить в ходе урока повторение, закрепление и контроль знаний о железе и его соединениях. Сформировать (продолжить формирование, закрепить, проверить усвоение) следующих специальных понятий по данному предмету: Умение характеризовать строение атома; Записывать уравнения, характеризующие химические свойства железа и его соединений; Составлять электронный баланс, указывая окислитель и восстановитель; Записывать уравнения, соответствующие цепочке превращений; Сформировать (продолжить формирование, закрепить, проверить усвоение) следующие общеучебные умения и навыки: Умение устно и письменно отвечать на известные вопросы Умение монологически высказываться Умение действовать по инструкции, алгоритму
Развивающие развивать у школьников следующие интеллектуальные умения и приемы умственной деятельности (анализ, синтез, сравнение); развивать самостоятельность и волю школьников, используя для этого самостоятельные тестовые задания по изучаемой теме; развивать познавательный интерес школьников, используя для этого данные о биологическом значении соединений железа; развивать познавательный интерес школьников, используя демонстрационный эксперимент.
Воспитательные содействовать в ходе урока формированию идеи материальности и познаваемости мира; Задачи для учащихся: Проверить знание основных теоретических вопросов темы “Железо и его соединения”; Развивать умения составлять электронный баланс и уравнения, соответствующие цепочке превращений; Закрепить теоретические знания практическим путем. Провести контроль усвоения основных теоретических понятий. Оборудование и реактивы: кодоскоп; для демонстрационных опытов: растворы FеSO4, FеС12, FеС13, NаОН, НСl, К3[Fе (СN)6], К4[Fе(СN)6], КСNS, пробирки. Подготовка к семинару: учащимся заранее выдаются вопросы к семинару (см. приложение).
ХОД УРОКА 1. Организационный момент. 2. Актуализация опорных зун. Ferrum от латинского fers - быть твердым, что в свою очередь происходит от санскритского «меч». Работа по вопросам семинара. 1 вопрос: Напишите электронно-графическую формулу атома железа. Укажите валентные электроны. Какие степени окисления проявляет железо в соединениях? Какие оксиды и гидроксиды соответствуют этим степеням окисления? Примерный ответ: 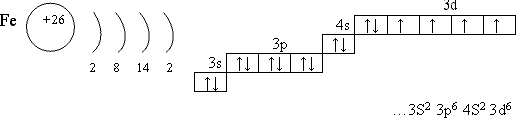 Валентные электроны 4S и 3d ( внешнего и предвнешнего уровня) Степени окисления +2 и +3 +2: FеО, Fе (ОН)2 ; +3: Fе2О3, Fе (ОН)з 2 вопрос: В каком состоянии железо встречается в природе? Назовите важнейшие природные соединения железа. Примерный ответ: В земной коре железа 5,1% (это 2 место после Аl) . В основном в виде соединений: оксидов, сульфидов, карбонатов. Магнитный железняк Fе3О4 (Урал) Гематит Fе2О3 (Кривой Рог) Лимонит Fе2О3 • n Н2О (Керчь) Пирит FеS2 (Урал) Сидерит FеСОз Гидрокарбонат железа (II) Fе (НСОз)2 (Железноводск) В свободном виде встречается только в метеоритах. 3 вопрос: Каковы физические свойства железа? Ответ: серебристо-серый металл, ковкий, пластичный, плотность 7,87г/см3; tпл.=1539°С; tкип.=2740°С; хорошо проводит тепло и электричество, обладает магнитными свойствами. 4 вопрос: С какими простыми веществами реагирует железо? Напишите
уравнения реакций и назовите полученные вещества. Что такое ржавчина и как она образуется? Ответ: 1) 3Fе + 2О2 = Fе3О4 (FеО • Fе2O3) - железная окалина 2) 2Fе + 3Сl2 = 2FеС13 - хлорид железа (III) 3) Fе + S = FеS - сульфид железа (II) Образование ржавчины: 4Fе + 3О2 + 6Н2О = 4Fе(ОН)з  Fе (ОН)3 + х Н2О = Fе (ОН)3 • х Н2О 5 вопрос: С какими сложными веществами реагирует железо? Напишите уравнения реакций и назовите их продукты. Ответ: 1) с водой при нагревании 3Fе + 4Н2О = Fе3О4 + 4Н2  (образуется железная окалина и выделяется водород) (образуется железная окалина и выделяется водород) 2) с растворами кислот Fе + 2НС1 = FеС12 + Н2  (хлорид железа (II) и водород) (хлорид железа (II) и водород) Fе + 4HNOз (разб.) = Fе(NOз)з + NО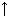 + 2Н2О (нитрат железа (III), оксид азота (II), вода) + 2Н2О (нитрат железа (III), оксид азота (II), вода) 3) c концентрированными кислотами HNOз и H2SО4 при обычной температуре железо пассивируется; при нагревании: 2Fе + 6H2SО4(конц.) = Fе2(SО4)3 + 3SО2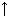 + 6Н2О (сульфат железа (III), оксид серы (IV), вода) + 6Н2О (сульфат железа (III), оксид серы (IV), вода) Fе + 6HNOз (конц.) = Fе(NOз)з + 3NО2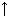 + 3Н2О (нитрат железа (III), оксид азота (IV), вода) + 3Н2О (нитрат железа (III), оксид азота (IV), вода) 4) с растворами солей менее активных металлов Fе + СuSО4 = FеSО4 + Сu (сульфат железа (II), медь) 6 вопрос: Какие гидроксиды образует железо? Укажите их кислотно-основный характер. Напишите уравнения реакций, характерных для гидроксидов железа (+2) и (+3). Ответ: Fе(ОН)2 - основание и Fе(ОН)3 - более слабое основание (амфотерное) | Fе (ОН)2 + 2НС1 = FеСl2 + 2Н2О Fе (ОН)2 + NаОН  | Fе (ОН)3 + 3НС1 = FеСl3 + 3Н2О Fе (ОН)3 + NаОН = Nа[Fе(ОН)4] | 7 вопрос: Почему гидроксид железа (II) со временем становится бурым? Ответ: Соединения Fе+2 нестойки и со временем на воздухе окисляются до Fе +3: | 4 Fе (ОН)2 + О2 + 2 Н2О = 4 Fе (ОН)з 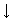 | | Зеленый | бурый | 8 вопрос: Какие вы знаете качественные реакции на ионы железа +2 и +3? Напишите уравнения реакций в молекулярной и ионной форме. Ответ (сопровождается демонстрационными опытами).  9 вопрос : Какова биологическая роль железа и его соединений? Примерный ответ: Железо - это биогенный элемент. Он входит в состав гемоглобина, миоглобина, различных ферментов и других сложных железо-белковых комплексов, которые находятся в печени и селезенке. В организме взрослого человека имеется 4-5 г железа, из них 65% - в крови. Железо стимулирует функцию кроветворных органов. Красный пигмент крови – гемоглобин – осуществляет перенос кислорода от органов дыхания к тканям и обратный перенос углекислого газа от тканей к легким. Много железа содержится в коровьем и козьем молоке, яичном желтке. У растений железо в порфиринах, которые отвечают за синтез хлорофилла. При недостатке железа растения не образуют хлорофилла (что разрушает процесс фотосинтеза), теряют возможность ассимилировать углекислый газ и выделять кислород, у животных и человека развивается анемия (малокровие). Основные источники железа: Зеленные овощи; Яичный желток; Печень; Горошек зеленый; Томаты сырые; Капуста; Чеснок; Яблоки, груши; Земляника; Сухофрукты. Тест “Порядок ли у вас с железом”. На вопросы отвечайте либо “да”, либо “нет”. 1. Часто ли вы чувствуете усталость и подавленность? 2. Произошли ли у вас в последнее время изменения кожи, волос и ногтей? 3. Теряли ли вы в последнее время много крови? 4. Занимаетесь ли вы профессиональным спортом? 5. Вы редко или совсем не едите мясо? 6. Выпиваете ли вы более трех чашек чая или кофе в день? 7. Вы едите мало овощей? Если на большинство вопросов вы ответили “нет”, то ваш организм в достаточной степени обеспечен железом.
3. Применение зун. Выполнение упражнений в тетради и на доске. Упр.1: Составьте уравнения реакций к схеме: 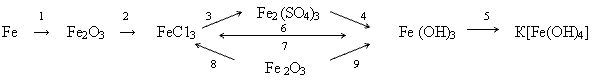 Выполнение: 4Fе + 3О2 = 2Fе2О3 Fе2О3 + 6НС1 =2FеС13 + 3Н2О 2FеС13 + 3Аg2SО4 = Fе2(SО4)3+ 6 AgCl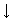 Fе2(SО4)3 + 6NаОН = 2Fе(ОН)3 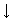 + 3Nа2SО4 + 3Nа2SО4 Fе(ОН)3 + КОН = К [Fе(ОН)4] FеС13 + 3NаОН = Fе(ОН)3  + 3NаСl + 3NаСl Fе(ОН)3 + 3НС1 = FеС13 + 3Н2О Fе2О3 + 6НС1 = 2FеС13 + 3Н2О 2Fе(ОН)3 = Fе2О3 + 3Н2О Упр. 2: Методом электронного баланса составьте уравнения, протекающие по схемам: 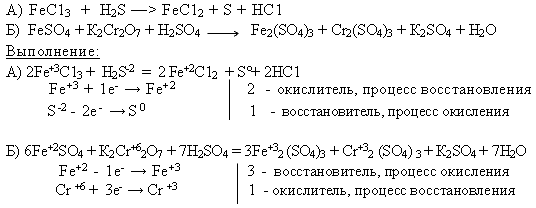 4. Задача: На сколько граммов увеличится масса железной пластинки, опущенной в раствор СиS04, если при этом на пластинке оказалось 20,8 г металлической меди? 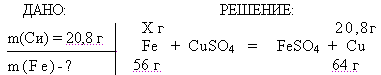 Х г - 20,8 г 56 г — 64 г Х = 18,2 г железа растворилось = m (Fе) увеличилась на 20,8 г-18,2 г = 2,6 г ОТВЕТ : 2, 6 г. 5. Проверка зун. Индивидуальное выполнение тестов на местах. 6. Подведение итогов урока. Оценки учащимся. Домашнее задание. П. 83-84, записи в тетради, стр. 292 №2.
|