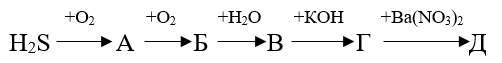Определите химическое количество (моль) ионов, образующихся при полной диссоциации соли MgBr2 химическим количеством 0,2 моль.
Смешали водные растворы, содержащие 0,1 моль BaCl2 и 0,05 моль K2SO4. Какие ионы будут присутствовать в полученном растворе?
К раствору массой 294 г с массовой долей серной кислоты, равной 5 %, добавили раствор массой 560 г, в котором массовая доля гидроксида калия составляет 0,04. Определите окраску индикатора лакмуса в растворе после реакции.
Между какой(ими) парой(ами) веществ в водном растворе будет протекать химическая реакция обмена?
А) BaCl2 и NaOH
Б) Ba(OH)2 и NaCl
В) Ba(NO3)2 и Na2SO4
Г) Na2SO4 и AgNO3
Д) KOH и Na2SO4
Выберите пары веществ, между которыми возможно протекание необратимых химических реакций в водных растворах: а) FeCl3 и Ba(OH)2; б) CuSO4 и АgNO3; в) Na2CO3 и HNO3; г) CuCl2 и NaNO3; д) NaNO3 и H2S.
Составьте молекулярные уравнения возможных реакций; для реакции, идущей с образованием газа, напишите полное и сокращённое ионные уравнения.
6. Осуществите следующую цепочку превращений, составьте уравнения реакций в молекулярной форме. Подпишите названия продуктов реакции.
CuSO4 → Cu(OH)2 → CuO → CuCl2
7. Укажите пары ионов, которые не могут одновременно существовать в растворе в больших количествах:
а) Ва²⁺ и Сl⁻; в) Na⁺ и SO₄²⁻; д) Fe3⁺ и OH⁻.
б) Al3⁺ и OH⁻; г) Ca²⁺ и CO₃²⁻
8. К раствору массой 56 грамм с массовой долей гидроксида калия 10% добавили раствор соляной кислоты массой 100 грамм с массовой долей HCl 20%. Какая среда будет у полученного раствора?
9. Для сокращенного ионного уравнения запишите соответствующие ему уравнения в молекулярной и полной ионной формах. Cu(OH)2 + 2H+ = Cu2+ + 2H2O
10. Укажите, чему равен объём углекислого газа, выделившегося при взаимодействии 200 г карбоната кальция с 73 г соляной кислоты.
11. Для нейтрализации гидроксида натрия был затрачен раствор серной кислоты массой 12,25г с массовой долей кислоты 20%. Определите массу полученной соли.
12. Осуществите следующую цепочку превращений, составьте уравнения реакций в молекулярной форме. Подпишите названия продуктов реакции.
BaO → Ba(OH)2 → BaCl2 → BaSO4
13. Определите сумму молярных масс веществ В и Д, образовавшихся в результате превращений, протекающих по схеме:
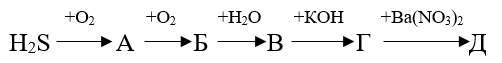
14. Водород какой массы (г) потребуется для получения аммиака химическим количеством 3,6 моль, если выход аммиака составляет 90 %?
15. Какие ионы могут одновременно присутствовать в водном растворе в заметных количествах:
а) Ag+ и I-; б) Fe3+ и OH-;
в) Al3+ и NO3-; г) Ba2+ и SO42-.
16. Сумма коэффициентов одной из реакций, представленных приведенными ниже схемами, равна 4. Определите схему:
а) Ba+H2O→ б) Zn+O2→ в) Mg+H2SO4→ г) Fe+Cl2 →
17. Определите массу серной кислоты с массовой долей кислоты 10% , которая расходуется на взаимодействие с алюминием, если известно, что в результате реакции выделился водород (н.у.) объемом 3,36 дм3.
18. Составьте уравнения реакций согласно схеме превращений. Для превращения 3 напишите полное и сокращённое ионные уравнения. В окислительно-восстановительной реакции 1 расставьте коэффициенты методом электронного баланса, укажите окислитель и восстановитель.
1 2 3 4
Zn → ZnO→ZnSO4→ Zn (OH)2→ZnCl2
19. Углерод массой 3 г. сожгли, полученный газ пропустили через раствор массой 400 г. с массовой долей гидроксида бария 12%. Образовавшаяся соль используется в производстве оптического стекла, керамической плитки, фарфора и глазурей, для получения изоляционных материалов. Определите массу этой соли (г) и назовите ее.
20. Определите массу хлорида калия, полученного при взаимодействии калия массой 0,78 г. и хлора, объем которого составляет 0,5 дм3 (н.у.).