ГПОУ «Новокузнецкий техникум строительных технологий и сферы обслуживания»
Заменитель сахара аспартам как токсичное вещество
Работа на конкурс «Творческий поиск»
Номинация: Математика, информатика и естественные науки
Автор: Калимов Степан,
ИСО1-16
Руководитель: Слюсарь
Кристина Сергеевна,
преподаватель химии,
биологии и естествознания
Новокузнецк 2017
Оглавление
Стр.
Введение…………………………………………………………………….….. 3
Глава 1. Аспартам – заменитель сахара ………………….…………………...4
История открытия аспартама…………………………………………...4
Состав и свойства аспартама ………………….…………...……..…….4
Применение аспартама……………………………………………….….5
Производные аспартама…………………………………………………5
Глава 2. Изучение свойств аспартама ……………………………….………..9
2.1. Качественная реакция на метанол………….…………………………….9
2.2. Качественная реакция на метаналь……………………………………….10
Заключение……………………………………………………………..……….11
Список литературы………………………………………………………..……12
Приложение 1. Результаты социологического опроса обучающихся ГПОУ НТСТиСО
Введение
Аспартам является вторым по популярности подсластителем и входит в состав огромного количества продуктов и напитков, в том числе: безалкогольных напитков, горячего шоколада, жевательных резинок, конфет, йогуртов, заменителей сахара, витаминов, таблеток против кашля и многого другого. Проведенный нами социологический опрос обучающихся ГПОУ НТСТиСО показал, что студенты регулярно употребляют аспартам в составе этих продуктов, но совершенно не знают о его свойствах и не задумываются об этом.
В России аспартам (Е 951) официально разрешен к применению в качестве пищевой добавки, а метанол и формальдегид – запрещены и признаны сильнейшими ядами. Однако в организме человека аспартам гидролизуется и одним из продуктов гидролиза является метанол, который в дальнейшем окисляется до формальдегида и муравьиной кислоты. Значит, аспартам тоже является ядом и его производство и применение в качестве пищевой добавки необходимо запретить.
Исходя из выше изложенного целью данной работы является исследование аспартама как токсичного вещества.
Данная цель достигается путем решения следующих задач:
изучить состав и свойства аспартама и продукты его гидролиза;
экспериментально проверить наличие метанола и формальдегида в напитках, содержащих в своем составе аспартам.
Объектом исследования является заменитель сахара аспартам, предметом – токсические свойства аспартама.
В качестве рабочей нами была принята следующая гипотеза: аспартам является источником смертельно ядовитого метанола в организме.
В ходе работы использовались такие методы исследования как анализ литературных источников, эксперимент, наблюдение, сравнение, анализ.
Глава 1. Аспартам – заменитель сахара
История открытия аспартама
Аспартам был открыт в 1965 г. Джеймсом М. Шлаттером, химиком, работавшим на компанию Сёрл (G.D. Searle & Company). Шлаттер синтезировал аспартам в ходе исследований для производства лекарств от язвы. Он обнаружил сладкий вкус аспартама случайно, облизнув палец, на который попал аспартам [3,1]. Первыми стали применять аспартам США и Великобритания — с 1981 года. Выпускаемый под различными торговыми марками (например, Equal, Spoonful), аспартам объявлен альтернативой сахару, позволяющей не набирать вес и официально не являющийся канцерогеном (в чём подозревался используемый ранее искусственный подсластитель — сахарин).
Состав и свойства аспартама
Систематическое наименование (номенклатура ИЮПАК): L-Аспартил-L-фенилаланина метиловый эфир
Состав молекулы: C14H18O5N2
Молярная масса: 294,301 г/моль
Температура плавления: 246–247 °C
Структурная формула:
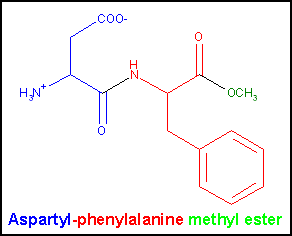
Аспартам - кристаллическое вещество белого цвета, без запаха, хорошо растворимое в воде, примерно в 160—200 раз слаще сахара. Несмотря на то, что этот подсластитель, как и белки, имеет калорийность 4 ккал/г, для создания сладкого вкуса необходимо небольшое количество аспартама, поэтому его вклад в калорийность пищи не принимается в расчет. По сравнению с сахаром вкусовое ощущение сладости от аспартама медленнее появляется и дольше остается. При нагреве аспартам разрушается, поэтому не пригоден для подслащивания продуктов, подвергаемых термообработке. Распадается в организме человека на метанол и две протеиногенных аминокислоты: аспарагиновую и фенилаланин [1,3].
Гидролиз аспартама: C14H18O5N2 → C9H11O2N + C4H7O4N + CH3OH
Аспартам фенилаланин аспарагиновая метанол
кислота
Применение аспартама
Аспартам выпускается под различными торговыми марками как отдельно, так и в составе смесей сахарозаменителей. Аспартам является вторым по популярности подсластителем и входит в состав огромного количества продуктов и напитков, в том числе: безалкогольных напитков, горячего шоколада, жевательных резинок, конфет, йогуртов, заменителей сахара, витаминов, таблеток против кашля и многого другого.
Производные аспартама
Метиловый спирт
Метиловый спирт (древесный спирт, карбинол, метилгидрат, гидроксид метила). CH3OH, простейший одноатомный спирт, бесцветная ядовитая жидкость[1,16].
Состав молекулы: СН4О
Температура кипения: 64,7 °C
Структурная формула:
 [1,12]
[1,12]
Метанол смешивается в любых соотношениях с водой и большинством органических растворителей[1,34].
При окислении метанола образуется формальдегид (метаналь), далее – муравьиная кислота:

метанол метаналь муравьиная кислота
Метанол — яд, действующий на нервную и сосудистую системы. Токсическое действие метанола обусловлено так называемым «летальным синтезом» — метаболическим окислением в организме до очень ядовитого формальдегида[1,12]. Приём внутрь 5—10 мл метанола приводит к тяжёлому отравлению (одно из последствий — слепота), а 30 мл и более — к смерти. Особая опасность метанола связана с тем, что по запаху и вкусу он неотличим от этилового спирта, из-за чего и происходят случаи его употребления внутрь [2].
Формальдегид
Формальдегид (от лат. formica — муравей), устаревшее — муравьиный альдегид (CH2=O) , первый член гомологического ряда алифатических альдегидов. Альдегид муравьиной кислоты.
Состав молекулы: СН2О
Температура кипения: -19 °C
Структурная формула:

Газообразное бесцветное вещество с острым запахом.
Формальдегид образуется в организме путём окисления метанола. Обладает токсичностью, негативно воздействует на генетический материал, репродуктивные органы, дыхательные пути, глаза, кожный покров. Оказывает сильное действие на центральную нервную систему. Смертельная доза 35 % водного раствора формальдегида (формалина) составляет 10 — 50г [3,19].
Водный раствор формальдегида — формалин — свёртывает белки, поэтому он применяется для дубления желатина при производстве кинофотоплёнки. Используется для консервации биологических материалов (создание анатомических и других препаратов), а также в медицине, как антисептик (формидрон — аптечный препарат, смесь растворов формальдегида и одеколона).
Фенилаланин
Фенилалани́н — ароматическая альфа-аминокислота, существует в двух оптически изомерных формах — L и D. По химическому строению соединение можно представить как аминокислоту аланин, в к оторой один из атомов водорода замещён фенильной группой [1,56].
Состав молекулы: C9H11O2N
Температура плавления: 283 °C.
Структурная формула:
 [1,45].
[1,45].
L-фенилаланин входит в состав белков множества организмов, а также участвует в ряде важных биохимических процессов. Для человека фенилаланин является незаменимой аминокислотой, потому должен ежедневно поступать в организм в достаточном количестве с белками пищи[1,5].
При наследственном заболевании фенилкетонурии превращение фенилаланина в тирозин нарушено, и в организме происходит накопление фенилаланина и его токсических производных, повреждающих нервную систему.
Также фенилаланин является составной частью синтетического сахарозаменителя — аспартама, до недавнего времени активно использовавшегося в пищевой промышленности, чаще в производстве жевательной резинки и газированных напитков. Употребление таких продуктов противопоказано лицам, страдающим фенилкетонурией [1,7].
Аспарагиновая кислота
Аспарагиновая кислота (аминоянтарная кислота, аспартат, аминобутандиовая кислота) — алифатическая аминокислота, одна из 20 протеиногенных (незаменимых) аминокислот организма. Встречается во всех организмах в свободном виде и в составе белков [1,5].
Состав: C4H7O4N
Структурная формула:
 [1,56]
[1,56]
Аспаргиновая кислота плохо растворима в воде, не растворяется в органических растворителях.
Физиологическая роль:
присутствует в организме в составе белков и в свободном виде
играет важную роль в обмене азотистых веществ
участвует в образовании пиримидиновых оснований и мочевины
Сама кислота и её соли используются, как компоненты лекарственных средств. Аспаркам — таблетки, сумма солей — аспарагинатов калия и магния (аспарагинаты калия и магния), применяется в терапии сердечно-сосудистых расстройств [3,15].
Глава 2. Изучение свойств аспартама
Испытуемые образцы:
Образец№1 - Coca Cola zero (производитель Coca Cola journey)
Образец № 2 - Ирбис джинс «Ириска» (производитель ООО «Ирбис плюс», Россия)
Образец №3 – Аспартам в таблетках (производитель Novasweet, Россия)
2.1. Качественная реакция на метанол
Образцы №1,2 нагревали до 400 С, таблетки аспартама (образец №3) растворяли в горячей воде и проводили качественную реакцию на метанол: свёрнутую в спираль медную проволоку прокалили в пламени спиртовки до образования на ней чёрного налёта – оксида меди (II). Опустили раскалённую проволоку в образцы ( повторили несколько раз).
Наблюдали, что проволока очистилась от налёта, так как мель восстанавливается из оксида, а метанол превращается в метаналь, ощущался резкий специфический запах формальдегида. Опыт проводили под вытяжкой.
СН3ОН + CuO → Cu + CH2O
2.2. Качественная реакция на метаналь
Далее с полученным раствором проводили качественную реакцию на метаналь:
со свежеприготовленным гидроксидом меди (II): к гидроксиду меди (II) прилили исследуемые растворы и осторожно нагрели, цвет осадка изменился с синего на кирпично-красный (образуется оксид меди(I) во всех образцах, что доказывает наличие альдегидной группы в исследуемых веществах:
CH2O + 2Cu(OН)2→ Cu2О + CH2O2 + 2Н2О
реакцию «серебряного зеркала»: к аммиачному раствору оксида серебра прилили исследуемые растворы и осторожно нагрели, на стенках пробирки образовался тонкий налёт чистого серебра, что доказывает наличие альдегидной группы в исследуемых веществах:
CH2O + Ag2О → Ag + CH2O2
Вывод по эксперименту: во всех трех образцах мы выявили наличие аспартама и продукты его распада.
Заключение
Таким образом, в ходе проделанной работы мы изучили состав и свойства аспартама и продукты его гидролиза и экспериментально проверили наличие метанола и формальдегида в напитках, содержащих в своем составе аспартам.
В результате можно сделать следующие выводы:
Изучение химических свойств аспартама и продуктов его гидролиза, а также их физиологической роли в организме человека, позволяет сделать вывод о том, что по крайней мере три из них (фенилаланин, метанол, формальдегид) способны нанести существенный вред здоровью людей.
Социологический опрос обучающихся ГПОУ НТСТиСО показал, что современные подростки очень часто употребляют в пищу продукты, в которых используется аспартам как подсластитель.
Химический эксперимент подтвердил выдвинутую нами гипотезу и показал, что действительно при нагревании свыше 300С, в продуктах, содержащих аспартам, можно обнаружить такие ядовитые вещества как метанол и формальдегид. Так как температура тела человека выше 300С, то следует сделать вывод о том, что аспартам как источник ядовитых веществ вреден для здоровья человека и его необходимо избегать.
Список литературы
. Иванова, Ю.А. Гигиена питания [Текст] / Ю.А. Иванова. – Москва: София, 2003. – 457 с.
Озерная, О. С. Физиология пищеварения [Текст] / О.С. Озерная. – Санкт-Петербург: ОНИКС XXI век, 2008.- 76 с.
Самуйлова, Л. И. Биохимия пищеварения [Текст] /.Самуйлова Л. И., Пучкова Т.Е.- Москва: Гелеос, 2005.- 215 с.
Энциклопедия химии [Электронный ресурс]. – Электрон. дан. – Москва: Комминфо, 2012. – 1 эл. опт. диск (CD- ROM).
Интернет-ресурсы:
1. Исследовано в России [Электронный ресурс] : многопредмет. науч. журн. / Моск. физ.-техн. ин-т. – Электрон. журн. – Долгопрудный : МФТИ, 2011. – Режим доступа к журн. :http://zhurnal.mipt.rssi.ru. (дата обращения: 02.10.2015).
2.Петрова Л. Е. Правильное питание [Электронный документ] // Диетология.- 2010.- Т. 2, N 1.- С.26-43. (http://www.ecsoc.msses.ru/pdf/ecsoc003.pdf). (дата обращения 06.11.2015).






 [1,12]
[1,12] 
 [1,45].
[1,45]. [1,56]
[1,56]









