III глава
 Сабактын темасы: Заттардын массасынын сакталуу закону.
Сабактын темасы: Заттардын массасынын сакталуу закону.
Сабактын конкреттүү максаты: Заттын саны моль.Авогадро саны. Заттын абсолюттук массасы жөнүндө түшүнүк берип, заттарды түзүүчү бөлүкчөлөр жонүндөгү билимдерге таянып, затты түзүүчү бөлүкчөлөрдүн санын билүү боюнча көнүгүү иштөө менен түшүнүктөрдү калыптандыруу.Заттын саны – моль боюнча маалымат алышып көнүгүү иштешет. Заттардын курамына сандык, сапаттык анализ беришет.Көнүгүү иштешет.
Көрсөткүчтөр: Эгерде окуучу затты түзүүчү эӊ майда бөлүкчөнү ченеп алууга мүмкүн экендигин түшүнсө, ар түрдүү газдар бирдей көлөмдү ээлей тургандыгын билишсе, ошол билимди пайдаланып маселе, мисал иштей алышса, газдардын көлөмүн, андагы кармалган бөлүкчөлөрдү эсептеп чыгара алышса.Заттардын курамына сандык, сапаттык анализ бере алса.
С абакты уюштуруу: 1.Жаӊы теманы кабыл алууга окуучуларды даярдоо.
абакты уюштуруу: 1.Жаӊы теманы кабыл алууга окуучуларды даярдоо.
(чөйрө түзүү)
2.Өтүлгөн темалар боюнча кайталоо, жаны теманы кабыл үчүн көнүгүүлөр менен окуучуларды машыктыруу.Мисалы:
Мугалим окуучу менен бирдикте өтүлгөн темаларды эске түшүрүп жаӊы тема айтылат.
0,5моль HCI ( хлордуу суутек) ;
1,5 моль CO2 ( көмүртектин (IV)оксиди ;
0,1моль H2S күкүрттүү суутек;
0,01моль NH3 аммиакта канча молекула кармаалат? Бул заттардын курамына сандык жана сапаттык анализ бергиле?
Оозеки иштелүүчү тапшырмаалар аткарылат?
1моль O2 жообу: М(O2 ) = 32г/ моль
0,5моль O2 жообу: М(O2 ) = 16г/ моль
0,1моль O2 жообу: М(O2 ) = 3,2г/ моль
2 моль O2 молдук массасы канча ? жообу: М(O2 ) = 64г/ моль
Сабактын жүрүшү:
Сабактын темасы берилет: Заттардын массасынын сакталуу закону.
М угалим:
угалим:
Суроо: Реакциянын натыйжасында пайда болгон заттардын массасы өзгорөбү? ( окуучулар менен бирдикте суроо талкууланат)
окуучулар менен бирдикте суроо талкууланат)
Бул суроону талкуулоо үчүн окуучулар топко бөлүнүп текст менен иштешет:
Текст:

Топ: Химиялык айлануулар учурунда заттар өзгөруугө дуушар болуп, баштапкы заттардын курамы жана касиеттери боюнча айырмаланган жаӊы заттар пайда болот.Өткөн кылымдагы химик- окумуштуулар реакцияга кирген заттардын массалары менен реакциянын натыйжасында пайда болгон заттардын массалары айырмаланарын байкашкан. Чындыгында жыгачтын кесиндисин күйгүзүүдөн баштапкы затка салыштырганда аз массадагы күлдүн калдыгын алышкан. Тескерисинче темирди ысытканда массасы көбөйгөн. Реакция учурунда бөлүнүп чыккан жана реакцияга катышкан газдарды эске албагандыктан химик-окумуштуулар туура эмес жыйынтыктарды чыгарып келишкен. Буга мисал, англиялык химик Р.Бойль ачык ретортада ар кандай металлдарды кызарта ысытып , аларды ысытканга чейин жана ысыткандан кийин таразага тартып көрүп , металлдардын массасынын көбөйгөндүгүн байкаган. Бул тажрыйбаларга таянуу менен ал абанын ролун эсепке алган эмес, мына ошону менен заттардын массасы химиялык реакциялардын натыйжасында өзгөрөт деп туура эмес жыйынтыка келген. Р.Бойль металлды ысытканда металл менен кошулуп, массаны көбөйткөн “от материясы “ жашайт деп белгилеген

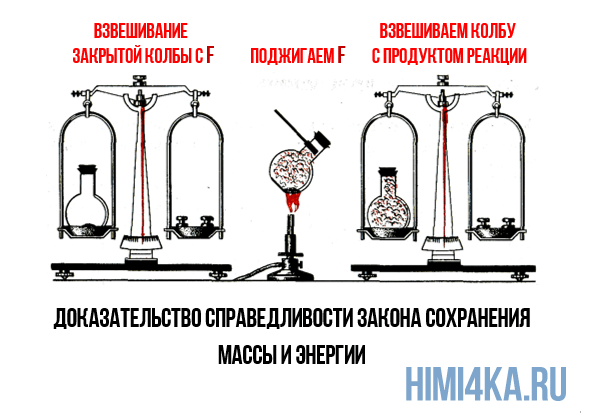
Эксперимент: Колбага бир аз кызыл фосфорду салып,оозун пробка менен бекитип,
аны таразага тартып алабыз. Андан кийин колбаны акырындык менен
ысытабыз. Колбада химиялык реакция жүрөт, да колбанын ичинде
коюу ак түтүн фосфордун(V) оксиди пайда болот. Андан кийин колбадагы
пайда болгон затты кайрадан таразага тартып көрөбүз. Колбадагы заттын массасы өзгөрбөйт. ( 32-сүрөт).
2-Топ: Орус окумуштуусу М.В. Ломоносов металлдарды ачык абада ысытпастан каӊдалган реторталарда ысыткан жана аларды ысытканга чейин , ысыткандан кийин таразага тартып алган.
3-Топ: Бул тажрыйбалардын натыйжаларын ал 1748 – жылы закон түрүндө мындайча жыйынтыктаган: “ Табияттагы болуучу бардык өзгөрүүлөрдүн негизи төмөнкүгө келип такалат, бир нерседен канча алынса, ошончо санда башка нерсе кошулат”. Бул закон азыркы убакта мындайча жыйынтыкталып айтылат:

Химиялык реакцияга кирген заттардын массасы , пайда болгон заттардын массасына барабар.
Мисалы: NaOH + HCI = NaCI + H2O
m1 + m2 = m3 + m4
m1, m2 – реакцияга кирген баштапкы заттардын массасы ;
m3, m4 - реакциянын натыйжасында пайда болгон заттардын массасы.
m1 + m2 = m3 + m4
4-топ: Мисалы метандын күйүү реакциясында реакцияга кирүүчү заттар: метан менен кычкылтек, пайда болгон заттар көмүртектин ( IV) оксиди жана суу.
CH4 + O2 = CO2 + H2O
Заттардын массасынын сакталуу законунун негизинде :
m1(СH4) + m2 (O2) = m3 (CO2) + m4(H2O)
Метан менен кычкылтектин массасы пайда болгон көмүртектин ( IV) оксиди жана суунун массасына барбар. Эгерде теӊдемени теӊдесек анда : 1 молекула метан 2 молекула кычкылтек менен кошулуп 1 молекула көмүртектин ( IV) оксиди жана 2молекула суу пайда болот.
СH4 + 2 O2 = CO2 + 2H2O
1атом “С” 1 атом “С”
4 атом “Н” 4 атом”Н”
4 атом “О” 4 атом “О”
Теӊдемени теӊдөө үчүн формуланын алдына коэфиценттер коюлат. Коэфицент – молекуланын санын аныктайт. М: 2H2O, 2 O2 , 3 Н2 .
Андан кийин окуу китебиндеги өз алдынча иштөө үчүн көнүгүүлөрдүн тапшырмасы аткарылат.
Сабак жыйынтыкталып, окуучулардын билимдери бааланат.







 Сабактын темасы: Заттардын массасынын сакталуу закону.
Сабактын темасы: Заттардын массасынын сакталуу закону.  окуучулар менен бирдикте суроо талкууланат)
окуучулар менен бирдикте суроо талкууланат)













